- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省师大附中高二下学期第八次学分认定(期末)考试化学试题 Word版
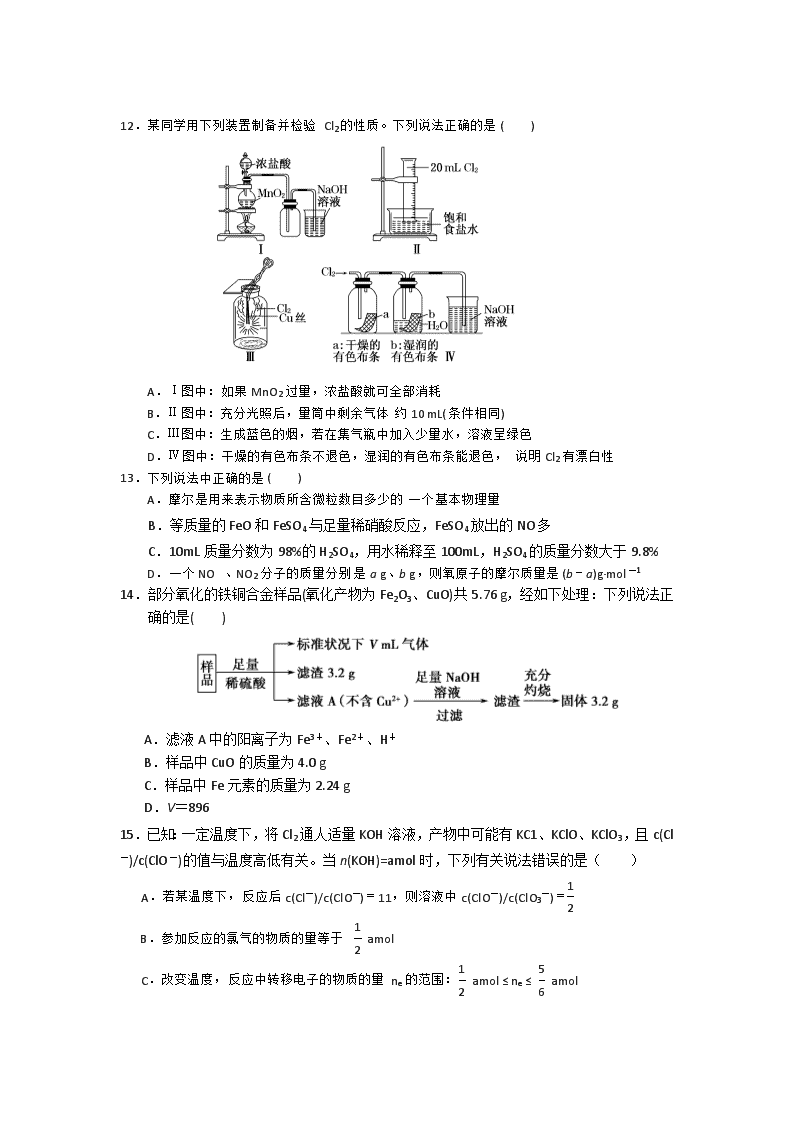
绝密 ★ 启用前 试卷类型A 2017-2018学年山东省师大附中高二下学期第八次学分认定(期末)考试化 学 试 题 命题人 陈自钦 审核人 庄绪上 本试卷分第Ⅰ卷和第Ⅱ卷两部分,满分为100分,考试用时90分钟。 注意事项: 1.答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、准考证号、考试科目填写在规定的位置上。 2.第Ⅰ卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。 3.第Ⅱ卷必须用0.5毫米黑色签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置;如需改动,先划掉原来的答案,然后再写上新的答案,不得使用涂改液,胶带纸、修正带和其他笔。 相对原于质量: H l C 12 O 16 Mg 24 Cl 35.5 Fe 56 Cu 64 Au 197 第Ⅰ卷(必做 共 45 分) 一、选择题(共15小题,每小题3分,共45分。每小题只有一个选项符合题意) 1.在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是( ) A.用量筒量取浓盐酸时俯视量筒刻度进行读数 B.溶解搅拌时有液体飞溅 C.定容时俯视容量瓶瓶颈刻度线 D.摇匀后见液面下降,再加水至刻度线 2. 标准状况下,a L氢气在过量的bL氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,则氯气的体积b为( ) A.2.24L B. 4.48L C.3.36L D.1.12L 3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( ) A.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA B.1mol FeCl3形成的 Fe(OH)3胶体中,胶体颗粒的数目为NA C.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA D.18g重水(D2O)所含的电子数为10NA 4.关于胶体和溶液的本质区别,下列叙述中正确的( ) A.溶液呈电中性,胶体带电荷 B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象 C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 D.溶液与胶体的本质区别在于分散质微粒直径大小 5.在下列有关离子共存的说法中,正确的是( ) A.能使pH试纸显蓝色的溶液中可能大量存在K+、Ba2+、Cl-、Br- B.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- C.含有大量Fe3+的溶液中可能大量存在SCN-、I-、K+、Br- D.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- 6.下述实验设计能够达到目的的是( ) ( ) 编号 实验目的 实验设计 A 除去Cl2中少量的HCl 将混合气体通过饱和NaHCO3溶液 B 除去FeCl2溶液中混有的FeCl3 向混合物中滴加适量铜粉,再过滤 C 检验溶液中是否含有Fe2+ 向溶液中滴入氯水后,再加KSCN溶液 D 证明Cl2的氧化性比I2强 将Cl2通人淀粉碘化钾溶液中 7.已知NH4CuSO3与足量的10 mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色 据此判断下列说法正确的是( ) A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化 C.刺激性气味的气体是氨气 D.1 mol NH4CuSO3完全反应转移0.5 mol电子 8.依据表中所给信息,结合已学知识所作出的判断中,不正确的是( ) 序号 氧化剂 还原剂 其他反应物 氧化产物 还原产物 ① Cl2 FeBr2 FeCl3 ② KMnO4 H2O2 H2SO4 O2 MnSO4 ③ KMnO4 HCl(浓) Cl2 MnCl2 A.反应①中的氧化产物不一定只有一种 B.反应③中浓盐酸既表现了还原性,又表现了酸性 C.由反应①③可推知:氧化性:KMnO4>Cl2>Fe3+ D.由反应②③可知:生成相同体积的Cl2和O2,消耗KMnO4的量相同 9.向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现血红色,由此得出下列的结论,错误的是( ) A.Fe3+的氧化性比溴的氧化性强 B.该晶体中一定含有SCN- C.Fe2+与SCN-不能形成血红色化合物 D.Fe2+被溴水氧化成Fe3+ 10.下列有关物质的分类和性质的叙述正确的是( ) ①酸性氧化物肯定是非金属氧化物 ②不能跟酸反应的氧化物一定能跟碱反应 ③碱性氧化物肯定是金属氧化物 ④分散系一定是混合物 ⑤浊液均可用过滤的方法分离 A.①③ B.③④ C.②④ D.④⑤ 11.下列表示对应化学反应的离子方程式正确的是( ) A.钠与水反应:Na +2 H2O=Na+ + H2↑ + 2OH- B.氯气溶于水:Cl2 + H2O = 2H+ + Cl-+ ClO- C.向Al2(SO4)3溶液中加入过量的NH3·H2O:Al3 ++4 NH3·H2O=[Al(OH)4]—+4NH4+ D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ 12.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( ) A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗 B.Ⅱ图中:充分光照后,量筒中剩余气体约10 mL(条件相同) C.Ⅲ图中:生成蓝色的烟,若在集气瓶中加入少量水,溶液呈绿色 D.Ⅳ图中:干燥的有色布条不退色,湿润的有色布条能退色,说明Cl2有漂白性 13.下列说法中正确的是( ) A.摩尔是用来表示物质所含微粒数目多少的一个基本物理量 B.等质量的FeO和FeSO4与足量稀硝酸反应,FeSO4放出的NO多 C.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% D.一个NO 、NO2分子的质量分别是a g、b g,则氧原子的摩尔质量是(b-a)g·mol-1 14.部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:下列说法正确的是( ) A.滤液A中的阳离子为Fe3+、Fe2+、H+ B.样品中CuO的质量为4.0 g C.样品中Fe元素的质量为2.24 g D.V=896 15.已知:一定温度下,将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KClO3,且c(Cl-)/c(ClO-)的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( ) A.若某温度下,反应后c(Cl-)/c(ClO-)=11,则溶液中c(ClO-)/c(ClO3-)= B.参加反应的氯气的物质的量等于 amol C.改变温度,反应中转移电子的物质的量ne的范围: amol ≤ ne ≤ amol D.改变温度,产物中KC1O3的最大理论产量为 amol 第Ⅱ卷(必做 共55分) 二、非选择题(本题包括5小题,共55分。) 16.(8分)某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的气态物质。 (1)装置A中发生反应的离子方程式为 。 (2)装置B中试剂Y应为_________________。 (3)已知在装置C中通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体(含氯氧化物),装置C中只有氯化钠和碳酸氢钠。若C中有0.1 mol Cl2参加反应,可推知C中反应生成的含氯氧化物为 (写化学式)。 (4)该实验装置中明显存在不足之处,改进的措施为 。 17.(12分)实验室里需用480 mL 0.5 mol·L-1的NaOH溶液。 (1)该同学应选择________ mL的容量瓶。 (2)其操作步骤如下图所示,则如图操作应在下图中的__________(填选项字母)之间。 A.②与③ B.①与② C.④与⑤ (3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。 附表 砝码规格 a b c d e 砝码大小/g 100 50 20 10 5 (4)下列操作对所配溶液的浓度偏大的有(填写下列序号)( ) ①转移完溶液后未洗涤玻璃棒和烧杯 ②容量瓶中原来有少量蒸馏水 ③摇匀后发现液面低于刻度线再加水 ④定容时观察液面俯视 18.(12分) 下图是有关FeSO4的转化关系 (无关物质已略去)。 已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。 (1) 气体X的成分是(填化学式)________。 (2) 反应Ⅰ的反应类型属于(填序号)________。 a.分解反应 b.复分解反应 c.置换反应 d.化合反应 e.氧化还原反应 (3) 溶液2中金属阳离子的检验方法是________________ __________。 (4) 若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅰ的化学方程式是 , 反应Ⅳ中生成FeSO4的离子方程式是 。 (5) 一瓶长期露置在空气中的FeSO4溶液,为检验其是否完全变质,则需要的试剂是 (填写名称) 。 19.(8分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。 (1)请将Au2O3之外的反应物与生成物分别填入以下空格内: (2)反应中,被还原的元素是______________,还原剂是___________。 (3)请将反应物的化学式配平后的系数填入下列相应的位置中,并标出电子转移的方向和数目。 (4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4 、NaCl和HCl,则还原剂与氧化剂的物质的量之比为______________。 20.[化学——选修3:物质结构与性质] (15分) 我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。 (1)Cu2+的未成对电子数有______个,H、O、S 电负性由大到小的顺序为_______。 (2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。 [Cu(NH3)4]SO4中化学键类型有___________,阴离子中心原子杂化类型为__________。 (3)铁铜合金晶体类型为_________;铁的第三(I3)和第四(I4)电离能分别为2957kJ·mol-1、5290kJ·mol-1,比较数据并分析原因__________________________________。 (4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为d g/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为a pm(1pm= 10-10cm)。则铜原子的半径为_____________cm(写出计算表达式)。 山东师大附中2016级第八次学分认定考试化学试题参考答案 一、选择题(本题包括15小题,每小题3分,共45分。每小题只有1个选项符合题意) 1-5, C C A D A 6-10,D D D A B 11-15,D B C C D 二、非选择题(本题包括5小题,共40分。) 16.(8分,每空2分) (1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2)饱和食盐水(或饱和氯化钠溶液) (3)Cl2O (4)在装置D后连接一尾气处理装置(或连接一盛有NaOH溶液的洗气瓶) 17. (12分,每空2分) (1)500 (2)C (3)10.0 c、d c (4) ④ 18. (12分,每空2分) (1) SO2、SO3 (2) a、e (3) 取少量溶液2中的溶液加入几滴KSCN试液,溶液变红色 (4) 2FeSO4Fe2O3+SO2↑+SO3 2Fe3+ + SO32-+ H2O =2Fe2++SO42-+ 2H+ (5)酸性高锰酸钾溶液 19. (8分) (1)Na2S2O3 H2O Na2S4O6 Au2O NaOH(2分) (2) Au Na2S2O3(每空1分) (3) (2分) (4) 1∶4(2分) 20. (15分) (1) 1 (2分); O、S、H(2分) (2) ①共价键、配位键、离子键(2 分,不全对扣一分,其它合理也可给分) sp3杂化(2分) (3) 金属晶体(2分) ;基态铁原子的价电子排布式为3d64s2,失去3 个电子后核外电子呈半充满稳定状态,因此I4远大于I3(2 分) (4) (3 分)查看更多