- 2021-07-02 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版 非选择题增分练 作业
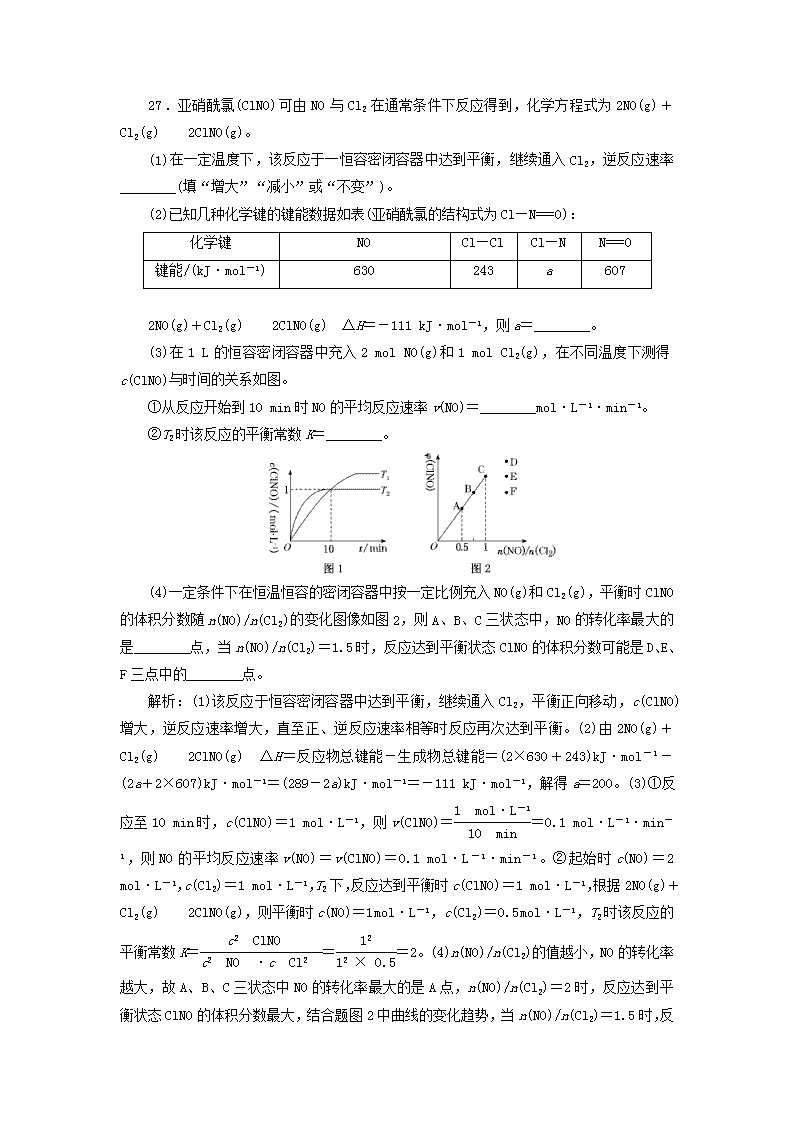
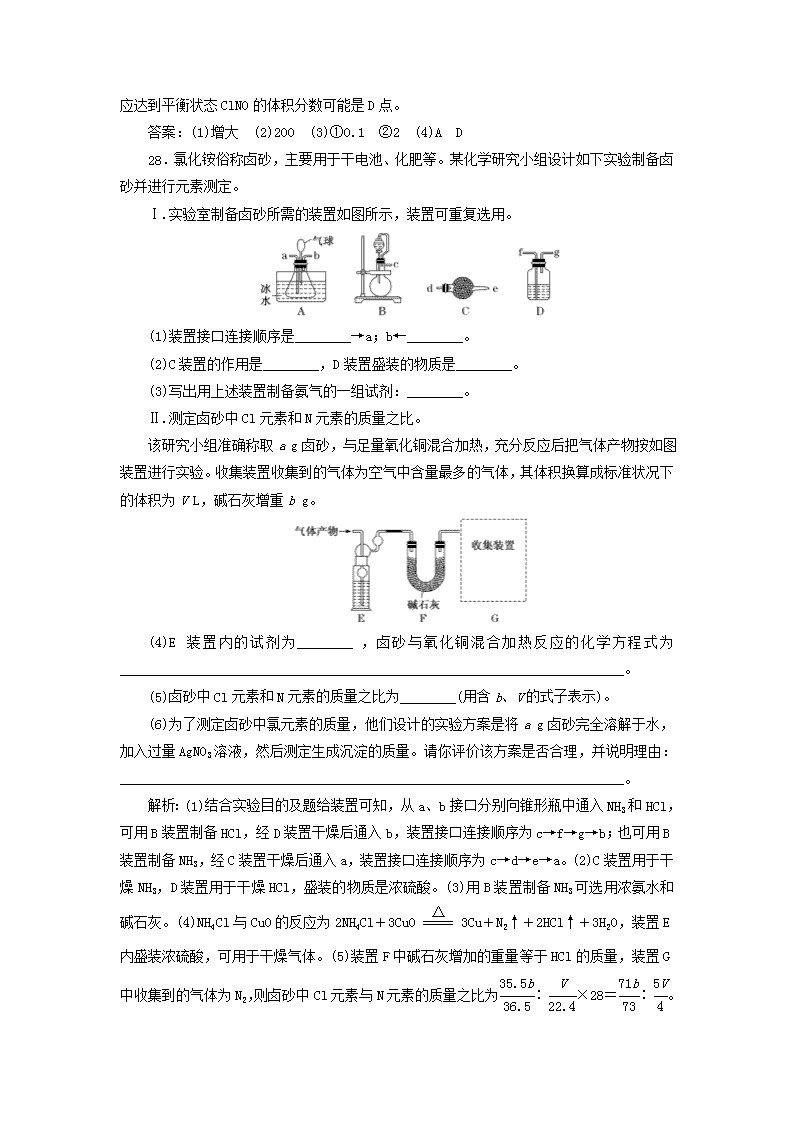
非选择题增分练 26.某科研小组采用如下方案回收废旧光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。 已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO===2NaCl+NaClO3 ②AgCl可溶于氨水: AgCl+2NH3·H2O===[Ag(NH3)2]++Cl-+2H2O ③常温时N2H4·H2O(水合肼)能还原[Ag(NH3)2]+:4[Ag(NH3)2]++N2H4·H2O===4Ag↓+N2↑+4NH+4NH3↑+H2O (1)“氧化”阶段需在80 ℃条件下进行,适宜的加热方式为________。 (2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________________________________________________________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是_________ ________________________________________________________________________。 (3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并________________。 (4)从“过滤Ⅱ”得到的滤液中获取单质Ag的过程中,在加入2 mol·L-1水合肼溶液后,后续还需选用的试剂有________(①1 mol·L-1 H2SO4溶液、②10%氨水、③1 mol·L-1 NaOH溶液,填序号)。反应完全后欲获取纯净的单质银需再进行的实验操作为________________________________________________________________________。 解析:(1)控制反应温度为80 ℃,可以选择水浴加热。(2)根据得失电子守恒、原子守恒配平化学方程式。HNO3也能氧化Ag,硝酸作氧化剂时通常被还原为有毒的氮氧化物而污染环境。(3)为提高Ag的回收率,需对过滤Ⅱ的滤渣进行洗涤(洗涤的目的是把滤渣表面残留的银氨配离子洗涤下来),并将洗涤后的滤液合并入过滤Ⅱ的滤液中。(4)“过滤Ⅱ”得到的滤液中含有银氨配离子,根据已知信息③,常温时N2H4·H2O(水合肼)能与[Ag(NH3)2]+反应产生氨气,氨气有强烈的刺激性气味,会污染空气,因此需要进行尾气吸收,可用硫酸吸收。完全反应后将混合物过滤、洗涤、干燥即可得到纯净的单质银。 答案:(1)水浴加热 (2)4Ag+4NaClO+2H2O4AgCl↓+4NaOH+O2↑ 会释放出氮氧化物,造成环境污染 (3)将洗涤后的滤液合并入过滤Ⅱ的滤液中 (4)① 过滤、洗涤、干燥 27.亚硝酰氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)2ClNO(g)。 (1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率________(填“增大”“减小”或“不变”)。 (2)已知几种化学键的键能数据如表(亚硝酰氯的结构式为Cl—N===O): 化学键 NO Cl—Cl Cl—N N===O 键能/(kJ·mol-1) 630 243 a 607 2NO(g)+Cl2(g)2ClNO(g) ΔH=-111 kJ·mol-1,则a=________。 (3)在1 L的恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图。 ①从反应开始到10 min时NO的平均反应速率v(NO)=________mol·L-1·min-1。 ②T2时该反应的平衡常数K=________。 (4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图2,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,反应达到平衡状态ClNO的体积分数可能是D、E、F三点中的________点。 解析:(1)该反应于恒容密闭容器中达到平衡,继续通入Cl2,平衡正向移动,c(ClNO)增大,逆反应速率增大,直至正、逆反应速率相等时反应再次达到平衡。(2)由2NO(g)+Cl2(g)2ClNO(g) ΔH=反应物总键能-生成物总键能=(2×630+243)kJ·mol-1-(2a+2×607)kJ·mol-1=(289-2a)kJ·mol-1=-111 kJ·mol-1,解得a=200。(3)①反应至10 min时,c(ClNO)=1 mol·L-1,则v(ClNO)==0.1 mol·L-1·min-1,则NO的平均反应速率v(NO)=v(ClNO)=0.1 mol·L-1·min-1。②起始时c(NO)=2 mol·L-1,c(Cl2)=1 mol·L-1,T2下,反应达到平衡时c(ClNO)=1 mol·L-1,根据2NO(g)+Cl2(g)2ClNO(g),则平衡时c(NO)=1 mol·L-1,c(Cl2)=0.5 mol·L-1,T2时该反应的平衡常数K===2。(4)n(NO)/n(Cl2)的值越小,NO的转化率越大,故A、B、C三状态中NO的转化率最大的是A点,n(NO)/n(Cl2)=2时,反应达到平衡状态ClNO的体积分数最大,结合题图2中曲线的变化趋势,当n(NO)/n(Cl2 )=1.5时,反应达到平衡状态ClNO的体积分数可能是D点。 答案:(1)增大 (2)200 (3)①0.1 ②2 (4)A D 28.氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。 Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。 (1)装置接口连接顺序是________→a;b←________。 (2)C装置的作用是________,D装置盛装的物质是________。 (3)写出用上述装置制备氨气的一组试剂:________。 Ⅱ.测定卤砂中Cl元素和N元素的质量之比。 该研究小组准确称取a g卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为V L,碱石灰增重b g。 (4)E装置内的试剂为________,卤砂与氧化铜混合加热反应的化学方程式为________________________________________________________________________。 (5)卤砂中Cl元素和N元素的质量之比为________(用含b、V的式子表示)。 (6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:________________________________________________________________________。 解析:(1)结合实验目的及题给装置可知,从a、b接口分别向锥形瓶中通入NH3和HCl,可用B装置制备HCl,经D装置干燥后通入b,装置接口连接顺序为c→f→g→b;也可用B装置制备NH3,经C装置干燥后通入a,装置接口连接顺序为c→d→e→a。(2)C装置用于干燥NH3,D装置用于干燥HCl,盛装的物质是浓硫酸。(3)用B装置制备NH3可选用浓氨水和碱石灰。(4)NH4Cl与CuO的反应为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O,装置E内盛装浓硫酸,可用于干燥气体。(5)装置F中碱石灰增加的重量等于HCl的质量,装置G中收集到的气体为N2,则卤砂中Cl元素与N元素的质量之比为∶×28=∶ 。(6)若NH4Cl样品纯净,其完全溶于水后,加入过量AgNO3溶液,溶液中的Cl-完全转化为AgCl,根据AgCl的质量可确定NH4Cl样品中Cl元素的质量;若NH4Cl样品不纯,混有的杂质离子也发生沉淀反应,则不能根据生成沉淀的质量确定NH4Cl样品中Cl元素的质量。 答案:(1)c→d→e g←f←c (2)干燥氨气 浓硫酸 (3)浓氨水和碱石灰(或其他合理答案) (4)浓硫酸 2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O (5)∶ (6)合理,氯化铵样品纯净,溶于水后其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯元素的质量(或不合理,氯化铵样品不纯,杂质离子也发生了沉淀反应) 35.[选修3:物质结构与性质] 赤血盐即K3[Fe(CN)6]易溶于水,主要应用于照相纸、颜料、制革、印刷、制药、肥料、媒染剂、电镀、造纸、钢铁等工业,其结构如图所示。 (1)写出基态Fe3+的核外电子排布式____________。 (2)K3[Fe(CN)6]中Fe3+与CN-之间的化学键是________。 (3)C、N的第一电离能的大小为C________N(填“>”“<”或“=”)。 (4)CN-中碳原子的杂化方式为________,写出CN-的一种含两种元素的等电子体:________。 (5)N2和C均为CN-的等电子体,C和Ca2+形成的晶体的晶胞结构如图所示,1个Ca2+周围距离最近的C数目为________。若该晶体中相邻的两个Ca2+之间的距离为a cm,阿伏加德罗常数的值为NA,该晶体的密度ρ=________(写出含a、NA的表达式)。 解析:(1)基态Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5。(2)K3[Fe(CN)6]中Fe3+提供空轨道,CN-提供孤对电子,因此Fe3+与CN-之间的化学键为配位键。(3)同周期元素从左向右,第一电离能呈增大趋势,且N的3p能级是半充满状态,因此N的第一电离能大于C的第一电离能。(4)CN-的结构中存在一个三键,其中有两个π键,用去两个p轨道,因此碳原子的杂化方式为sp杂化;等电子体的原子数、价电子总数均相等,又要求含两种元素,CO符合题意。(5)Ca2+的上、下、左、右、 前、后各有一个C,因此Ca2+周围距离最近的C的数目为6。相邻的两个Ca2+之间的距离为a cm,该晶胞的边长为a cm,体积V=(a)3 cm3,1个该晶胞中含有的Ca2+的数目为1+12×=4个,含有C的数目为8×+6×=4个,因此一个晶胞的质量为 g= g,密度ρ= g÷(a)3 cm3= g·cm-3。 答案:(1)1s22s22p63s23p63d5或[Ar]3d5 (2)配位键 (3)< (4)sp CO(其他答案合理即可) (5)6 g·cm-3 36.[选修5:有机化学基础] 聚醋酸乙烯酯(PVAc)可用于口香糖基料、制造玩具绒、无纺布;聚羟基乙酸(PGA)具有优异的生物降解性和生物相容性,是一类较重要的医用高分子材料。以下是由石油化工重要产品CxHy合成PVAc和PGA的流程图: (1)在CxHy的同系物中,所有碳原子一定共平面且分子中碳原子数最多的有机物的名称是____________________________________,A的结构简式为________________。 (2)G的官能团名称为________________。 (3)下列说法正确的是________。 a.CxHy和苯都能使溴水褪色,原理相同 b.②和④的反应类型相同,③与⑤反应本质不相同 c.C能与Na、NaOH、NaHCO3反应 d.PGA是比PVAc具有更好的环保性能的高分子材料 e.PVAc和PGA均可在酸性条件下水解产生小分子化合物 (4)I是D的同分异构体,与D具有相同官能团的还有________种(含顺、反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是______________________ __________________________________________________。 (5)写出反应⑤的化学方程式:_________________________________________________ __________________________________________。 (6)设计合成路线实现由F合成 (格式参考上述流程图)。 解析:(1)根据题意,结合流程图推出CxHy为乙烯,符合题意的烯烃的结构简式为,名称为2,3二甲基2丁烯。A能与银氨溶液反应,结合由A合成聚醋酸乙烯酯的流程可确定A为乙醛。(2)G的结构简式为,官能团的名称为羧基、溴原子。(3)苯萃取溴水中的溴而使溴水褪色,乙烯与溴发生加成反应而使溴水褪色,a错。反应②和反应④都是加成反应;反应③为加聚反应,反应⑤为缩聚反应,本质不相同,b正确。C的结构简式为,分子中的羟基、酯基与NaHCO3均不反应,c错。PGA是聚酯类高分子化合物,易发生水解反应,生物降解性能好,是具有更好环保性能的高分子材料;PVAc是聚烯类高分子化合物,分子中虽然存在酯基,但不在主链上,所以不易降解,环保性能较差,d正确。PVAc和PGA分子中均存在酯基,可在酸性条件下水解产生小分子化合物,e正确。(4)D的结构简式是CH2===CHOOCCH3,与D具有相同官能团的同分异构体有CH2===CHCOOCH3(1种)、CH3CH===CHOOCH(顺、反2种)、CH2===CHCH2OOCH(1种)、CH2===C(CH3)OOCH(1种),共5种;其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是。(5)反应⑤属于缩聚反应,化学方程式为nCH2OHCOOH (6)由目标产物的结构简式及已知信息可推出需要制取CH2OHCHO和CH2OHCOOH,F的结构简式为CH2BrCHO,F经氧化、取代得到CH2OHCOOH,F经取代得到CH2OHCHO。 答案:(1)2,3二甲基2丁烯 (2)羧基、溴原子 (3)bde (4)5 查看更多