- 2021-07-02 发布 |
- 37.5 KB |
- 11页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年福建省福州市八县(市)一中高二下学期期末联考化学试题 word版
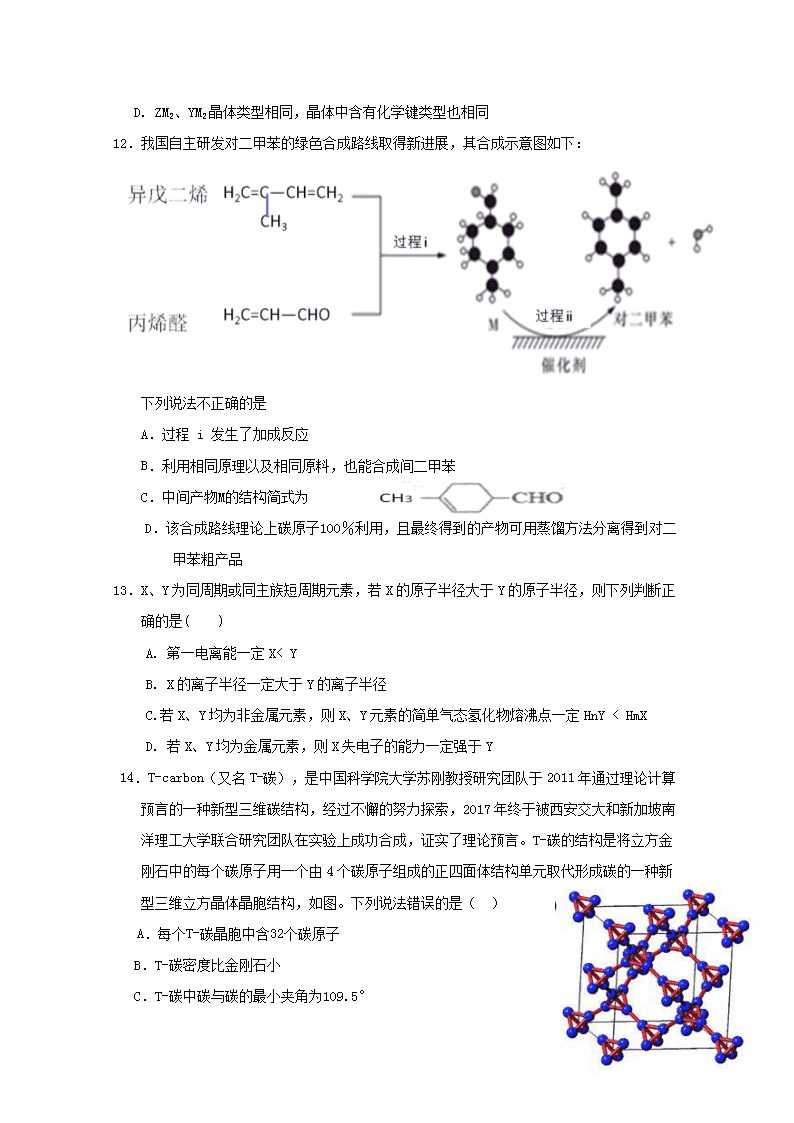
2018-2019学年第二学期八县(市)一中期末联考 高二化学试卷 考试时间:7月10日 完成时间:90分钟 满 分:100分 可能用到的相对原子质量:H—1 C—12 O—16 F—19 Na—23 Cl—35.5 一、单选题(每小题只有一个选项符合题意,每小题2分,共22小题,共44分) 1. 化学与生产、生活、科技、环境等密切相关。下列说法正确的是( ) A.“华为麒麟980”手机中芯片的主要成分是二氧化硅 B.高铁“复兴号”车厢连接关键部位使用的增强聚四氟乙烯板属于高分子材料 C.医用双氧水和酒精均可用于伤口清洗,两者消毒原理相同 D.“碳九”(石油炼制中获取的九个碳原子的芳烃)均属于苯的同系物,泄漏不会污染水体 2.下列说法正确的是( ) A.向鸡蛋清的溶液中加入浓的硫酸钠溶液或福尔马林,蛋白质的性质发生改变并凝聚 B.将牛油和烧碱溶液混合加热,充分反应后加入食盐水,上层析出甘油 C.氨基酸分子中都含有—COOH和—NH2 ,种类较多,为高分子化合物 D.淀粉、纤维素、麦芽糖在一定条件下可和水作用转化为葡萄糖 3.某链状烷烃的一个分子里含有9个碳原子,其一氯代物只有两种,该烷烃的名称是( ) A.正壬烷 B.2,6—二甲基庚烷 C.2,3,4—三甲基己烷 D.2,2,4,4—四甲基戊烷 4.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( ) A.第一电离能、电负性均是 Cl > S B.S2Cl2为含有极性键和非极性键的极性分子 C.S2Br2与S2Cl2结构相似,由于S—Cl键键能更大,S2Cl2熔沸点更高 D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl 5.下列脱水过程中不属于取代反应的是 ①高级脂肪酸与甘油脱水形成油脂 ②乙醇在浓H2SO4作用下脱水制乙烯 ③氨基酸在酶的作用下脱水形成二肽 ④葡萄糖在浓H2SO4作用下脱水成焦炭 A.①② B.②③ C.②④ D.①④ 6.如右下图是某原子晶体A空间结构中的一个单元。A与某物质B反应生成C,其实质是在每个A—A键中间插入一个B原子。则C物质的化学式为 ( ) A.AB B.AB2 C.A5B4 D.A2B5 7.设NA为阿伏加德罗常数的值。下列说法正确的是( ) A.标准状况下,11.2 LCH3Cl含极性键数目为2NA B.甲基的碳原子杂化轨道类型是sp2,每摩尔甲基含9NA电子 C.等质量的葡萄糖和乙酸所含碳原子数均为NA/30 D.有机物(右图)中最多有6个原子在同一直线上 8.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( ) A.实验室制取溴苯 B.实验室制取乙酸乙酯 C.石油分馏 D.实验室制取硝基苯 9.下列说法正确的是( ) A.乙烯和聚乙烯均能使溴水反应褪色 B.乙苯的同分异构体多于三种 C.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 D.葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 10.有机物 具有手性(连接的四个原子或原子团都不相同的碳原子叫手性碳,则该分子具有手性),发生下列反应后,分子一定还有手性的是( ) ①发生加成反应 ②发生酯化反应 ③发生水解反应 ④发生加聚反应 A.②③ B.①②④ C.②③④ D.①②③④ 11.有X、Y、Z、W、M五种短周期元素,原子半径依次减小,其中只有一种金属元素;X+与M2—具有相同的电子层结构;离子半径:Z2—>W—;Y的单质晶体熔点高、硬度大。下列说法中正确的是( ) A. X、M两种元素只能形成X2M型化合物 B. X 的氢化物熔点比W 的氢化物低 C. 元素W和M的某些单质可作为水处理中的消毒剂 D. ZM2、YM2晶体类型相同,晶体中含有化学键类型也相同 12.我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下: 下列说法不正确的是 A.过程 i 发生了加成反应 B.利用相同原理以及相同原料,也能合成间二甲苯 C.中间产物M的结构简式为 D.该合成路线理论上碳原子100%利用,且最终得到的产物可用蒸馏方法分离得到对二甲苯粗产品 13.X、Y为同周期或同主族短周期元素,若X的原子半径大于Y的原子半径,则下列判断正确的是( ) A. 第一电离能一定X< Y B. X的离子半径一定大于Y的离子半径 C.若X、Y均为非金属元素,则X、Y元素的简单气态氢化物熔沸点一定HnY < HmX D. 若X、Y均为金属元素,则X失电子的能力一定强于Y 14.T-carbon(又名T-碳),是中国科学院大学苏刚教授研究团队于2011年通过理论计算预言的一种新型三维碳结构,经过不懈的努力探索,2017年终于被西安交大和新加坡南洋理工大学联合研究团队在实验上成功合成,证实了理论预言。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体晶胞结构,如图。下列说法错误的是( ) A.每个T-碳晶胞中含32个碳原子 B.T-碳密度比金刚石小 C.T-碳中碳与碳的最小夹角为109.5° D.由于T-碳是一种蓬松的碳材料,其内部有很大 空间可供利用,可能可以用作储氢材料 15.配合物Co2(CO)8的结构如下图(已知Co是0价),该配合物中存在的作用力类型共有( ) ①金属键 ②离子键 ③共价键 ④配位键 ⑤氢键 ⑥范德华力 A . ②③④ B. ②③④⑥ C. ①③④⑥ D. ②③④⑤⑥ 16.热播电视剧《破冰行动》中曾经多次提到一种叫东莨菪碱(Scopolamine)的化学物质。东莨菪碱是1892年由E.施密特首先从东莨菪中分离出来,可用于麻醉、镇痛、止咳、平喘,对动晕症有效。但其毒性较强,稍一过量服用即可致命,具有极高的致幻作用,称为“魔鬼呼吸”。其结构如下图,下列说法不正确的是( ) A.分子间可以形成分子间氢键 B.东莨菪碱的化学式为C17H21NO4 C.该物质能发生加成、取代和氧化反应 D.可使用质谱仪测出这个分子的相对分子质量, 也可用紫外光谱确定这个分子的环状结构 17.已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应的水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系如图所示。下列说法不正确的是( ) A.从图中得出同浓度下W的最高价氧化物对应的 水化物的pH比Z小,故非金属性:W>Z B. X、Z的最简单气态氢化物在常温下可以反应生成离子化合物 C. X、Y、Z、W、M五种元素单质中Y常见单质熔点最高 D.简单离子半径大小顺序:X>M 18.为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法不正确的是( ) A B C D 被提纯物质 O2 (CO) 乙酸乙酯(乙酸) 酒精(水) 溴苯(溴) 除杂试剂 通过炽热的CuO 饱和碳酸钠溶液 生石灰 氢氧化钠溶液 分离方法 洗气 分液 蒸馏 分液 19.下列实验装置能达到其实验目的的是( ) A.用图甲所示装置制取少量H2 B.用图乙所示装置验证Na和水反应放热 C.用图丙所示装置分离Na2CO3溶液和CH3COOCH2CH3的混合物 D.用图丁所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 20.下列说法正确的是( ) A.过氧化铬(CrO5)的结构为: ,可推知CrO5中氧元素的化合价全部是-1价 B. 第三周期部分元素电离能如图所示,其中a、b、c分别代表的含义是I2、I3、I1 C.可以用如图实验装置图除去甲烷中混有的乙烯 D.银镜反应后试管壁上的银镜和黏附在试管壁上的油脂可分别用稀氨水、热碱液洗涤 21.实验室按如下装置测定纯碱(含少量NaCl)的纯度。下列说法不正确的是( ) A.滴入盐酸前,应将装置中含有CO2的空气排尽 B.装置①、④的作用是防止空气中的CO2进入装置③ C.必须在装置②、③间添加盛有饱和NaHCO3溶液的洗气瓶 D.反应结束时,应再通入空气将装置②中CO2转移到装置③中 22.有机物X的蒸气相对氢气的密度为51,X中氧元素的质量分数为31.5%,则能与NaOH溶液发生反应的X的同分异构体有(不考虑立体异构)( ) A.15种 B.14种 C.13种 D.12种 II 卷 二、填空题(共4大题,共56分) 23.(14分)有机物A(C6H12O2)具有果香味,可用作食品加香剂,还可用作天然和合成树脂的溶剂。 已知:① D、E具有相同官能团,E的相对分子质量比D大; ② E分子含有支链 ③ F是可以使溴的四氯化碳溶液褪色的烃。 (1) B的化学名称为____________;D的结构简式_____________。 (2) C、F分子中所含的官能团的名称分别是___________、______________。 (3) 写出有机物B生成C的化学反应方程式及反应类型: ___________________________________________________;反应类型是________。 (4) 写出有机物B与E反应生成A的化学反应方程式及反应类型: ___________________________________________________;反应类型是________。 (5) E的同分异构体中能同时满足下列条件的共有 种(不含立体异构) ,并写出任意一种符合条件的同分异构体结构简式__________________。 ①能与Na反应; ②能发生银镜反应。 24.(15分)第四周期的多数元素及其化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1) 基态Ti原子中,最高能层电子的电子云轮廓形状为 ,与Ti同周期的所有过渡元素的基态原子中, 写出任意一种最外层电子数与钛不同的元素外围电子排布式_____。 (2) 琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C 促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是 _____________________________ 。 (3) SCN— 可用于Fe3+的检验,写出与SCN— 互为等电子体的一种微粒: 。 (4) 成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如右图, As原子的杂化方式为 ___,雌黄和SnCl2在盐酸中反应转化 为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式: ________________________。SnCl4分子的立体构型为 。 (5)金红石(TiO2)是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构(晶胞中相同位置的原子相同)如图所示(注意:D不在体心): ①4个微粒A、B、C、D中, 属于氧原子的是________________。 ②若A、B、C原子的坐标分别为 A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c), 则D原子的坐标为D(0.19a,____, ____); 若晶胞底面边长为x,则钛氧键的键长 d=_______(用代数式表示)。 25.(12分)为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。 (1) 仪器C名称是___________,长导管作用是_____________________________。 (2)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏。若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。 (3)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是________。 (4)B中加入一定体积高氯酸和1.00g 氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。 ①下列物质不可代替高氯酸的是___________(填标号) a. 硫酸 b.硝酸 c.磷酸 d.乙酸 e.盐酸 ②D中主要反应的离子方程式为_________________________________。 (5)向馏出液中加入25.00mL0.1000mol·L-1La(NO3)3溶液,得到LaF3沉淀(La3+不发生其他反应),再用0.1000 mol· L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按 1︰1发生络合反应),消耗EDTA标准溶液平均19.80mL,则氟化稀土样品中氟的质量分数为______(百分数保留小数点后两位)。 26.(15分)短周期主族元素及其化合物在生产生活中至关重要。 (1)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R: 晶体Q中含有的化学键包括____________________。 (2) NF3与NH3的空间构型相同,但NF3不易与Cu2+等形成配位键,其原因是___________。 (3)PCl5是一种白色晶体,在恒容密闭容器中加热可在148 ℃液化,形成一种能导电的熔体,测得其中含有阴阳离子各一种,结构是正四面体型离子和正八面体型离子;正八面体型离子的化学式为_________________________;正四面体型离子中键角大于PCl3的键角原因为______________________________________________________。 (4)氯化钠的晶胞结构如图2所示,图3是氯化钠的晶胞截面图(图3中球大小代表半径大小)。已知NA代表阿伏加德罗常数的值,氯化钠晶体的密度为d g·cm-3。则Na+半径 为 pm(只需列出计算式)。 图2 图3 (5)砷化硼为立方晶系晶体,该晶胞中原子的分数坐标为: B: (0,0,0); (,,0);(,0,);(0,,);…… As:(,,);(,,);(,,);(,,);…… ①请在图中画出砷化硼晶胞的俯视图。 ②砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有______个。 2018-2019学年第二学期八县(市)一中期末联考 高二化学试卷参考答案 1 2 3 4 5 6 7 8 9 10 B D D C C B A A B C 11 12 13 14 15 16 17 18 19 20 C D D C C D A A B B 21 22 C C 23. (共14分) (1)乙醇(1分) CH3COOH(1分) (2) 醛基(1分)、碳碳双键(1分) (3)2CH3CH2OH+O2 2CH3CHO+2H2O (2分)氧化反应(1分) (4)CH3CH(CH3)COOH+CH3CH2OH CH3CH(CH3)COOCH2CH3+H2O(2分) 酯化反应(或取代反应) (1分) (5)5 (2分) HOCH2CH2CH2CHO(2分)(其余符合即可) 24(共15分)(1)球形 (1分) 3d54s1或3d104s1(1分) (2)Fe3+的3d5半满状态更稳定(1分) 合理即可给分 (3)①N2O(或CO2、CS2、OCN-) (2分) (4)sp3(1分) 2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑(2分)正四面体(1分) (5)①B、D; (2分)②0.81a ; 0.5c ; (2分)(2分) 25(12分)(1) (直形)冷凝管(1分) 平衡气压(1分) (2) 打开活塞K(2分) (3)保温,避免水蒸气冷凝(2分) (4)①bde(2分) ②HF+OH-=F-+H2O (2分) (5) 2.96% (2分) 26(15分)(1)共价键、配位键(2分) (2)F的电负性比N大,NF成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(2分) (3)PCl6— (1分);两者磷原子均采取sp3杂化,PCl3分子中P原子有一对孤电子对,孤电子和对成键电子对斥力更大,PCl4+中P没有孤电子对,正四面体形阳离子中键角大于PCl3的键角 (2分) (4) (2分)(必须用d表示密度) (5) (2分) 4 (2分) 12(2分)查看更多