- 2021-07-02 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2021届高考化学一轮复习卤族元素及其重要化合物 海水资源的开发和利用作业
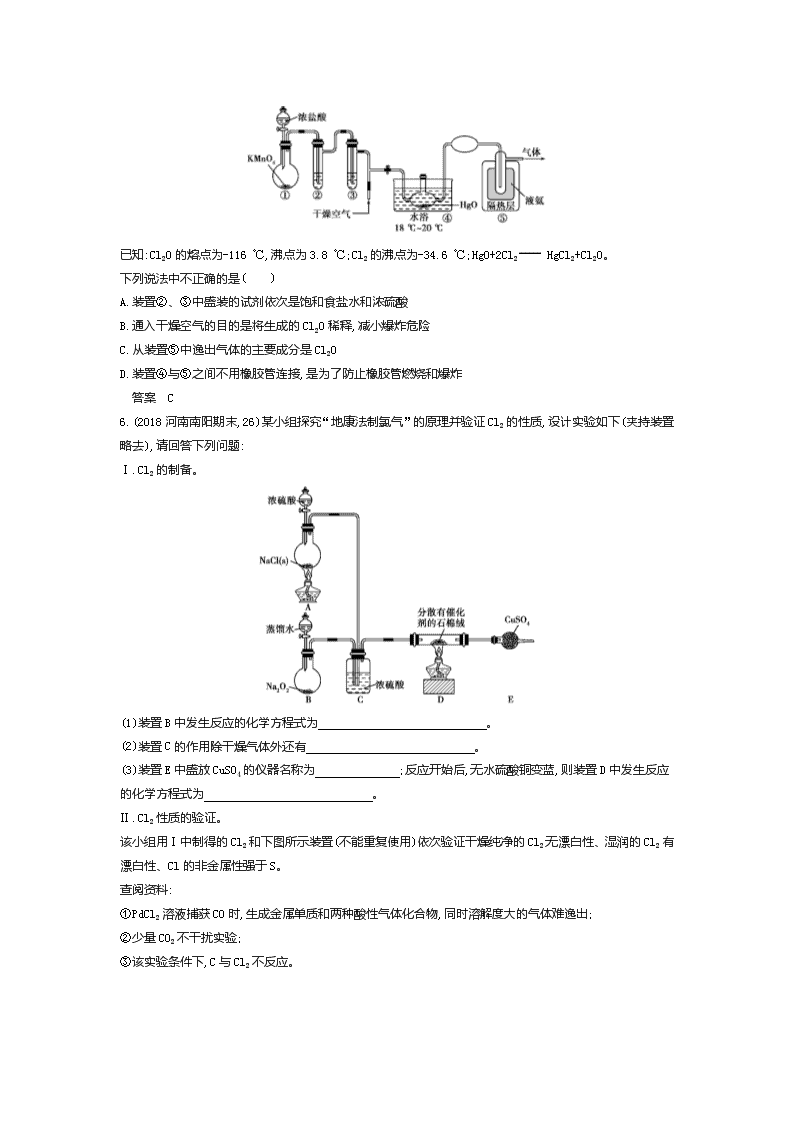
专题八 卤族元素及其重要化合物 海水资源的开发和利用 探考情 悟真题 【考情探究】 考点 内容解读 5年考情 预测热度 考题示例 难度 关联考点 氯及其化合物的性质 1.掌握Cl2及其重要化合物的主要性质和应用 2.掌握Cl2的实验室制法 2016课标Ⅰ,28,14分 中 电解原理的应用 ★★ 卤素性质的相似性和递变性 海水资源的开发利用 1.掌握ⅦA族内元素性质递变规律与原子结构的关系 2.了解海水资源的综合利用 2015课标Ⅱ,12,6分 中 粗盐提纯 ★★☆ 分析解读 卤素是典型的非金属元素,是高考的重点考查内容,试题通常以本专题知识为载体综合考查基本概念和基本理论,或与生产、生活、科技、医疗等各方面联系起来考查知识的灵活应用能力;对海水资源的开发利用的考查偶尔出现,多以选择题为主。今后高考对本专题的考查方式应基本不变。 【真题探秘】 破考点 练考向 【考点集训】 考点一 氯及其化合物的性质 1.(2019安徽合肥调研,2)下列物质性质与用途具有对应关系的是( ) A.Si的熔点高,可用作半导体材料 B.Cl2具有强氧化性,可用于漂白有色有机物质 C.Na2CO3溶液呈碱性,可用于洗涤油污 D.Al2O3硬度大,可用于制造耐火材料 答案 C 2.(2019四川成都毕业班摸底,5)酸化的KI-淀粉溶液中,加入(或通入)下列物质不能使溶液变蓝的是( ) A.Fe(OH)3胶体 B.漂白液 C.O2 D.生石灰 答案 D 3.(2020届西南地区名师联盟入学调研,13)实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4溶液,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( ) A.ClO2 B.Cl2O C.Cl2 D.Cl2O3 答案 A 4.(2020届辽宁六校协作体期初考试,7)ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。我国成功研制出利用NaClO2和稀盐酸反应制取ClO2的新方法。关于该反应,下列说法正确的是( ) A.在反应中NaClO2作氧化剂,稀盐酸作还原剂 B.反应中氧化产物和还原产物的物质的量之比为1∶4 C.在反应过程中溶液的酸碱性保持不变 D.在反应中每生成1 mol ClO2转移1 mol 电子 答案 D 5.(2018山东济宁教学质检,12)Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示。 已知:Cl2O的熔点为-116 ℃,沸点为3.8 ℃;Cl2的沸点为-34.6 ℃;HgO+2Cl2 HgCl2+Cl2O。 下列说法中不正确的是( ) A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸 B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险 C.从装置⑤中逸出气体的主要成分是Cl2O D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸 答案 C 6.(2018河南南阳期末,26)某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去),请回答下列问题: Ⅰ.Cl2的制备。 (1)装置B中发生反应的化学方程式为 。 (2)装置C的作用除干燥气体外还有 。 (3)装置E中盛放CuSO4的仪器名称为 ;反应开始后,无水硫酸铜变蓝,则装置D中发生反应的化学方程式为 。 Ⅱ.Cl2性质的验证。 该小组用Ⅰ中制得的Cl2和下图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S。 查阅资料: ①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物,同时溶解度大的气体难逸出; ②少量CO2不干扰实验; ③该实验条件下,C与Cl2不反应。 (4)按气流从左到右的方向,装置连接的合理顺序为E→G→K→ → → → → →尾气处理。(填装置字母) (5)试剂X的名称为 。 (6)装置J中发生反应的化学方程式为 。 (7)设计实验证明经净化后的Cl2中不含HCl: 。 答案 (1)2Na2O2+2H2O 4NaOH+O2↑ (2)控制气体的流速和比例,使气体混合均匀 (3)(球形)干燥管 4HCl+O2 2H2O+2Cl2 (4)J L H F I (5)硫化钠溶液 (6)PdCl2+CO+H2O Pd↓+CO2+2HCl (7)将净化后的气体通入足量CCl4,再与湿润的蓝色石蕊试纸接触,试纸不变红(或将净化后的气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HCl 考点二 卤素性质的相似性和递变性 海水资源的开发利用 1.(2020届四川成都摸底,11)教材中证明海带中存在碘元素的实验过程中,下列有关装置或操作错误的是( ) 答案 B 2.(2020届湖北名师联盟入学调研,5)通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是( ) 选项 现象 解释 A KI淀粉溶液中通入Cl2,溶液变蓝 Cl2能与淀粉发生显色反应 B 测得饱和NaA溶液的pH大于饱和NaB溶液 常温下水解程度:A->B- C 往乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性高锰酸钾溶液中,溶液紫红色褪去 证明乙烯能被酸性高锰酸钾溶液氧化 D 常温下,SO2能使酸性高锰酸钾溶液褪色 SO2具有还原性 答案 D 3.(2019四川顶级名校入学考试,12)下列依据相关实验得出的结论正确的是( ) A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 B.已知I3-I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯 D.向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤,可除去MgCl2溶液中的少量FeCl3 答案 D 4.(2019辽宁五校协作体联合模拟,8)南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( ) A.氯碱工业中采用阴离子交换膜可提高产品的纯度 B.工业生产中②常选用NaOH作为沉淀剂 C.由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干 D.④、⑤的目的是富集溴元素,溴元素在反应④、⑥中均被氧化,在反应⑤中被还原 答案 D 5.(2018河南、河北重点高中一联,12)用海水制盐工业中的母液来生产金属镁的一种工艺流程如下: 下列说法错误的是( ) A.上述工艺流程中未涉及置换反应 B.设计步骤①、②、③的主要目的是富集MgCl2 C.脱水时在HCl气氛中进行可防止MgCl2发生水解 D.电解得到的炽热镁粉可在二氧化碳气氛中冷却 答案 D 6.[2018河北“名校联盟”质监(一),12]已知:SO32-+I2+H2O SO42-+2H++2I-。某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列判断正确的是( ) A.不能肯定是否含有Cu2+ B.肯定不含NH4+ C.可能含 SO32- D.可能含有I- 答案 D 7.(2019陕西西安交大附中月考,30)某市场销售的食用精制盐包装袋上有如下说明: 产品标准 GB5461 产品等级 一级 配 料 食盐、碘酸钾、抗结剂 碘含量(以I计) 20~50 mg/kg 分装时期 分装企业 (1)碘酸钾与碘化钾在硫酸存在的条件下发生反应的化学方程式为 。 (2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。 (3)已知:I2+2S2O32-2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为: a.准确称取w g食盐,加适量蒸馏水使其完全溶解; b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全; c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全。 ①判断c中反应恰好完全依据的现象是 。 ②b中反应所产生的I2的物质的量是 mol。 ③根据以上实验和包装袋说明,所测精制盐的碘含量是 mg·kg-1。(以含w的代数式表示) 答案 (1)KIO3+5KI+3H2SO43K2SO4+3I2+3H2O (2)I2+SO32-+H2O2I-+SO42-+2H+ (3)①滴最后一滴溶液,溶液由蓝色恰好变为无色,且半分钟内不变色 ②1.0×10-5 ③1 2703w 炼技法 提能力 【方法集训】 方法 卤素离子的检验方法 1.(2020届吉林一中一调,20)对分别盛有不同无色溶液的①②③④四支试管进行如下操作,现象和结论对应正确的是( ) 操作 现象 结论 A 向①中先滴加BaCl2溶液再滴加盐酸 生成白色沉淀 原溶液中有SO42- B 向②中滴加氯水和CCl4,振荡静置 下层溶液呈橙色 原溶液中有I- C 向③中滴入NaHCO3溶液 有白色沉淀生成 原溶液中有AlO2- D 向④中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 试纸变蓝 原溶液中有NH4+ 答案 D 2.(2018辽宁六校协作体期中,12)下列关于物质或离子检验的推断正确的是( ) A.向X溶液中滴加KSCN溶液,溶液显红色,证明X溶液中有Fe3+,无Fe2+ B.用硝酸酸化Y溶液,无现象,再加入硝酸钡溶液,产生白色沉淀,则Y溶液中含有SO42- C.用玻璃棒蘸Z溶液在酒精灯上灼烧,火焰呈黄色,再透过蓝色钴玻璃观察火焰无紫色,则Z溶液中有Na+,无K+ D.用盐酸酸化W溶液,无现象,再向其中滴加AgNO3溶液,产生白色沉淀,则W溶液中含有Cl- 答案 B 3.(2018湖南五市十校教研教改共同体联考,11)某无色溶液中可能存在Na+、Mg2+、Fe3+、I-、CO32-、SO42-、Cl-中的几种,某学生进行了下列实验:①取少量原溶液,向其中滴加足量氯水,有无色无味气体产生,溶液仍为无色,再将溶液分为2份;②向其中一份溶液中加入AgNO3溶液,有白色沉淀产生;③向另一份溶液中加入BaCl2溶液,有白色沉淀产生。原溶液中一定大量存在的离子组是( ) A.Na+、Fe3+、SO42- B.CO32-、Cl-、SO42- C.Mg2+、I-、SO42- D.Na+、SO42-、CO32- 答案 D 【五年高考】 A组 统一命题·课标卷题组 考点一 氯及其化合物的性质 1.(2016课标Ⅲ,7,6分)化学在生活中有着广泛的应用,下列对应关系错误的是( ) 化学性质 实际应用 A. Al2(SO4)3和小苏打反应 泡沫灭火器灭火 B. 铁比铜金属性强 FeCl3腐蚀Cu刻制印刷电路板 C. 次氯酸盐具有氧化性 漂白粉漂白织物 D. HF与SiO2反应 氢氟酸在玻璃器皿上刻蚀标记 答案 B 2.(2016课标Ⅰ,28,14分)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 回答下列问题: (1)NaClO2中Cl的化合价为 。 (2)写出“反应”步骤中生成ClO2的化学方程式 。 (3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。“电解”中阴极反应的主要产物是 。 (4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为 ,该反应中氧化产物是 。 (5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数) 答案 (1)+3 (2)2NaClO3+SO2+H2SO4 2ClO2+2NaHSO4 (3)NaOH溶液 Na2CO3溶液 ClO2-(或NaClO2) (4)2∶1 O2 (5)1.57 考点二 卤素性质的相似性和递变性 海水资源的开发利用 3.(2015课标Ⅱ,12,6分)海水开发利用的部分过程如图所示。下列说法错误的是( ) A.向苦卤中通入Cl2是为了提取溴 B.粗盐可采用除杂和重结晶等过程提纯 C.工业生产中常选用NaOH作为沉淀剂 D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收 答案 C B组 自主命题·省(区、市)卷题组 考点一 氯及其化合物的性质 1.(2019江苏单科,6,2分)下列有关化学反应的叙述正确的是( ) A.Fe在稀硝酸中发生钝化 B.MnO2和稀盐酸反应制取Cl2 C.SO2与过量氨水反应生成(NH4)2SO3 D.室温下Na与空气中O2反应制取Na2O2 答案 C 2.(2017北京理综,8,6分)下列变化中,气体被还原的是( ) A.二氧化碳使Na2O2固体变白 B.氯气使KBr溶液变黄 C.乙烯使Br2的四氯化碳溶液褪色 D.氨气使AlCl3溶液产生白色沉淀 答案 B 3.(2015重庆理综,9,15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。 (1)仪器D的名称是 。安装F中导管时,应选用图2中的 。 (2)打开B的活塞,A中发生反应:2NaClO3+4HCl 2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。 (3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。 (4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。 (5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。 图3 答案 (15分)(1)锥形瓶 b (2)慢 (3)吸收Cl2 (4)4H++5ClO2- Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 (5)稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度 考点二 卤素性质的相似性和递变性 海水资源的开发利用 4.(2015北京理综,27,14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。 (1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式: 。 (2)在海洋碳循环中,通过如图所示的途径固碳。 ①写出钙化作用的离子方程式: 。 ②同位素示踪法证实光合作用释放出的O2只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整: + (CH2O)x+x18O2+xH2O (3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法: ①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。 ②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol·L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度= mol·L-1。 (4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。 ①结合方程式简述提取CO2的原理: 。 ②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。 答案 (14分)(1)CO2+H2O H2CO3、H2CO3 H++HCO3- (2)①2HCO3-+Ca2+ CaCO3↓+CO2↑+H2O ②xCO2 2xH218O (3)① ②x·yz (4)①a室:2H2O-4e- 4H++O2↑,H+通过阳离子膜进入b室,发生反应:H++HCO3- CO2↑+H2O ②c室的反应:2H2O+2e- 2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调至接近装置入口海水的pH C组 教师专用题组 考点一 氯及其化合物的性质 1.(2014浙江理综,12,6分)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系: Cl2(g)Cl2(aq) K1=10-1.2 Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4 HClO H++ClO- Ka=? 其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( ) A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9 B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-) C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差 D.氯处理饮用水时,在夏季的杀菌效果比在冬季好 答案 C 2.(2014江苏单科,19,15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下: Na2SO3溶液↓ Cl2↓ 含碘废液还原操作X 氧化 富集 … I2 ↓CCl4 (1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。 (2)操作X的名称为 。 (3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如下图所示)。 实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。 (4)已知:5SO32-+2IO3-+2H+ I2+5SO42-+H2O 某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在; 。 实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。 答案 (15分)(1)SO32-+I2+H2O 2I-+SO42-+2H+ 使CCl4中的碘进入水层 (2)分液 (3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液 (4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-。另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3- 3.(2013北京理综,28,15分)某学生对SO2与漂粉精的反应进行实验探究: 操作 现象 取4 g漂粉精固体,加入100 mL水 部分固体溶解,溶液略有颜色 过滤,测漂粉精溶液的pH pH试纸先变蓝(约为12),后褪色 ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 (1)Cl2和Ca(OH)2制取漂粉精的化学方程式是 。 (2)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。 (3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验: a.用湿润的碘化钾淀粉试纸检验白雾,无变化; b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。 ①实验a的目的是 。 ②由实验a、b不能判断白雾中含有HCl,理由是 。 (4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。 (5)将A瓶中混合物过滤、洗涤,得到沉淀X。 ①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是 。 ②用离子方程式解释现象ⅲ中黄绿色褪去的原因: 。 答案 (1)2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O (2)碱性、漂白性 (3)①检验白雾中是否含有Cl2,排除Cl2干扰 ②白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀 (4)向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色 (5)①CaSO4 ②SO2+Cl2+2H2O SO42-+2Cl-+4H+ 考点二 卤素性质的相似性和递变性 海水资源的开发利用 4.(2014福建理综,23,15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。 (1)与氯元素同族的短周期元素的原子结构示意图为 。 (2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。 a.Cl2、Br2、I2的熔点 b.Cl2、Br2、I2的氧化性 c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性 (3)工业上,通过如下转化可制得KClO3晶体: NaCl溶液NaClO3溶液KClO3晶体 ①完成Ⅰ中反应的总化学方程式: NaCl+ H2O NaClO3+ 。 ②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 。 (4)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如下图所示。 ①D是 (填离子符号)。 ②B A+C反应的热化学方程式为 (用离子符号表示)。 答案 (1) (2)b、c (3)①1NaCl+3H2O 1NaClO3+3H2↑ ②复分解反应 室温下,氯酸钾在水中的溶解度明显小于其他晶体 (4)①ClO4- ②3ClO-(aq) ClO3-(aq)+2Cl-(aq) ΔH=-117 kJ·mol-1 【三年模拟】 时间:45分钟 分值:90分 一、选择题(每题6分,共48分) 1.(2020届河南平顶山调研,9)某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是( ) A.装置中通入的a气体是Cl2 B.实验时应在装置A中通入a气体一段时间后,停止通入,改通入热空气 C.装置B中通入a气体前发生的反应为SO2+Br2+2H2OH2SO4+2HBr D.装置C的作用是吸收多余的二氧化硫气体 答案 D 2.(2020届福建永安一中期初考试,14)氢化亚铜(CuH)是一种难溶的物质,可用CuSO4溶液和“另一种物质”在40~50 ℃时反应来制备,CuH不稳定,它既能与HCl反应产生气体,又能在氯气中燃烧,以下有关判断不正确的是( ) A.CuH既可作氧化剂又可作还原剂 B.另一种物质一定具有还原性 C.CuH跟HCl反应的化学方程式为:2CuH+2HClCuCl2+2H2↑+Cu D.CuH在Cl2中燃烧的化学方程式为:CuH+Cl2CuCl+HCl 答案 D 3.(2020届吉林一中一调,23)下列所示物质的制备方法合理的是 ( ) A.实验室从海带中提取单质碘:取样→灼烧→溶解→过滤→萃取→蒸馏 B.以金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭TiCl4Ti C.从卤水中(溶质主要是MgCl2)提取Mg:卤水 Mg(OH)2MgCl2(aq) MgCl2(s) Mg D.由食盐制取漂粉精:NaCl(aq) Cl2漂粉精 答案 B 4.(2019山西五市期末,9)在制备和收集Cl2的实验过程中,下列装置正确的是( ) 答案 D 5.(2019安徽定远重点高中期末,1)ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示: 下列说法不正确的是( ) A.步骤a的操作包括过滤、洗涤和干燥 B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2 2ClO2-+O2+2H+ C.工业上可将ClO2制成NaClO2固体,便于贮存和运输 D.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收 答案 B 6.(2019河南许昌一模,11)下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。已知:2KMnO4+16HCl(浓) 2KCl+5Cl2↑+2MnCl2+8H2O。向KMnO4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。 下列有关说法正确的是( ) A.a处变蓝、b处变棕红,说明非金属性:Cl>Br>I B.c处先变红后褪色,说明Cl2与H2O反应生成HCl C.d处立即褪色,说明Cl2与H2O反应生成HClO D.e处变红,说明Cl2与Fe2+反应生成Fe3+ 答案 D 7.(2019辽宁六校协作体联考,11)海水开发利用的部分过程如图所示。下列说法不正确的是( ) A.操作X是蒸发、结晶、过滤、洗涤 B.操作Y是先将NH3通入饱和食盐水,再不断通入CO2 C.沉淀主要成分为Mg(OH)2 D.气体及滤液可用于制备纯碱 答案 C 8.(2018北京临川学校月考,16)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( ) A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO 答案 D 二、非选择题(共42分) 9.(2020届安徽合肥八校一联,19)(16分)下图是实验室制取少量无水AlCl3的实验装置,请回答下列问题: (1)A装置中发生反应的化学方程式: 。 (2)B装置中的化学试剂a为 ,其作用是 。 (3)F装置中的化学试剂b为 ,其作用(写出2条)是 ; 。 (4)若将B、C装置去除,使A装置直接与D装置相接,有人认为存在安全隐患,理由是 。 (5)装置D的出口导管不能过细,原因是 。 答案 (1)MnO2+2NaCl+3H2SO4(浓)MnSO4+2NaHSO4+Cl2↑+2H2O或MnO2+4NaCl+2H2SO4(浓)MnCl2+Cl2↑+2Na2SO4+2H2O (2)饱和食盐水 除Cl2中的HCl (3)碱石灰 吸收尾气,防止环境污染 防止空气中水蒸气进入E装置 (4)Cl2中混有的潮湿的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸 (5)防止AlCl3凝华成固体造成堵塞 10.(2020届江西名师联盟入学调研,19)(16分)KIO3是我国规定的食盐补碘剂,利用“KClO3氧化法”可制备KIO3,流程如下: 已知:“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。 (1)KIO3所含的化学键有 。 (2)逐出的Cl2可用 检验;“滤液”中的溶质主要是 ;“调pH”中所用的试剂是 。 (3)已知KIO3在水中的溶解度随温度升高而增大,则操作Ⅰ包含的操作应该是 、 、过滤。 (4)为测定“加碘食盐”中碘元素含量:①称取50.000 g食盐,配成250 mL溶液;②量取25.00 mL溶液于锥形瓶中,加入足量KI,并用少量稀硫酸酸化,使KIO3与KI反应完全;③以淀粉溶液为指示剂,用2.0×10-4 mol/L的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液体积为30.00 mL。已知:KIO3+KI+H2SO4K2SO4+I2+H2O(未配平),2Na2S2O3+I2Na2S4O6+2NaI。测定过程中,所需仪器在使用前必须检查是否漏液的有 。 (5)判断滴定终点的依据是 。 (6)配平KIO3+KI+H2SO4K2SO4+I2+H2O: 。 (7)该食盐中碘元素的含量是 mg/kg。 答案 (1)离子键和共价键 (2)湿润的KI淀粉试纸 KCl KOH溶液 (3)加热浓缩 冷却结晶 (4)容量瓶、滴定管 (5)溶液由蓝色变成无色,且30秒内无变化 (6)KIO3+5KI+3H2SO43K2SO4+3I2+3H2O (7)25.4 11.(2018河南、河北重点高中一联,18)(10分)亚氯酸(HClO2)是一种中强酸,易分解,亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。回答下列问题: (1)HClO2中氯元素的化合价为 ;亚氯酸不稳定,易分解为Cl2、ClO2和H2O,分解后的氧化产物与还原产物的物质的量之比为 。 (2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH- ClO2-+H2O在常温下的平衡常数K= 。 (3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:Cl2和ClO2溶于水后更易与SO2和NO反应。 ①亚氯酸盐脱除SO2的离子方程式为 。 ②pH越小,脱除率越大,其原因是 。 答案 (每空2分)(1)+3 6∶1 (2)1.1×1012 (3)①2SO2+ClO2-+2H2O 2SO42-+Cl-+4H+ ②亚氯酸盐的氧化性在酸性条件下较强,pH较小时有利于释放出ClO2及Cl2,ClO2和Cl2溶于水可提高脱除率查看更多