- 2021-07-02 发布 |
- 37.5 KB |
- 119页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届高考化学二轮复习离子反应课件(119张)
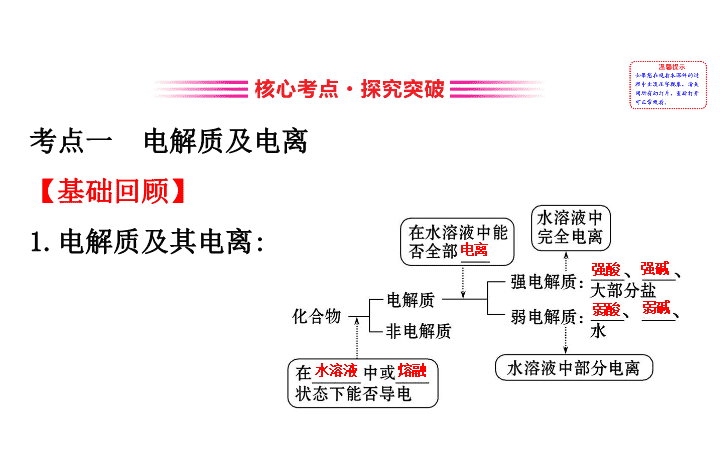
离 子 反 应 考点一 电解质及电离 【 基础回顾 】 1. 电解质及其电离 : 电离 强酸 强碱 弱酸 弱碱 水溶液 熔融 2. 电解质的电离 : 电解质在水溶液中或熔融状态下 , 离解成 _________ 的 离子的过程。 自由移动 ==== 3. 电解质导电的原因 : (1) 内因 : 电解质在一定条件 ( 溶于水或加热熔融 ) 下电离成自由移动的离子。 (2) 外因 : 电解质溶液 ( 或熔融电解质 ) 与电源构成闭合回路。 (3) 电解质电离与导电的关系 : 【 方法点拨 】 电解质的相关判断 4 个注意点 (1) 单质和混合物既不是电解质也不是非电解质。 (2) 电解质不一定导电 , 如固体 NaCl 、液态 HCl 均不导电 ; 导电的物质不一定是电解质 , 如金属单质、电解质溶液均可导电 , 但都不是电解质。 (3) 本身电离而导电的化合物才是电解质 , 如 NH 3 、 SO 2 、 SO 3 、 CO 2 为非电解质。 (4) 电解质的强弱与电解质溶液导电能力的强弱、溶解性大小没有必然联系。如 CaCO 3 的溶解度很小 , 其溶液导电能力很弱 , 但 CaCO 3 属于强电解质。 【 题组过关 】 1.(RJ 必修 1·P33 改编题 ) 下列物质能够导电 , 但既不是电解质也不是非电解质的是 ( ) A. 熔融的氯化钠 B. 盐酸 C. 醋酸 D. 乙醇 【 解析 】 选 B 。 NaCl 和醋酸为电解质 ,A 、 C 错误。乙醇为非电解质 ,D 错误。盐酸为 HCl 的水溶液 , 能够导电 , 但既不是电解质也不是非电解质 ,B 正确。 2. 下表中物质的分类组合完全正确的是 ( ) 选项 A B C D 强电解质 KNO 3 H 2 SO 4 BaSO 4 HClO 4 弱电解质 HF CaCO 3 HClO CH 3 COONH 4 非电解质 SO 2 金属 Al H 2 O C 2 H 5 OH 【 解析 】 选 A 。 B 项中的 CaCO 3 属于强电解质 ;Al 为单质 , 既不属于电解质 , 也不属于非电解质 ,B 错误。 C 项中 H 2 O 为弱电解质 ,C 错误。 D 项中 CH 3 COONH 4 为强电解质 ,D 错误。 3.(2018· 滨海新区模拟 ) 下列指定化学用语正确的是 ( ) A.NaHCO 3 的电离方程式 :NaHCO 3 Na + + B.Ba(OH) 2 的电离方程式 : Ba(OH) 2 Ba 2+ +2OH - C.NaHSO 4 的电离方程式 :NaHSO 4 ====Na + +H + + D.Na 2 S 水解的离子方程式 :S 2- +2H 2 O ==== H 2 S+2OH - 【 解析 】 选 C 。 NaHCO 3 为强电解质 , 电离方程式为 NaHCO 3 ==== Na + + , 故 A 错误 ;Ba(OH) 2 为强电解质 , 电离方 程式为 Ba(OH) 2 ==== Ba 2+ +2OH - ,B 错误 ;C 正确 ;Na 2 S 的水 解分步进行 , 而且水解的程度很小 , 要用可逆符号表示 离子方程式 , 水解的离子方程式 :S 2- +H 2 O HS - +OH - , HS - +H 2 O H 2 S+OH - , 故 D 错误。 4. 下列关于强弱电解质的叙述错误的是 ( ) A. 弱电解质在溶液中部分电离 , 存在电离平衡 B. 在溶液中导电能力强的电解质是强电解质 , 导电能力弱的电解质是弱电解质 C. 同一弱电解质的溶液 , 当温度、浓度不同时 , 其导电能力也不相同 D. 纯净的强电解质在液态时 , 有的导电 , 有的不导电 【 解析 】 选 B 。弱电解质在溶液中部分电离 , 存在电离 平衡 ,A 正确。强电解质溶液导电能力不一定强 , 弱电 解质溶液导电能力不一定弱 ,B 错误。同一弱电解质的 溶液 , 如 0.1 mol·L -1 的氨水和 0.01 mol·L -1 的氨水 , 溶液中离子浓度不同导电能力不同 ;0.1 mol·L -1 的氨 水在不同温度时导电能力也不相同 , 因为温度升高 , NH 3 ·H 2 O 的电离程度增大 , 则溶液中离子浓度增大 , 且离子运动速率加快 , 导电性增强 ,C 正确。 H 2 SO 4 和 NaCl 均为强电解质 , 液态时 H 2 SO 4 不导电 , 液态 NaCl 可以导电 ,D 正确。 【 加固训练 】 下列说法中正确的是 ( ) A. 氯化钠水溶液在电流的作用下电离出 Na + 和 Cl - B. 二氧化碳的水溶液能够导电 , 故二氧化碳属于弱电解 质 C. 硫酸钡难溶于水 , 但硫酸钡属于强电解质 D. 氧化钠在水中的电离方程式可表示为 Na 2 O====2Na + +O 2- 【 解析 】 选 C 。电解质电离的条件是溶于水或熔融 ,A 错 ; 二氧化碳不能发生电离 , 其溶液导电是因为二氧化碳与水反应生成碳酸 , 碳酸电离产生了自由移动的离子 , 二氧化碳属于非电解质 ,B 错 ; 硫酸钡在水中溶解的部分能够完全电离 , 属于强电解质 ,C 正确 ;Na 2 O 是金属氧化物 , 与水反应生成 NaOH, 故不存在电离方程式 ,D 错。 考点二 离子反应 离子方程式的书写和正误判断 【 基础回顾 】 1. 离子反应 : (1) 定义 : 有 _________ 或有 _________ 的反应。 离子参加 离子生成 (2) 类型 : 难溶 难电离 气态 2. 离子方程式 : (1) 书写步骤 : 以 CaCO 3 与盐酸的反应为例。 (2) 意义 : 离子方程式不仅可以表示某一个具体的化学 反应 , 还可以表示同一类型的离子反应 , 如氢氧化钠溶 液和盐酸反应、氢氧化钾溶液和硝酸反应的离子方程 式 , 都可用 _____________ 来表示。 H + +OH - ====H 2 O 【 思维诊断 】 ( 正确的打“√” , 错误的打“ ×”) (1) 向稀硝酸中滴加 Na 2 S 溶液 :S 2- +2H + ====H 2 S↑ 。 ( ) 提示 : × 。稀硝酸具有强氧化性 , 能将 S 2- 氧化为单质 S 。 (2) 氯气溶于水 :Cl 2 +H 2 O====2H + +Cl - +ClO - 。 ( ) 提示 : × 。次氯酸是弱酸 , 写分子式。 (3) 酸性溶液中 KIO 3 与 KI 反应生成 I 2 : +I - +6H + ==== I 2 +3H 2 O 。 ( ) 提示 : × 。酸性条件下 KIO 3 溶液与 KI 溶液发生反应生 成 I 2 的离子反应为 +5I - +6H + ====3I 2 +3H 2 O 。 (4)H + +OH - ====H 2 O 可表示所有强酸和强碱的中和反 应。 ( ) 提示 : × 。部分强酸和强碱反应可用 H + +OH - ====H 2 O 来 表示 , 有些强酸与强碱的反应不能 , 如 H 2 SO 4 和 Ba(OH) 2 反应的离子方程式为 2H + + +Ba 2+ +2OH - ==== BaSO 4 ↓+2H 2 O 。 (5) 向硅酸钠溶液中通入过量 SO 2 : +SO 2 +H 2 O==== H 2 SiO 3 ↓+ 。 ( ) 提示 : × 。 SO 2 过量 , 反应应生成 , 反应的离子方 程式为 +2SO 2 +2H 2 O====H 2 SiO 3 ↓+2 。 (6) 电解 MgCl 2 溶液 :2Cl - +2H 2 O H 2 ↑+Cl 2 +2OH - 。 ( ) 提示 : × 。溶液中的 Mg 2+ 会与 OH - 反应生成 Mg(OH) 2 沉淀 , 离子方程式为 Mg 2+ +2Cl - +2H 2 O H 2 ↑+Cl 2 ↑+ Mg(OH) 2 ↓ 。 【 典题探究 】 角度一 离子方程式正误判断 【 典题 1】 (2018· 河西区模拟 ) 下列反应的离子方程 式正确的是 ( ) A. 过氧化钠与水反应 : 2 + 2H 2 O====4OH - +O 2 ↑ B. 用盐酸制硅胶 : Na 2 SiO 3 + 2H + ====2Na + +H 2 SiO 3 C. 实验室制氯气 : MnO 2 +4HCl( 浓 ) Mn 2+ + 2Cl - + Cl 2 ↑+ 2H 2 O D. 用 NaOH 溶液除去铝表面的氧化膜 : Al 2 O 3 + 2OH - ====2 +H 2 O 【 解析 】 选 D 。过氧化钠与水反应的离子方程式应为 2Na 2 O 2 +2H 2 O====4Na + +4OH - +O 2 ↑,A 项错误 ; 盐酸与 Na 2 SiO 3 反应生成 H 2 SiO 3 沉淀 , 反应的离子方程式应为 2H + + ====H 2 SiO 3 ↓,B 项错误 ; 实验室制氯气的离 子方程式应为 MnO 2 +4H + +2Cl - Mn 2+ +Cl 2 ↑+2H 2 O,C 项错误。 【 归纳提升 】 离子方程式正误判断的方法 1. 总体思路 : 2. 具体方法 ——“ 六查” : (1)“ 一查”是否符合客观事实。 如 2Fe+6H + ====2Fe 3+ +3H 2 ↑(×) 。 (2)“ 二查”“ ====”“ ”“↑”“↓” 是否使 用恰当。 如 NaHCO 3 溶液因水解呈碱性 : +H 2 O====H 2 CO 3 +OH - (×), 因 水解过程很微 弱 , 应用“ ”表示而不能用“ ====” 。 (3)“ 三查”拆分是否正确。 只有易溶于水的强电解质能拆写成离子 , 其他物质均 不能拆写。 (4)“ 四查”是否“漏写”离子反应。 如稀硫酸与氢氧化钡溶液反应 : Ba 2+ + ====BaSO 4 ↓(×) 。 (5)“ 五查”反应物的“量” —— 过量、少量、足量 等。 如把过量的 NaHCO 3 溶液与 Ca(OH) 2 溶液混合 : +Ca 2+ +OH - ====CaCO 3 ↓+H 2 O(×) 。 (6)“ 六查”是否符合三个守恒。 ①质量守恒。 如 Na+H 2 O====Na + +OH - +H 2 ↑(×) 。 ②电荷守恒。 如 Fe 3+ +Cu====Fe 2+ +Cu 2+ (×) 。 ③ 得失电子守恒 如将氯化亚铁溶液和稀硝酸混合 : Fe 2+ +4H + + ====Fe 3+ +2H 2 O+NO↑(×) 。 角度二 与量有关的离子方程式的书写 【 典题 2】 (2018· 和平区模拟 ) 下列离子方程式书写 正确的是 ( ) A. 用硫酸酸化的淀粉碘化钾溶液在空气中变蓝 : 4I - +O 2 +4H + ====2I 2 +2H 2 O B.NH 4 HCO 3 溶液与过量 NaOH 溶液反应 : +OH - ==== NH 3 ·H 2 O C. 向 NaAlO 2 溶液中通入过量 CO 2 制 Al(OH) 3 :2 +CO 2 +3H 2 O====2Al(OH) 3 ↓+ D. 向 Fe(NO 3 ) 3 溶液中加入过量的 HI 溶液 :2 +8H + +6I - ====3I 2 +2NO↑+4H 2 O 【 解析 】 选 A 。淀粉碘化钾溶液在空气中变蓝 , 碘离子 具有还原性 , 被空气中的氧气氧化为单质碘 , 碘单质使 淀粉变蓝 , 反应的离子方程式为 4I - +O 2 +4H + ====2H 2 O+ 2I 2 , 故 A 正确 ;NH 4 HCO 3 溶液与过量的 NaOH 溶液反应的离 子方程式为 + +2OH - ====NH 3 ·H 2 O+H 2 O+ , 故 B 错误 ; 向 NaAlO 2 溶液中通入过量 CO 2 , 由于二氧化碳 过量 , 反应生成碳酸氢根离子 , 离子方程式为 +CO 2 +2H 2 O====Al(OH) 3 ↓+ , 故 C 错误 ; 向 Fe(NO 3 ) 3 溶液 中加入过量的 HI 溶液 , 硝酸先氧化碘离子 , 硝酸反应完 后 , 三价铁离子再氧化碘离子为单质碘 , 由于是过量的 HI, 所以 Fe 3+ 和 均被还原 , 化学方程式为 Fe(NO 3 ) 3 + 12HI====FeI 2 +5I 2 ↓+3NO↑+6H 2 O, 离子方程式为 Fe 3+ + 3 +12H + +10I - ====Fe 2+ +5I 2 ↓+3NO↑+6H 2 O, 故 D 错误。 【 归纳提升 】 与量有关离子方程式的种类与解答 (1) 连续型 :① 向多元弱酸的盐溶液中滴加强酸溶液 , 一般先生成弱酸的酸式盐 , 强酸过量则生成弱酸 , 如 Na 2 CO 3 溶液中滴加盐酸 , 首先生成 NaHCO 3 , 盐酸过量生成 CO 2 。 ② 向碱液、弱酸盐溶液中加入酸性氧化物或多元酸 , 酸性氧化物或多元酸少量则反应生成正盐 , 过量则生成酸式盐 , 如氨水中通入 SO 2 气体 ,SO 2 少量反应生成 (NH 4 ) 2 SO 3 ,SO 2 过量则生成 NH 4 HSO 3 。 ③向 NaAlO 2 溶液中通入少量 CO 2 , 反应生成 Al(OH) 3 沉淀和 Na 2 CO 3 , 通入过量 CO 2 生成 Al(OH) 3 沉淀和 NaHCO 3 。 (2) 先后型 : 向 FeBr 2 溶液中通入氯气 , 氯气少量则 Fe 2+ 首先反应 ,Cl 2 过量则 Fe 2+ 和 Br - 均可反应 ; 向 FeI 2 溶液中 通入氯气 , 氯气少量则 I - 首先反应 ,Cl 2 过量则 Fe 2+ 和 I - 均可反应。向 NH 4 HCO 3 溶液中加入 NaOH 溶液 , 首先 与 OH - 中和 , 然后是 反应。 (3) 配比型 : 两种物质比例不同 , 反应的离子方程式不同。这种离子反应的书写可用“定一法”书写 , 将量少的物质化学计量数定为 1, 若该物质中有多种离子参加反应 , 则参加反应的离子按照物质组成中离子个数比书写。依据量少的物质中离子的个数 , 确定过量物质中试剂参加反应的离子个数 , 据此写出产物并配平。 【 题组过关 】 1.(RJ 必修 1·P34 改编题 ) 下列化学方程式中 , 不能用 离子方程式 Ba 2+ + ====BaSO 4 ↓ 表示的是 ( ) A.Ba(NO 3 ) 2 +H 2 SO 4 ====BaSO 4 ↓+2HNO 3 B.BaCl 2 +Na 2 SO 4 ====BaSO 4 ↓+2NaCl C.BaCO 3 +H 2 SO 4 ====BaSO 4 ↓+H 2 O+CO 2 ↑ D.BaCl 2 +H 2 SO 4 ====BaSO 4 ↓+2HCl 【 解析 】 选 C 。硝酸钡是可溶性的钡盐 , 硫酸是强酸 , 二者之间反应仅有难电离物质硫酸钡沉淀生成 ; 氯化 钡是可溶性的钡盐 , 硫酸钠是可溶性的硫酸盐 , 二者之 间反应仅有难电离物质硫酸钡沉淀生成 ; 氯化钡是可 溶性的钡盐 , 硫酸是强酸 , 二者之间反应仅有难电离 物质硫酸钡沉淀生成 , 故 A 、 B 、 D 均正确 ; 碳酸钡是 难溶于水的物质 , 不能用离子方程式 Ba 2+ + ==== BaSO 4 ↓ 表示 BaCO 3 和 H 2 SO 4 之间的反应 , 故 C 错误。 2.(2018· 江苏高考 ) 下列指定反应的离子方程式正确 的是 ( ) A. 饱和 Na 2 CO 3 溶液与 CaSO 4 固体反应 : +CaSO 4 CaCO 3 + B. 酸化 NaIO 3 和 NaI 的混合溶液 :I - + +6H + ====I 2 +3H 2 O C.KClO 碱性溶液与 Fe(OH) 3 反应 :3ClO - +2Fe(OH) 3 ==== 2 +3Cl - +4H + +H 2 O D. 电解饱和食盐水 :2Cl - +2H + Cl 2 ↑+H 2 ↑ 通电 ==== 【 解析 】 选 A 。 A 项 ,CaSO 4 固体在离子方程式中不能拆 开 , 与 CaSO 4 电离出的 可结合成更难溶的 CaCO 3 , 符合沉淀溶解平衡的移动 , 正确 ;B 项 , 不符合得失电子 守恒以及电荷守恒 , 错误 ;C 项 , 碱性溶液中不可能生成 H + , 错误 ;D 项 , 电解 NaCl 溶液 , 阴极为 H + 放电 , 但是 H + 来自 于水 , 而水为弱电解质 , 在写离子方程式时不可拆开 , 故 应写成 :2Cl - +2H 2 O Cl 2 ↑+H 2 ↑+2OH - , 错误。 通电 ==== 3.(1) 取少量铝粉和 Fe 2 O 3 做铝热反应后所得的固体混合物 , 将其溶于足量稀硫酸 , 滴加 KSCN 溶液无明显现象 ,________( 填“能”或“不能” ) 说明固体混合物中无 Fe 2 O 3 , 理由是 ________________________( 用离子方程式说明 ) 。 (2)Na 2 CO 3 溶液能和 HCN 反应 :Na 2 CO 3 +HCN====NaHCO 3 + NaCN, 则向 NaCN 溶液中通入少量 CO 2 时反应的离子方程式 :________________________________ 。 (3) 铈是一种重要的稀土金属元素 , 以下是其重要化合 物 Ce(OH) 4 的一种制备方法 : ( 注 : 高铈是指溶液中 Ce 为 +4 价 ) ① 写出加入氨水时发生反应的离子方程式 _________ ___________________________________ 。 ②“氧化”过程若用 NaClO 代替 O 2 , 写出该反应的离子方程式 ________________________________ 。 【 解析 】 (1) 少量铝粉和 Fe 2 O 3 做铝热反应后所得的固体 混合物含有未反应的 Fe 2 O 3 和反应生成的 Fe, 加入稀硫 酸 ,Fe 2 O 3 反应生成 Fe 3+ ,Fe 可与 Fe 3+ 反应 , 因此反应后的 溶液中可能不含 Fe 3+ 。 (2) 根据反应 Na 2 CO 3 +HCN====NaHCO 3 +NaCN, 说明电离程 度 H 2 CO 3 >HCN> , 因此在 NaCN 溶液中通入少量 CO 2 反 应生成 NaHCO 3 和 HCN 。 (3) 根据题意 , 硫酸铈钠溶液中应含有 Ce 3+ , 可与氨水反 应生成 Ce(OH) 3 沉淀。 Ce(OH) 3 被 NaClO 氧化生成 Ce(OH) 4 和 NaCl 。 答案 : (1) 不能 Fe 2 O 3 +6H + ====2Fe 3+ +3H 2 O 、 2Fe 3+ +Fe====3Fe 2+ (2)CN - +H 2 O+CO 2 ==== +HCN (3)①Ce 3+ +3NH 3 · H 2 O====Ce(OH) 3 ↓+3 ②2Ce(OH) 3 +ClO - +H 2 O====2Ce(OH) 4 +Cl - 【 加固训练 】 1. 下列反应的离子方程式表示正确的是 ( ) A. 澄清石灰水中通入过量二氧化碳 :OH - +CO 2 ==== B. 铜片跟三氯化铁溶液反应 :2Fe 3+ +3Cu====3Cu 2+ +2Fe C. 漂白粉溶液中通入少量 SO 2 :Ca 2+ +2ClO - +SO 2 +H 2 O==== CaSO 3 ↓+2HClO D.Fe 3 O 4 与稀硝酸反应 :Fe 3 O 4 +8H + ====Fe 2+ +2Fe 3+ +4H 2 O 【 解析 】 选 A 。铜与 FeCl 3 溶液反应不能置换出单质铁 , 离子反应为 2Fe 3+ +Cu====Cu 2+ +2Fe 2+ ,B 错误。漂白粉具有强氧化性可氧化 SO 2 , 因此产物不是 CaSO 3 和 HClO,C 错误。稀硝酸具有强氧化性会把 Fe 2+ 氧化生成 Fe 3+ ,D 错误。 2. 下列方程式书写正确的是 ( ) A.CaCO 3 的电离方程式 :CaCO 3 ====Ca 2+ + B.NaHS 水解 :HS - +H 2 O H 3 O + +S 2- C.Fe(OH) 3 溶于氢碘酸 :Fe(OH) 3 +3H + ====Fe 3+ +3H 2 O D. 用少量氨水吸收工业尾气中的 SO 2 :2NH 3 ·H 2 O+SO 2 ====2 + +H 2 O 【 解析 】 选 A 。碳酸钙是强电解质 , 电离方程式正确 ,A 正确 ;B 属于 HS - 的电离方程式 ,B 错误 ;C 中铁离子具有氧化性 , 氢氧化铁和氢碘酸发生氧化还原反应 ,C 错误 ;D 中 SO 2 过量生成亚硫酸氢铵 ,D 错误。 考点三 离子共存与推断 【 基础回顾 】 1. 离子共存 : 判断离子共存的基本原则是看离子间有无反应 , 能反应则不能大量共存。 (1) 离子不能共存的“四大”类型。 ① 复分解反应型 a. 生成难溶物或微溶物。 Ba 2+ 、 Ca 2+ 与 、 、 等不能大量共存 ;Ag + 与 、 、 Cl - 等不能大量共存 ;OH - 与 Mg 2+ 、 Ca 2+ 、 Al 3+ 、 Mn 2+ 、 Fe 2+ 、 Cu 2+ 等不能大量共存 ; 与 不能大量共存。 b. 生成难电离或易挥发的物质。 H + 与 OH - 、 、 、 、 、 F - 、 CH 3 COO - 等 不能大量共存 ;OH - 与 H + 、 、 Mg 2+ 等阳离子及 、 等弱酸的酸式酸根不能大量共存。 ② 氧化还原反应型 常见三种氧化剂与还原性离子共存情况 ( 不能共存用“ ×” 表示 , 能大量共存用“√”表示 ) 。 ③ 络合反应型 : 如 _____________________ 。 ④互促水解反应型 : Al 3+ 与 ______________ 、 __________ 、 ______ 发生水 解相互促进反应不能大量共存。 Fe 3+ 与 ( 或 ) 、 发生水解相互促进反应不能大量共存。 Fe 3+ +3SCN - ====Fe(SCN) 3 ( 或 ) HS - ( 或 S 2- ) (2) 离子共存判断中的“一色”与“二性”。 ①常见有色离子 :Cu 2+ —— 蓝色 ,Fe 3+ —— 黄色 ,Fe 2+ —— 浅绿色 , —— 紫红色 , ——___ 色 , —— ___ 色。 橙 黄 ② 酸性 a. 强酸性溶液 : 含有大量 H + , 与 OH - 、弱酸根 ( 如 、 、 S 2- 、 ClO - 等 ) 均不能大量共存。 b. 酸性溶液的说法 : Ⅰ.pH<7 或 c(H + )>c(OH - ) 或 c(OH - )= 10 -(8 ~ 14) mol·L -1 (25 ℃) Ⅱ. 能使 pH 试纸显 _____ 的溶液 Ⅲ. 能使甲基橙显 ___________ 的溶液 Ⅳ. 能使紫色石蕊溶液显 _____ 的溶液 红色 红色或橙色 红色 ③ 碱性 a. 强碱性溶液 : 含有大量 OH - ,H + 与弱碱阳离子 ( 如 、 Al 3+ 、 Fe 3+ 等 ) 均不能大量共存。 b. 碱性溶液的说法 : Ⅰ.pH>7 或 c(H + )查看更多