江西省上饶市玉山县樟村中学2018-2019学年高二第一次月考化学试卷 Word版缺答案
樟村中学2018-2019上学期高二化学月考试卷
一、单选题(48分)
1.下列说法中不正确的是( )
A.氨气极易溶于水,所以它是农业上常用的氮肥
B.工业上用H2和N2合成氨与自然界中放电时O2和N2反应都属于氮的固定
C.大型中央空调的致冷剂可用液氨
D.铵盐易溶于水,且可与强碱发生复分解反应
2.在密闭容器中充入4,在一定温度下 达到平衡时,有30%的发生分解,则平衡时混合气体总的物质的量是( )
A.3.4 B.4 C.2.8 D.1.2
3. 黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
已知硫的燃烧热
则为( )
A. B. C. D.
4.反应2A + B3C +4D中,下列各项中表示该反应的反应速率最大的是( )。
A. (A)=0.5mol/(L·s) B. (B)=0.3mol/(L·s)
C. (C)=0.8mol/(L·s) D. (D)=1mol/(L·s)
5.在合成氨时,可以提高H2转化率的措施( )
A.延长反应时间
B.充入过量H2
C.充入过量N2
D.升高温度
6.下列说法中正确的是( )
A.测定中和热的实验中需要用到的主要玻璃仪器:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒
B.可以用保温杯代替烧杯做有关中和热测定的实验
C.测定中和热的实验中,至少需要测定并记录温度3次
D.测定中和热的实验中,若所使用的稀溶液的量稍大于稀盐酸的,则会导致测得的中和热数值偏高
7.己知丙烷的燃烧热,若一定量的丙烷完全燃烧后生成1.8水,则放出的热量约为A.55 B.220 C.550 D.1108
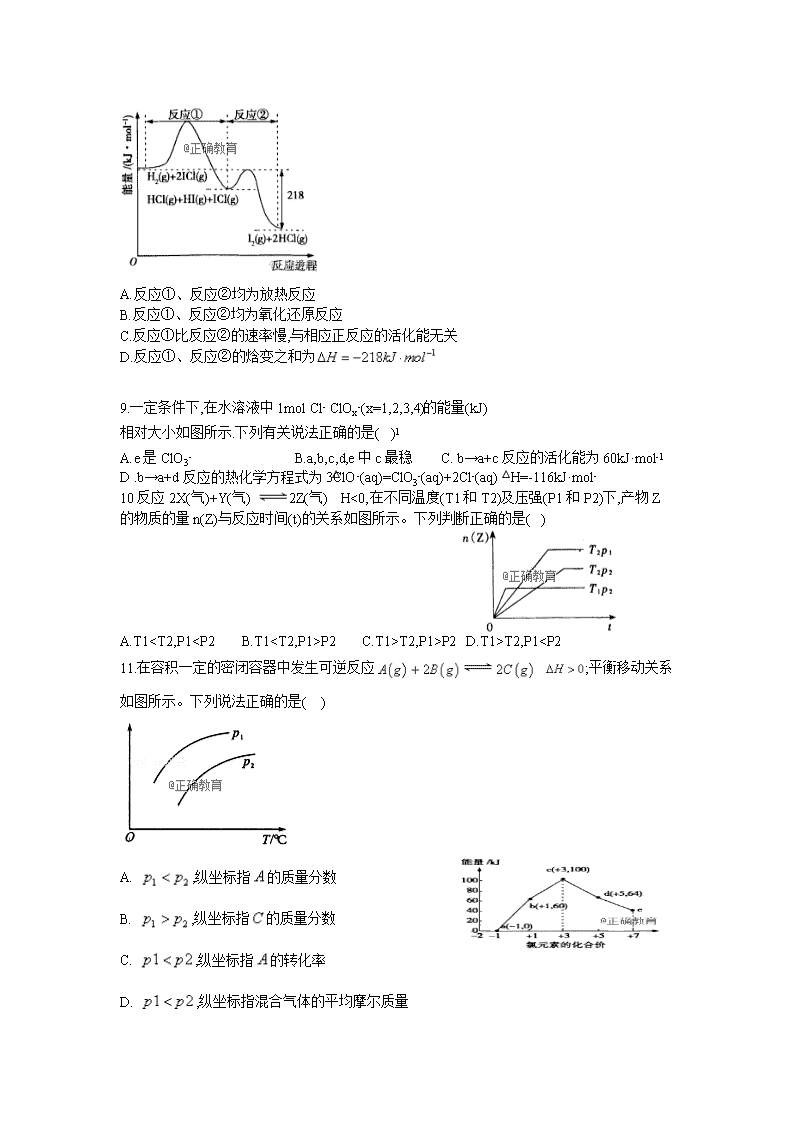
8.与的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为
9.一定条件下,在水溶液中1mol Cl- ClOx-(x=1,2,3,4)的能量(kJ)
相对大小如图所示.下列有关说法正确的是( )1
A.e是ClO3- B.a,b,c,d,e中c最稳 C. b→a+c反应的活化能为60kJ·mol-1
D .b→a+d反应的热化学方程式为3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-116kJ·mol-
10反应2X(气)+Y(气) 2Z(气) △H<0,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如图所示。下列判断正确的是( )
A.T1
P2 C.T1>T2,P1>P2 D.T1>T2,P10,反应吸热时ΔH<0
C.任何条件下,化学反应的焓变都等于化学反应的反应热
D.在一定条件下,某一化学反应是吸热反应还是放热反应,由生成物与反应物的焓值差决定
14.在一固定体积的密闭容器中加入2molA和1molB发生反应:2A(g)+B(g)⇌3C(g)+D(g),达到平衡时C的浓度为wmol•L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为wmol•L-1的配比是( )
A.4molA+2molB
B.3molC+1molD+2molA+1molB
C.3molC+1molD+1molB
D.3molC+1molD
15. 已知反应X(g)+3Y(g)2Z(g) △H<0,在密闭容器中反应达到平衡时,X物质的量浓度为0.4mol/L。下列说法正确的是
A.恒温恒容下,通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的1/3
C.恒温下,扩大容器体积至原来的两倍,则X物质的量浓度大于0.4mol/L
D.恒温恒压下,增加Z的物质的量,重新达平衡时,X物质的量浓度大于0.4mol/L
16.对于可逆反应mA(g)+nB(g)pC(g)+gD(g),若其他条件都不变,只考虑反应前是否加入催化剂,可得到如下两个图象:
下列关系正确的是( )
①a1=a2 ②a1t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧甲图中阴影部分面积比乙图大
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
第II卷 共52分
二、填空题
17.(14分)用50mL 0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
1.从实验装置上看,图中尚缺少的一种玻璃用品是__________。
2.烧杯间填满碎纸条的作用是__________。
3.大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)
4.如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量__________(填“相等、不相等”);所求中和热__________(填“相等、不相等”),简述理由__________
5.用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________;(填“偏大”、“偏小”、“无影响”)
18.(10分)自然界的矿物、岩石的成因和变化受到许多条件的影响。地壳内每加深1,压强增大约25000~30000。在地壳内和存在以下平衡:
根据题意完成下列填空:
1.在地壳深处容易有____________气体逸出,在地壳浅处容易有____________沉积。
2.如果上述反应的平衡常数值变大,该反应__________(填编号)。
a.一定向正反应方向移动
b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动
d.在平衡移动时逆反应速率先减小后增大
3.如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,__________(填编号)。
a. b.
c. 的质量保持不变 d.反应物不再转化为生成物
4.若反应容器容积为2.0,反应时间8.0,容器内气体的密度增大了0.12,在这段时间内的平均反应速率为_____________。
19.(8分)已知:, △H=-483.6kJ·mol-1
, △H=-571.6 kJ·mol-1
, △H=2220kJ·mol-1
根据上述热化学方程式,回答下列问题:
1. 的燃烧热为__________,的燃烧热为__________.
2.1和2组成的混合气体完全燃烧恢复到室温时释放的热量为__________.
3.现有和的混合气体共5 ,完全燃烧恢复到室温时放热3847,则在混合气体中和的体积比是__________。
20.(6分)某温度时,在一个2的密闭容器中, 、、三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
1.该反应的化学方程式为__________。
2.从开始至2,的平均反应速率为__________。
3.若、、均为气体,反应达平衡时:此时体系的压强是开始时的_______倍.
21.(10分)工业上利用CO和H2合成甲醇的原理可表示为:CO(g)+2H2(g)CH3OH(g) △H=a kJ/mol 将1molCO(g)和2molH2(g)充入容积为2L的密闭容器中合成CH3OH(g),反应过程中,CH3OH(g)的物质的量(n)与时间(t)及温度的关系如图所示:
回答下列问题:
1.T2_____T1(填“>”、“<”或“=”).该反应ΔH_________0(填“>”、“<”或“=”),在T2时,从反应开始到平衡,氢气的平均反应速率v(H2) = 。在T1温度时,反应达到平衡后,容器内的压强与起始压强之比为 .
2.若其它条件不变,对处于Z点的体系,将体积压缩至原来的 ,达到新的平衡后,下列有关该体系的说法正确的是 。
A.氢气的浓度与原平衡比减少
B.正、逆反应速率都加快
C.甲醇的物质的量增加
D.体系的密度不变时说明达到新平衡
22.(4分)在2L的密闭容器中,加入2molA和1molB,发生下述反应:2A(g)+B(g)⇌2C(g)+D(s)达到平衡时,C的浓度为0.4mol•L-1
(1)温度不变,若缩小容器的体积,则平衡______移动(填正向、逆向或不)
(2)维持容器的温度和体积不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是0.4mol•L-1的是______.
A.4molA+2molB B.2molC+1molD
C.2molA+1molB+2molC+1molD D.1molA+0.5molB+1molC+0.2molD