- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】四川省阆中中学2019-2020学年高二下学期第二次月考
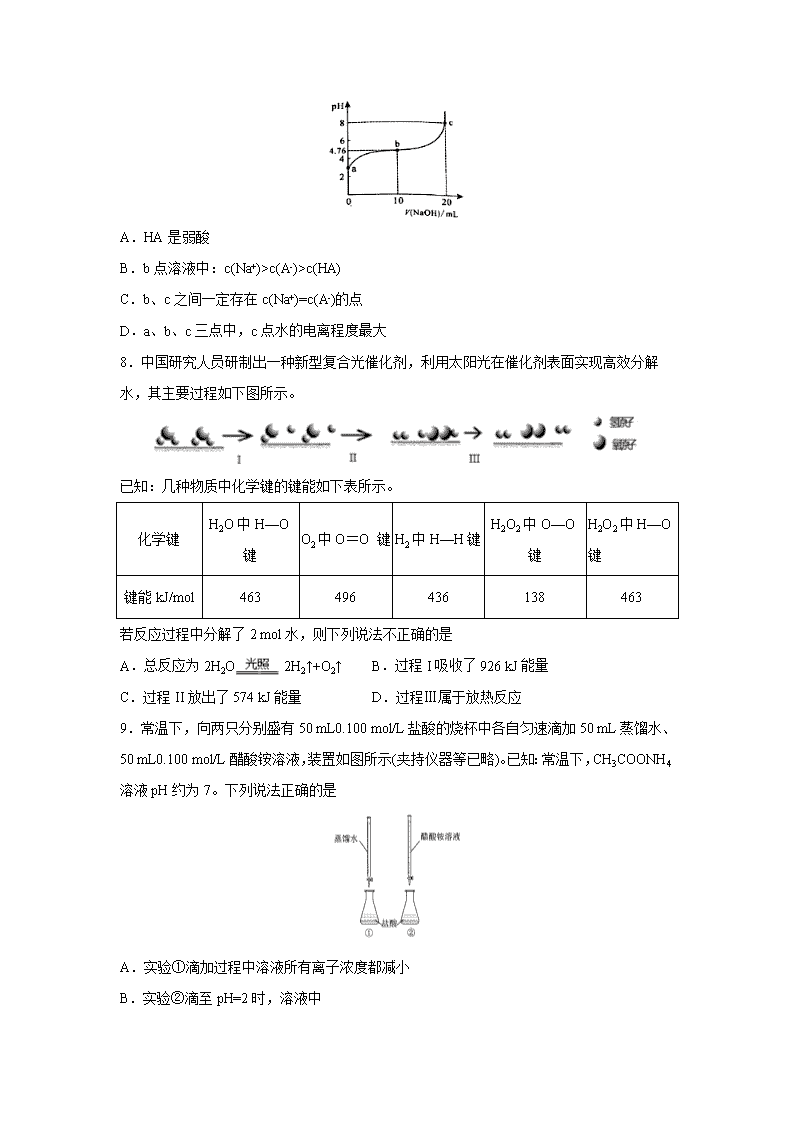
四川省阆中中学2019-2020学年高二下学期第二次月考 (H-1 Na-23 O-16) 一、单选题(每小题5分,共计60分,请将答案写在答题卡上) 1. 化学与人类生产、生活、科研密切相关。下列有关说法正确的是 A.白酒中混有少量的塑化剂(易溶于酒精),可以通过过滤的方法除去 B.蚕丝的主要成分是蛋白质 C.向燃煤中加入生石灰的目的是减少温室气体的排放 D.油脂在人体内水解为氨基酸,才能被人体吸收 2. 港珠澳大桥设计寿命达120年,对桥体钢构件采用的主要的防腐方法有:①钢梁上 安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预 留钢铁腐蚀量。下列分析不正确的是 A.钢铁在海水中主要为析氢腐蚀 B.方法①②③只能减缓钢铁腐蚀,未能完全消除 C.钢铁发生吸氧腐蚀时的负极反应式为:Fe-2e- = Fe2+ D.①②防腐原理是牺牲阳极的阴极保护法 3. 下列热化学方程式中,正确的是 A.甲烷燃烧热为 890.3 kJ•molˉ1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g); △H=+890.3 kJ•molˉ1 B.稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H++OH-=H2O; △H =-57.3 kJ•molˉ1 C.H2 燃烧热为 142.9kJ•molˉ1 ,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1); △H =-285.8 kJ•molˉ1 D.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) 2NH3(g) ; △H=-38.6kJ· mol-1 4.反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2=2HCl的反应 速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据 确定之。 c(H2)/mol·L-1 c(Cl2)/mol·L-1 v/mol·L-1·s-1 1.0 1.0 1.0 k 2.0 1.0 2.0 k 2.0 4.0 4.0 k 由此可推得,m、n值正确的是 A.m=1,n=2 B.m=1,n= C.m=,n=1 D.m=,n= 5. 下列说法中正确的是 A.NaHCO3和NaHSO4都能促进水的电离 B.降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动 C.加热0.1mol/L Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 D.水解平衡右移,盐的离子的水解程度一定增大 6.2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元 年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放 电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次 电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-x FexPO4,其原理如图所示, 下列说法正确的是 A.放电时,电流由石墨电极流向磷酸铁锂电极 B.充电时,Li+移向磷酸铁锂电极 C.放电时,负极反应式为LiC6-e-=Li++6C D.电池总反应为M1-xFexPO4+LiC6 Li M1-xFexPO4+6C 7.298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是 A.HA是弱酸 B.b点溶液中:c(Na+)>c(A-)>c(HA) C.b、c之间一定存在c(Na+)=c(A-)的点 D.a、b、c三点中,c点水的电离程度最大 8.中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解 水,其主要过程如下图所示。 已知:几种物质中化学键的键能如下表所示。 化学键 H2O中H—O键 O2中O=O 键 H2中H—H键 H2O2中O—O键 H2O2中H—O键 键能kJ/mol 463 496 436 138 463 若反应过程中分解了2 mol水,则下列说法不正确的是 A.总反应为2H2O2H2↑+O2↑ B.过程I吸收了926 kJ能量 C.过程II放出了574 kJ能量 D.过程Ⅲ属于放热反应 9.常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。已知:常温下,CH3COONH4溶液pH约为7。下列说法正确的是 A.实验①滴加过程中溶液所有离子浓度都减小 B.实验②滴至pH=2时,溶液中 c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L C.实验②滴加过程中,溶液中均存在c(CH3COO-)查看更多
相关文章
- 当前文档收益归属上传用户