- 2022-08-16 发布 |
- 37.5 KB |
- 115页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
最新大学化学第4章ppt课件
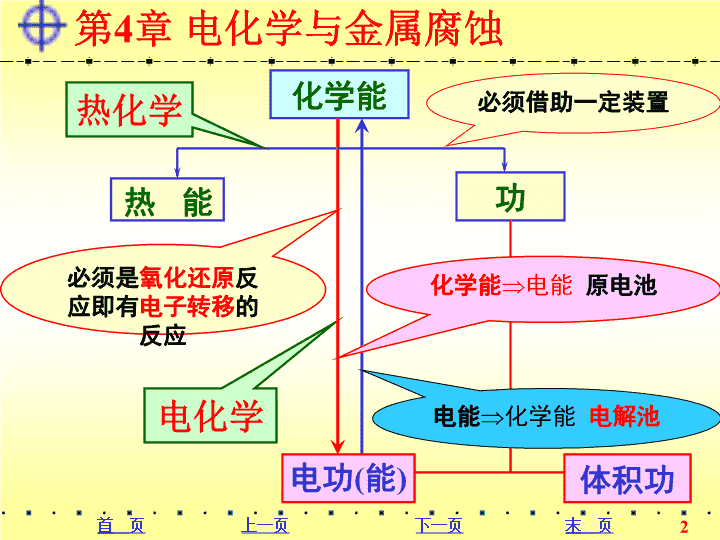
大学化学第4章\n化学能必须借助一定装置能热热化学电化学必须是氧化还原反应即有电子转移的反应电功(能)体积功功化学能电能原电池电能化学能电解池第4章电化学与金属腐蚀\n\n\n\n\n\n\n4.1原电池盐桥KCl观察现象:电流计指针偏移,有电流通过;Zn片溶解;Cu片上有红色Cu沉淀;ZnSO4CuSO4Cu片Zn片电流计铜锌电池(Daniellcell,英,1836)\n4.1原电池盐桥KClCuSO4ZnSO4Zn片Cu片电流计ZnSO4/Zn—Zn失e-,氧化成Zn2+—e-流出,氧化反应1.原电池的组成(3)盐桥:U型管中装入含琼胶的饱和KCl溶液。(2)导线:电子只能经导线在外电路流动——电子走旱路不走水路。(1)两个电极:—负极—正极e-e-CuSO4/Cu—Cu2+得e-,还原为Cu—e-流入,还原反应(—)(+)\n4.1原电池盐桥KClCuSO4ZnSO4Zn片Cu片电流计思考:盐桥有什么作用呢?(1)连通内电路,使之与外电路构成一个闭合回路;(2)带正电荷带负电荷e-(盐桥)K+CuSO4溶液中和负电荷(盐桥)Cl-ZnSO4溶液中和正电荷(-)(+)盐桥可使两极溶液呈电中性。\n4.1原电池例:铜锌电池中的两个电极2.电极和电极反应(1)电极——也称为半电池,由氧化还原电对构成。氧化态的物质—氧化值高的物质——氧化型;氧化还原电对还原态的物质—氧化值低的物质——还原型;“氧化型/还原型”Cu2+(aq,c2)/Cu(s)Zn2+(aq,c1)/Zn(s)铜电极:锌电极:注意:应标明物质的相态、浓度或压力\n4.1原电池(2)电极反应——半电池反应定义——电极上发生的氧化或还原反应。正极——还原反应,得电子反应负极——氧化反应,失电子反应原电池任何电极既可以发生氧化反应,也可以发生还原反应。电极反应的通式:a(氧化态)+ne-⇌b(还原态)注意:n表示电子化学计量数,即单位物质的量的氧化态物质在还原过程中获得的电子的物质的量。电极反应有时并不一定是只有氧化态、还原态物质,还会涉及介质和其他产物。在原电池中需分析正、负极,然后写出电极反应。电极反应\n4.1原电池答:取决于该电极氧化(或还原)能力的强弱,即得失电子的能力——电极电势。例:1)写出下列电极的电极反应通式Cu2+(aq,c)/Cu(s)Zn2+(aq,c)/Zn(s)MnO4-(aq,c)/Mn2+(aq,c)Cu2+(aq)+2e-⇌Cu(s)Zn2+(aq)+2e-⇌Zn(s)MnO4-(aq)++5e-⇌Mn2+(aq)8H+(aq)+4H2O(l)2)铜锌原电池中的电极反应正极:还原反应Cu2+(aq)+2e-⇌Cu(s)负极:氧化反应Zn(s)–2e-⇌Zn2+(aq)思考:当两个电极组成原电池时,哪一个电极做正极、哪一个电极做负极,与什么相关呢?\n4.1原电池例:Cu2+(aq,c)/Cu(s)Zn2+(aq,c)/Zn(s)Cl2(g,p)/Cl-(aq,c)(3)常见电极的种类非金属电极—非金属单质/非金属离子金属电极—金属离子/金属第一类电极作为负极的氯电极可完整地表示为:(–)Pt|Cl2(g,p)|Cl-(aq,c)Cl2(g,p)+2e-⇌2Cl-(aq,c)注意:金属电极可直接用金属作为电极材料;非金属电极则需用辅助电极材料,一般为惰性电极材料(Pt、石墨等),书写时应标明。\n4.1原电池例:AgCl(s)/Ag(s)Ag2CrO4(s)/Ag(s)例:(+)Pt|Fe3+(aq,c1),Fe2+(aq,c2)第二类电极(难溶盐电极):金属离子的难溶盐/金属AgCl(s)+e-⇌Ag(s)+Cl-(aq)Ag2CrO4(s)+2e-⇌2Ag(s)+CrO42-(aq)第三类电极:同种元素不同价态的离子,也能形成氧化还原电对构成电极,需用惰性电极材料。Fe3+(aq,c1)+e-⇌Fe2+(aq,c2)——这类电极的电势较稳定,因此常用作参比电极。\n4.1原电池(2)铜银原电池电极反应为:正极2Ag+(aq)+2e-⇌2Ag(s)负极Cu(s)–2e-⇌Cu2+(aq)3.电池反应两个电极上的电极反应之和称为电池反应。电池反应就是氧化还原反应。例:(1)铜锌原电池电极反应为:正极Cu2+(aq)+2e-⇌Cu(s)负极Zn(s)–2e-⇌Zn2+(aq)电池反应为:Zn(s)+Cu2+(aq)⇌Zn2+(aq)+Cu(s)电池反应为:Cu(s)+2Ag+(aq)⇌Cu2+(aq)+2Ag(s)同一个电极既可以发生氧化反应,也可发生还原反应。\n4.1原电池图式书写规则:(1)负极(-)在左边,正极(+)在右边——“负左正右”;(2)电池符号中,“|”代表一个界面,“¦¦”代表盐桥;(3)同一溶液中,不同离子在负极按氧化数升高的顺序,正极按氧化数下降顺序,并用“,”隔开——“负升正降”;(4)注明惰性电极材料(Pt、C等);(5)标明物质状态、气体压力、溶液浓度等。4.原电池的图式\n还原反应为:Cl2(g,p)+2e-⇌2Cl-(aq,c)4.1原电池原电池图式:例:将下列反应设计成原电池并以原电池图式表示。2Fe2+(1.0mol·dm-3)+Cl2(101325Pa)=2Fe3+(1.0mol·dm-3)+2Cl-(2.0mol·dm-3)氧化反应为:Fe2+(aq,c)–e-⇌Fe3+(aq,c)正极负极(–)(+)Pt||Pt¦¦Fe2+(1.0mol·dm-3),Fe3+(1.0mol·dm-3)Cl2(101325Pa)|2Cl-(2.0mol·dm-3)\n4.1原电池例:将下列反应设计成原电池并以原电池图式表示。(1)Zn+Cu2+⇌Zn2++Cu(2)2Fe3++Sn2+⇌2Fe2++Sn4+正极Cu2++2e-⇌Cu负极Zn-2e-⇌Zn2+(-)Zn|Zn2+(c1)¦¦Cu2+(c2)|Cu(+)正极2Fe3++2e-⇌2Fe2+负极Sn2+-2e-⇌Sn4+(-)Pt|Sn2+(c1),Sn4+(c2)¦¦Fe3+(c3),Fe2+(c4)|Pt(+)\n4.1.2原电池的热力学1.电池反应的△Gm与电动势E的关系4.1原电池(1)电动势E原电池两电极之间存在着电势差,称为电池的电动势E。(2)ΔrGm与E的关系化学能ΔrGm电能w'原电池做的最大电功为:w'max=-QE=-nFEF=NA•e={6.02210231.602210-19}C•mol-1=96485C•mol-1,——表示单位物质的量的电子的电量,称为Faraday常数在等温、等压、只做电功的条件下,原电池体系的Gibbs自由能降低值全部用于做电功。\n4.1原电池ΔrGm=w'=–nFE在标准状态下:ΔrGmθ=–nFEθ(3)电动势的能斯特(Nernst)公式aA(aq)+bB(aq)⇌gG(aq)+dD(aq)当T=298.15K时,并将自然对数改为常用对数:H.W.Nernst,德,1864~1941,1920年诺贝尔奖\n(1)随着反应的进行,E下降。(2)原电池电动势数值与电池反应计量式的写法无关。4.1原电池思考:(1)随着反应的进行,E怎样变化。(2)原电池电动势数值与反应化学计量数有关系吗?2.电池反应的标准平衡常数K与标准电动势E的关系lnK=–ΔrGm/RTΔrGm=–nFElnK=nFE/RT当T=298.15K时,并将自然对数改为常用对数:lgK=nE/0.05917V\n4.1原电池例:利用E(0.1852V)计算下列反应在298K的平衡常数2Cu(s)+2HI(aq)⇌2CuI(s)+H2(g)解:(1)负极(氧化):2Cu(s)+2I-(aq)-2e-⇌2CuI(s)正极(还原):2H+(aq)+2e-⇌H2(g)图式:(-)Cu(s)|CuI(s)|I-(1mol·dm-3)¦¦H+(1mol·dm-3)|H2(p)|Pt(+)(2)EӨ=+0.1852Vn=2lgK=nE/0.05917V=6.263K=1.83106\n4.1原电池小结:任意自发的氧化还原反应原则上都可设计成原电池原电池半电池半电池导体氧化还原电对电极:正极——还原反应导体氧化还原电对电极:负极——氧化反应原电池图式电动势的Nernst方程rGm与E以及KӨ与EӨ的关系ΔrGm=–nFElgK=nE/0.05917V\n第4章电化学与金属腐蚀4.1原电池4.2电极电势4.3电极电势在化学上的应用4.4化学电源4.5电解4.6金属的腐蚀与防止\nM不活泼Mn+溶液4.2电极电势电极电势的产生(thecharacterizationofelectrodepotential)溶解>沉积-++--++--++--++-M活泼Mn+溶液+--++--++--++--+溶解沉淀双电层理论沉积>溶解电极电势双电层——由于物质的氧化态、还原态得失电子能力不同\n4.2电极电势4.2.1标准电极电势例:锌电极、铜电极的电极电势怎样表示,比较其大小?1.电极电势(electrodepotential)(1)定义:同一元素氧化态与还原态之间的电势值称为电极电势。符号:(氧化态/还原态)单位:V越强的氧化剂越弱的还原剂氧化态物质得电子能力越强还原态物质失电子能力越弱越弱的氧化剂越强的还原剂氧化态物质得电子能力越弱还原态物质失电子能力越强意义值越大值越小锌电极电势:(Zn2+/Zn)铜电极电势:(Cu2+/Cu)(Zn2+/Zn)<(Cu2+/Cu)\n(2)电极电势与电动势EE=(正极)-(负极)注意:电极电势的绝对值测定尚有困难,在实际应用中只需知道的相对值而不必去追究它们的绝对值。2.标准氢电极4.2电极电势H+PtH2H2氢电极示意图H2|H+(1)标准氢电极的组成Pt|(p=100kPa)(c=1mol·dm-3)国际统一规定:(H+/H2)=0V(2)标准氢电极的电极电势电极反应通式:2H+(aq)+2e-⇌H2(g)\n4.2电极电势3.标准电极电势θ(1)定义:标准电极的电势。凡是符合标准态条件的电极都是标准电极。标准态所有的气体分压均为100kPa溶液中所有溶质的浓度均为1mol·dm-3原电池标准氢电极¦¦待测电极测其EӨ,即可计算待测电极的电极电势EӨ=Ө(正极)–Ө(负极)Ө(H+/H2)Ө(待测)(2)θ的测定方法\n4.2电极电势若待测电极发生:还原反应Ө(待测)为正值例:(–)Pt|H2(100kPa)|H+(1mol.dm-3)¦¦Cu2+(1mol.dm-3)|Cu(+)EӨ=Ө(Cu2+/Cu)–Ө(H+/H2)=Ө(Cu2+/Cu)—正值若待测电极发生:氧化反应(–)Zn|Zn2+(1mol.dm-3)¦¦H+(1mol.dm-3)|H2(100kPa)|Pt(+)EӨ=Ө(H+/H2)–Ө(Zn2+/Zn)=–Ө(Zn2+/Zn)—负值Ө(待测)为负值待测电极为正极待测电极为负极\n解:(1)EӨ=Ө(正极)–Ө(负极)0.7618V=0V–Ө(Zn2+/Zn)Ө(Zn2+/Zn)=-0.7618V例:(1)Zn与H2在标准条件下组成电池,Zn为负极,在25℃时测得电池的电动势EӨ=0.7618V。求Ө(Zn2+/Zn)=? (2)如果用热力学方法EӨ,计算结果如何?4.2电极电势(2)Zn(s)+2H+(aq)⇌Zn2+(aq)+H2(g)∆fGmӨ/kJ·mol-100-147.060∆rGmӨ=-147.06kJ·mol-1EӨ=-∆rGmӨ/nF=0.7630VӨ(Zn2+/Zn)=-0.7630V\n(3)参比电极甘汞电极:Pt∣Hg(l)∣Hg2Cl2(s)∣Cl-(aq)KCl溶液Hg2Cl2HgPt4.2电极电势易于制备参比电极 使用方便电极电势稳定氯化银电极:Ag(s)∣AgCl(s)∣Cl-(aq)第二类电极难溶盐电极电极反应:Hg2Cl2(s)+2e-⇌2Hg(l)+2Cl-(aq)c(Cl-)为饱和溶液,=0.2412Vc(Cl-)=1mol·dm-3,Ө=0.2801Vc(Cl-)=0.1mol·dm-3,=0.3337V电极反应:AgCl(s)+e-⇌Ag(s)+Cl-(aq)c(Cl-)=1mol·dm-3,Ө(AgCl/Ag)=0.2223V\n(4)标准电极电势表(P399页附录10)4.2电极电势表中Ө代数值按从小到大顺序编排+2.866+0.401+0.34190-0.7618-2.71/VF2(g)+2eˉ⇌2Fˉ(aq)O2(g)+2H2O+4eˉ⇌4OHˉ(aq)Cu2+(aq)+2eˉ⇌Cu(s)2H+(aq)+2eˉ⇌H2(g)Zn2+(aq)+2eˉ⇌Zn(s)Na+(aq)+eˉ⇌Na(s)电极反应F2/FˉO2/OHˉCu2+/CuH+/H2Zn2+/ZnNa+/Na电对氧化能力逐渐增强还原能力逐渐增强\n4.2电极电势φӨ代数值与电极反应中化学计量数的选配无关φӨ反映物质得失电子倾向的大小,与物质的数量无关,也没有加和性,是强度性质。例:Zn2++2e-⇌Zn2Zn2++4e-⇌2ZnφӨ数值相同φӨ代数值与半反应的方向无关IUPAC规定,表中电极反应以还原反应表示(称为还原电势),无论电对在实际反应中的转化方向如何,其φӨ代数值不变。例:Zn2++2e-⇌ZnZn-2e-⇌Zn2+φӨ数值相同查阅标准电极电势数据时,要注意电对的具体存在形式、状态和介质条件等都必须完全符合。\n4.2.2电极电势的能斯特方程式1.能斯特(Nernst)方程式由电动势的能斯特方程式或由热力学推导:当T=298.15K时,并用常用对数:4.2电极电势a氧化态+ne-⇌b还原态电极电势的能斯特方程\n4.2电极电势注意:方程中各物质的浓度以其对应的化学计量数为指数;纯固体或纯液体,则能斯特方程中该物质的浓度为1;气体,则能斯特方程中c/cӨ改用相对压力p/pӨ表示;方程中还应包括介质的离子浓度;如果T298.15K,则不能用0.05917V计算;只有可逆电势(平衡电势),即电极反应和电池反应中通过的电流无限小的可逆情况下,才可用能斯特方程计算。\n4.2电极电势例:写出下列电极反应的能斯特方程式(1)O2(g)+2H2O(l)+4e-⇌4OH-(aq)(2)Hg2Cl2(s)+2e-⇌2Hg(l)+2Cl-(aq)(3)Cr2O72-(aq)+14H+(aq)+6e-⇌2Cr3+(aq)+7H2O(l)\n例:计算OH-浓度为0.100mol·dm-3时,氧的电极电势φ(O2/OH-)。已知:p(O2)=101.325kPa,T=298.15K。解:从附录10中可查得氧的标准电极电势:φӨ(O2/OH-)=0.401VO2(g)+2H2O+4e-⇌4OH-(aq)=0.460V4.2电极电势O2+H2O+2e-⇌2OH-=0.460V说明反应式中各物质的化学计量数乘以一定的倍数,对电极电势的数值无影响。\n4.2电极电势例:计算下列原电池的E。(—)Pt|H2(50kpa)|H+(0.1mol·dm-3)||MnO4-(1mol·dm-3),H+(0.1mol·dm-3),Mn2+(1mol·dm-3)|Pt(+)解法一:正极MnO4-(aq)+8H+(aq)+5e-⇌Mn2+(aq)+4H2O(l)=1.42V负极H2(g)-2e-⇌2H+(aq)=-0.05VE=(+)-(-)=1.47V解法二:总反应2MnO4-(aq)+6H+(aq)+5H2(g)⇌2Mn2+(aq)+8H2O(l)=1.47V\n4.2电极电势2.影响电极电势的因素)()(cc,氧化型还原型)(c,还原型)(c,氧化型或(1)氧化型或还原型的浓度或分压a氧化态+ne-=b还原态)()(cc,氧化型还原型)(c,还原型)(c,氧化型或浓度变化不大时,值变化不大P169/例4.1思考:怎样才使离子浓度显著变化?生成沉淀或配离子,可使金属离子浓度(氧化态),则\n4.2电极电势例:已知Ө(Ag+/Ag)=0.799V,若在Ag+/Ag的半电池中加入NaCl会产生AgCl(s),当c(Cl-)=1.0mol·dm-3时,(Ag+/Ag)=?解:AgCl(s)⇌Ag+(aq)+Cl-(aq)Ks(AgCl)={c(Ag+)/cӨ}{c(Cl-)/cӨ}c(Cl-)=1.0mol·dm-3,c(Ag+)=Ks(AgCl)=1.7710-10mol·dm-3Ag+(aq)+e-⇌Ag(s)(Ag+/Ag)=Ө(Ag+/Ag)-0.05917lg{1/[c(Ag+)/cӨ]}=0.799V+0.05917lg(1.7710-10)=0.222VAgCl(s)+e-⇌Ag(s)+Cl-(aq)Ө(AgCl/Ag)=(Ag+/Ag)=Ө(Ag+/Ag)-0.05917lg{1/Ks(AgCl)}=0.222V同理:可求其他难溶盐电极的Ө,反之可由Ө求溶度积Ks\n4.2电极电势例:Ө(Fe3+/Fe2+)=0.769V,在Fe3+/Fe2+中加入NaOH,平衡时c(OH-)=1.0mol·dm-3,求(Fe3+/Fe2+)=?Ө[Fe(OH)3/Fe(OH)2]=?[Ks(Fe(OH)3)=2.6410-39;Ks(Fe(OH)2)=4.8710-17]解:Fe(OH)3(s)⇌Fe3+(aq)+3OH-(aq)Ks[Fe(OH)3]={c(Fe3+)/cӨ}{c(OH-)/cӨ}3c(OH-)=1.0mol·dm-3,c(Fe3+)=Ks[Fe(OH)3]=2.6410-39mol·dm-3Fe(OH)2(s)⇌Fe2+(aq)+2OH-(aq)c(OH-)=1.0mol·dm-3,c(Fe2+)=Ks[Fe(OH)2]=4.8710-17mol·dm-3Fe3+(aq)+e-⇌Fe2+(aq)(Fe3+/Fe2+)=Ө(Fe3+/Fe2+)-0.05917lg{[c(Fe2+)/cӨ]/[c(Fe3+)/cӨ]}=0.769V-0.05917lg(4.8710-17/2.6410-39)=-0.547VFe(OH)3(s)+e-⇌Fe(OH)2(s)+OH-(aq)Ө[Fe(OH)3/Fe(OH)2]=-0.547V\n4.2电极电势氧化型和还原型都形成沉淀氧化型形成沉淀还原型形成沉淀Ө(AgCl/Ag)<Ө(Ag+/Ag)Ө(Cu2+/CuI)>Ө(Cu2+/Cu+)Ks(氧化型)>Ks(还原型)Ks(氧化型)查看更多