大学化学第4章11822
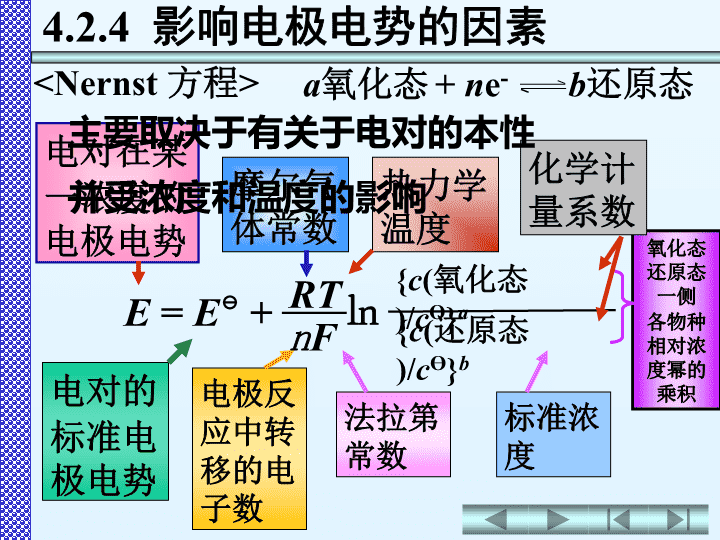
第四章氧化还原与电化学4.1氧化还原反应4.2原电池和电极电势4.3电极电势的应用4.4电解4.5金属的腐蚀与防护4.6化学电池\n氧化态还原态一侧各物种相对浓度幂的乘积电对在某一浓度的电极电势电对的标准电极电势摩尔气体常数热力学温度电极反应中转移的电子数法拉第常数a氧化态+ne-b还原态
4.2.4影响电极电势的因素E=E+㏑nF{c(氧化态)/cӨ}aRT{c(还原态)/cӨ}b化学计量系数标准浓度主要取决于有关于电对的本性并受浓度和温度的影响\nE=E+㏑nF{c(氧化态)}a{c(还原态)}bRT符号E、c(氧化态)、c(还原态)R浓度分压单位数值VmolL-1PaJK-1mol-18.314EcӨ=1molL-1,不考虑对数中的单位,则有\n2.氧化型物质,还原型物质的浓度、分压3.酸度对某些电对有影响组成电对的物质的本性,决定E值金属越活泼,E代数值越小,E越小E=E+㏑nF{c(氧化态)}a{c(还原态)}bRT\n当R=8.314JK-1mol-1F=96485JV-1T=298.15KE(-);电动势E=E(+)-E(-)4.3.1判断原电池的正、负极例1:由电对Fe3+/Fe2+、Sn4+/Sn2+构成原电池,判断原电池正、负极,计算其电动势。解:E(Fe3+/Fe2+)=+0.771VE(Sn4+/Sn2+)=+0.154V(1)在标准态下:只需比较E(+)极(-)极∨电动势E=E(+)-E(-)=0.771V-0.154V=0.617V原电池符号:(-)Pt|Sn2+(1molL-1),Sn4+(1molL-1)‖Fe3+(1molL-1),Fe2+(1molL-1)|Pt(+)(2)非标准态:先根据Nernst方程计算出E,然后再比较两个E值\n例2:试比较KMnO4、Cl2、FeCl3在酸性介质中的氧化能力氧化能力:KMnO4>Cl2>FeCl3⊖4.3.2判断氧化剂、还原剂的相对强弱越大,电对中氧化型物质的氧化能力越强还原型物质的还原能力越弱越小,电对中还原型物质的还原能力越强氧化型物质的氧化能力越弱EE解:0.7711.35831.51E/VFe3+/Fe2+Cl2/Cl-MnO4-/Mn2+电对>>\n例3:试比较SnCl2、Zn、H2S在酸性介质中的还原能力还原能力:Zn>H2S>SnCl2越大,电对中氧化型物质的氧化能力越强还原型物质的还原能力越弱越小,电对中还原型物质的还原能力越强氧化型物质的氧化能力越弱EE4.3.2判断氧化剂、还原剂的相对强弱解:0.1540.144-0.763E/VSn4+/Sn2+S/H2SZn2+/Zn电对<<\n(1)标准态例:判断反应2Ag++CuAg+Cu2+进行方向∨反应向右进行浓度对氧化还原反应方向的影响E(Ag+/Ag)=0.7991V(Cu2+/Cu)=0.340VE返回\n浓度对氧化还原反应方向的影响例:判断反应2Ag++CuAg+Cu2+进行方向(2)非标准态>反应向右进行0.0592V1c(Ag+)=0.050molL-1,c(Cu2+)=1.0molL-1=0.7991V+lg0.050=0.72VE(Ag+/Ag)=E(Ag+/Ag)+lg[c(Ag+)/c]0.0592V1E(Ag+/Ag)-E(Cu2+/Cu)=0.7991V-0.340V>0.2V电极反应中有关物质浓度的变化,没有导致反应方向的改变。E0.3400.720.7991(Cu2+/Cu)/VE(Ag+/Ag)/V(Ag+/Ag)/VE返回\n4.3.3判断氧化还原反应的方向化学反应自发进行的条件△rGm<0而△rGm=-nFE电池反应中转移的电子数法拉第常数1.氧化还原反应自发进行的判据\n4.3.3判断氧化还原反应的方向化学反应自发进行的条件△rGm<0△rGm<0E>0或E(氧化剂)>E(还原剂)△rGm=-nFE1.氧化还原反应自发进行的判据E>0;E(氧化剂)>E(还原剂)氧化还原反应的规律:氧化剂还原剂还原剂氧化剂较强较强较弱较弱++\n反应自发向右进行>(1)标准态时E>0;E(氧化剂)>E(还原剂)1.氧化还原反应自发进行的判据只需计算电动势E或比较E(氧化剂)和E(还原剂)大小Sn2+/Sn-0.136V-0.126VPb2+/Pb电对E/V例1试判断下列反应:Pb2++SnPb+Sn2+在标准态时反应自发进行的方向\n先根据Nernst方程求出E(电对),再计算电动势E或比较E(电对)。(2)非标准态时E>0;E(氧化剂)>E(还原剂)c(Pb2+)0.0010c(Sn2+)1.0例2试判断下列反应:Pb2++SnPb+Sn2+在=时反应自发进行的方向1.氧化还原反应自发进行的判据0.0592V2E(Pb2+/Pb)=E(Pb2+/Pb)+lg[c(Pb2+)/c]0.0592V2=-0.126V+lg0.0010=-0.215V\n先根据Nernst方程求出E(电对),再计算电动势E或比较E(电对)。(2)非标准态时c(Pb2+)0.0010c(Sn2+)1.0-0.136-0.215-0.126E(Sn2+/Sn)/VE(Pb2+/Pb)/VE(Pb2+/Pb)/VE>0;E(氧化剂)>E(还原剂)例2试判断下列反应:Pb2++SnPb+Sn2+在=时反应自发进行的方向1.氧化还原反应自发进行的判据反应自发向左进行<\n浓度电极反应中有关物质浓度的变化,会引起电极电势的改变,有可能会导致反应方向的改变。2.影响氧化还原反应方向的因素当E(氧化剂)-E(还原剂)>0.2V一般情况下浓度的变化,不会导致E(氧化剂)反应向右进行0.0592V1c(Ag+)=0.050molL-1,c(Cu2+)=1.0molL-1=0.7991V+lg0.050=0.72V(2)非标准态E(Ag+/Ag)=E(Ag+/Ag)+lg[c(Ag+)/c]0.0592V1E0.3400.720.7991(Cu2+/Cu)/VE(Ag+/Ag)/V(Ag+/Ag)/VEE(Ag+/Ag)-E(Cu2+/Cu)=0.7991V-0.340V>0.2V电极反应中有关物质浓度的变化,没有导致反应方向的改变。\n酸度对于某些有含氧酸及其盐参加的氧化还原反应,溶液的酸度有可能导致反应方向的改变。H3AsO4+I-+2H+HAsO2+I2+H2O强酸性介质*强碱性介质向左0.53550.0861.0×10-8碱性向右0.53550.604.0酸性反应方向(I2/I-)VE(H3AsO4/HAsO2)Vc(H+)molL-1介质E2.影响氧化还原反应方向的因素><\n反应首先发生在电极电势差值较大的两个电对之间例在Br-和I-的混合溶液中加入Cl2,哪种离子先被氧化?反应首先在Cl2和I-之间进行3.氧化还原反应进行的次序0.53551.0651.3583I2/I-Br2/Br-Cl2/Cl-电对E解E(Cl2/Cl-)-E(Br2/Br-)>E(Fe3+/Fe2+)\n△rGm-nFElgK=-=-2.303RT2.303RT当R=8.314JK-1mol-1F=96485JV-1T=298.15K4.3.4判断氧化还原反应进行的程度氧化还原反应的平衡常数()只与标准电动势()有关,与物质浓度无关EKElg==K0.0592V0.0592Vn{(+)-(-)}EEn为氧化还原反应中转移电子数值越大,值越大,正反应进行得越完全。EK\nElg==K0.0592V0.0592Vn{(+)-(-)}EEn例1已知反应:Pb2++SnPb+Sn2+计算反应的标准平衡常数解E(Pb2+/Pb)=-0.126V(Sn2+/Sn)=-0.136VElg==K0.0592V0.0592Vz{(+)-(-)}2[(-0.126)-(-0.136)]EE=0.34=2.2K\n例2已知反应:Pb2++SnPb+Sn2+反应开始时c(Pb2+)=2.0molL-1,计算反应达平衡时Pb2+和Sn2+的浓度。c(Sn2+)=1.4molL-1,c(Pb2+)=0.6molL-1Elg==K0.0592V0.0592Vn{(+)-(-)}EEn解Pb2++SnPb+Sn2+平衡浓度/molL-12.0-xxx=1.4===2.2c(Pb2+)/c2.0-xc(Sn2+)/xKc\n说明*1.当n=2时K极小很完全反应进行程度<2.0×10-7>6×106<-0.2V>0.2VE(氧化剂)-(还原剂)E2.电极电势的相对大小不能判断反应速率的大小如:2MnO4-+5Zn+16H+→2Mn2++5Zn2++8H2OElg==K0.0592V0.0592Vn{(+)-(-)}EEnK=2.7×10383EE(MnO4-/Mn2+)=1.51V(Zn2+/Zn)=-0.7626V由可看出,反应理应可完全进行。但实验证明:若用纯Zn与KMnO4反应,反应速率极小,只有在Fe3+的催化下,反应才明显进行。K\nEK反应进行得很完全当n=2时返回极小很完全反应进行程度<2.0×10-7>6×106<-0.2V>0.2V(氧化剂)-(还原剂)KEE例1H2O2+2Fe2++2H+2H2O+2Fe3+E(H2O2/H2O)-(Fe3+/Fe2+)E=1.763V-0.771V=0.992V>0.2Vlg===33.50.0592V0.0592V2×0.992Vz’EKK=3.2×1033[E(氧化剂)-E(还原剂)]与K的关系\n反应进行程度很小返回[E(氧化剂)-E(还原剂)]与K的关系当n=2时极小很完全反应进行程度<2.0×10-7>6×106<-0.2V>0.2V(氧化剂)-(还原剂)KEE例22Fe2++2H+2Fe3++H2=0.000V-0.771V=-0.771V<-0.2V(H+/H2)-(Fe3+/Fe2+)EElg===-26.00.0592V0.0592VKz’E2×(-0.771)VK=1.0×10-26\n=0.60V返回H3AsO4+I-+2H+HAsO2+I2+H2O强酸性介质强碱性介质E(H3AsO4/HAsO2)=0.560V+lg[4.0]20.0592V2c(H+)=4.0molL-1,其它物质浓度均为1.0molL-1(1)酸性介质电极反应:H3AsO4+2H++2e-HAsO2+2H2OE(H3AsO4/HAsO2)=E(H3AsO4/HAsO2)+lg0.0592V[c(H3AsO4)/c]·[c(H+)/c]22c(H3AsO4)/c酸度对氧化还原反应方向的影响\n酸度对氧化还原反应方向的影响=0.086VH3AsO4+I-+2H+HAsO2+I2+H2O强酸性介质强碱性介质其它物质浓度均为1.0molL-1c(H+)=1.0×10-8molL-1(2)碱性介质E(H3AsO4/HAsO2)=0.560V+lg[1.0×10-8]20.0592V2返回电极反应:H3AsO4+2H++2e-HAsO2+2H2OE(H3AsO4/HAsO2)=E(H3AsO4/HAsO2)+lg0.0592V[c(H3AsO4)/c]·[c(H+)/c]22c(H3AsO4)/c\n把同一元素不同氧化数物质所对应电对的标准电极电势,按各物质的氧化值由高到低的顺序排列,并在两种物质之间标出对应电对的标准电极电势。定义4.3.5元素标准电极电势图及其应用AO2H2O2H2O0.6951.7631.229E/VEB/VO2HO2H2O-0.0760.8670.401-\n应用:1123z、z1、z2、z3分别为各电对中氧化型与还原型的氧化数之差EEEEABCDn1n2n3nn=n1+n2+n3EEEE=n1+n2+n3nEEEE计算电对的标准电极电势\n计算电对的标准电极电势应用:1(BrO-/Br2)=n2n4(BrO-/Br-)-n3(Br2/Br-)=(2×0.76-1×1.605)V1=0.455VEEEn4BrO3-BrO-Br2Br-n1n2n3??1.6050.760.61n例1E/VB=n1+n2+n3nEEEE\n计算电对的标准电极电势应用:1=nEEEEn4BrO3-BrO-Br2Br-n1n2n3?0.4551.6050.760.61n例1E/VB(BrO3-/BrO-)=En1n(BrO3-/Br-)–n4(BrO-/Br-)EE=(6×0.61-2×0.76)V4=0.53Vn1+n2+n3\n应用:2反应2Cu+→Cu2++Cu当一种元素处于中间氧化数时,它一部分向高的氧化数状态变化(被氧化),另一部分向低的氧化数状态变化(被还原),这类反应称为歧化反应判断能否发生歧化反应E(Cu2+/Cu+)=0.159VE(Cu+/Cu)=0.520V>Cu2+Cu+Cu0.1590.5200.340E/VA结论:(右)>(左),Cu+易发生歧化反应EE\n应用:3Fe+2H+→Fe2++H2↑故在非氧化性稀酸(如稀盐酸或稀硫酸)中金属铁只能被氧化为Fe2+解释元素的氧化还原特性E/VAFe3+Fe2+Fe0.771-0.44如(1)因(Fe2+/Fe)<0,而(Fe3+/Fe2+)>0EE\n解释元素的氧化还原特性应用:34Fe2++O2+2H+→4Fe3++2H2O所以Fe2+在空气中不稳定易被空气中氧氧化为Fe3+E/VAFe3+Fe2+Fe0.771-0.44如EE(2)因(O2/H2O)=1.229V>(Fe3+/Fe2+)\n解释元素的氧化还原特性应用:3故Fe2+不会发生歧化反应可发生歧化反应的逆反应在Fe2+盐溶液,加入少量金属铁能避免Fe2+空气中氧气氧化为Fe3+Fe+2Fe3+→3Fe2+如E/VAFe3+Fe2+Fe0.771-0.44\nP149:思考题:2~9作业:P151:习题8,9,10,11,13,14\nTheENDThanksforlisteningAnyquestions…