- 2022-08-16 发布 |
- 37.5 KB |
- 87页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
大学化学 晶体结构课件
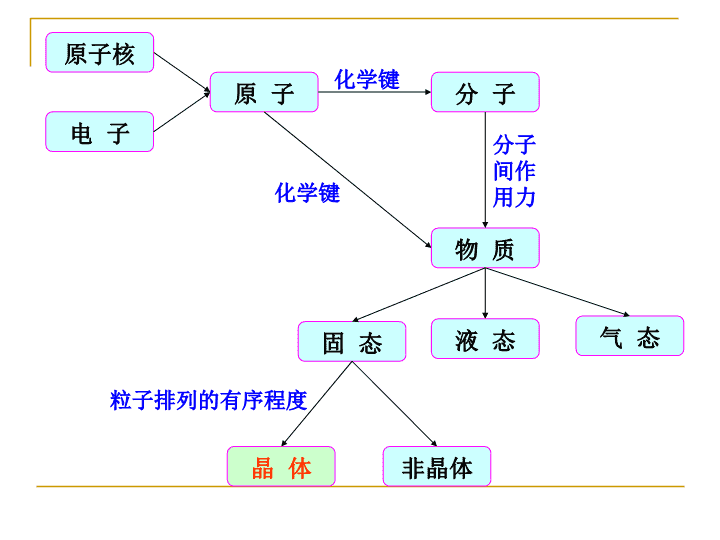
第三章晶体结构Crystalstructure\n原子核电子原子分子物质气态液态固态化学键分子间作用力化学键晶体非晶体粒子排列的有序程度\n晶体的定义晶体是由原子或分子在空间按一定规律周期性地重复排列构成的固体物质。注意(1)一种物质是否是晶体是由其内部结构决定的,而非由外观判断;(2)周期性是晶体结构最基本的特征。\n本章内容晶体的宏观性质晶体的微观性质晶体的基本类型晶体的缺陷物质的其它聚集形态硫石英金刚石与石墨干冰紫水晶黄铁矿\n3-1晶体的宏观性质(1)\n3-1晶体的宏观性质(2)晶体具有规则的几何构形,这是晶体最明显的特征,同一种晶体由于生成条件的不同,外形上可能差别,但晶体的晶面角(interfacialanglt)却不会改变。钻石—晶体玻璃—非晶体\n例如:石英的晶体外形可以各式各样(如下图所示),但它们相应两面间的夹角都是固定不变的数值:\n3-1晶体的宏观性质(3)晶体都有固定的熔点,非晶体在加热时却是先软化,后粘度逐渐小,最后变成液体。\n3-1晶体的宏观性质(4)晶体表现各向异性,例如热、光、电、硬度等常因晶体取向不同而异;而非晶体则为各向同性。例:云母沿层状结构方向易被剥离例:石墨层内导电率比层间高一万倍\n2004年,英国曼彻斯特大学的安德烈·K·海姆(AndreK.Geim)等制备出了石墨烯。2010年10月5日电瑞典皇家科学院5日宣布,将2010年诺贝尔物理学奖授予英国曼彻斯特大学科学家安德烈·K·海姆和康斯坦丁·沃肖洛夫,以表彰他们在石墨烯材料方面的卓越研究。石墨烯的合成方法主要有两种:机械方法和化学方法。机械方法包括微机械分离法、取向附生法和加热SiC的方法;化学方法是化学分散法。(参考《化工新型材料》,2010,38,15).石墨烯—改变世界的新材料\n\n3-1晶体的宏观性质(5)宏观上判断晶体与非晶体,应综合以上三方面的特点来考察,单从一方面进行判断是不充分的。为什么晶体与非晶体上存在如此大的差异?内部结构不同(结构决定性质,性质反映结构)如何探测内部结构?衍射实验(X衍射和电子衍射)\n晶体X射线衍射图\n关于晶体与非晶体从热力学的角度看晶体一般都具有最低能量,因而较为稳定;非晶体一般能量较高都处于介稳或亚稳态。晶体和非晶体之间无绝对界线同一物质在不同条件下既可形成晶体,又可形成非晶体,彼此之间在一定条件下可以实现转化。\n3-2晶体的微观性质(1)点阵与晶格从1912年劳厄(Laue)开始用x射线研究晶体结构至今,大量的事实证明晶体内部的质点具有周期性重复规律。为了便于研究晶体中微粒(原子,离子或分子)在空间排列的规律和特点,将晶体中按周期重复的那一部分微粒抽象成几何质点(晶格结点),联结其中任意两点所组成的向量进行无限平移,这一套点的无限组合就叫做点阵。直线点阵平面点阵平面格子空间点阵空间格子(晶格)\n3-1晶体的微观性质(2)晶胞在晶格中,能表现出其结构一切特征的最小部分称为晶胞。晶胞是充分反映晶体对称性的基本结构单位,其在三维空间有规则地重复排列便组成了晶格(晶体)。晶格晶胞(平行六面体)结点\n晶胞参数晶胞的大小和形状由六个参数决定,称为晶胞参数或点阵参数(latticeparameters)a、b、c不一定相等也不一定垂直\n晶系晶系边长角度实例立方晶系a=b=cα=β=γ=90°岩盐(NaCl)四方晶系a=b≠cα=β=γ=90°白锡六方晶系a=b≠cα=β=90°γ=120°石墨三方晶系a=b=cα=β=γ≠90°(<120°)方解石(CaCO3)正交晶系a≠b≠cα=β=γ=90°斜方硫单斜晶系a≠b≠cα=β=90°γ>90°单斜硫三斜晶系a≠b≠cα≠β≠γ重铬酸钾\n与晶系对应的晶胞αβγbac立方abc四方bac正交cba三方六方bacabc单斜bac三斜\n结点在晶胞上的分布类型简单格子(P):仅在单位平行六面体的8个顶角上有结点;底心格子(C):除8个顶角上有结点外,平行六面体上、下两个平行面的中心各有一个结点;体心格子(I):除8个顶角上有结点外,平行六面体的体心还有一个结点;面心格子(F):除8个顶角有结点外,平行六面体的6个面的面心上都有一个结点。\n七个晶系中又包含十四种晶格\n关于点群的概念各种晶体在外观上均呈现某种对称性,能够使晶体外形复原的操作称为对称操作,据以进行对称操作的几何点(对称中心)、线(对称轴360/n;反轴)、面(镜面)称为对称元素。所谓点群指描述晶体宏观对称性的对称操作群,根据所含对称元素的不同,可以分为32个点群。\n晶体结构的表达一般描述晶体结构需给出:晶系;晶胞参数;晶胞中所包含的原子或分子数Z;特征原子的坐标。\n{[Cu(1,2-phda)(dpa)]3·H2O}n晶系:Triclinic,空间群:P-1,晶胞参数:a=8.142(3),b=8.335(3),c=14.222(4),a=99.369(5),b=81.920(4),g=79.925(3),V=940.9(5),Z=2.Sposato,L.K.CrystalGrowth&Design,2010,10,335.\n单晶与多晶单晶体是由一个晶核(微小的晶体)各向均匀生长而成的晶体,其内部的粒子基本上是按照某种规律整齐排列的。多晶体由多个单晶体颗粒杂乱地聚结而成的晶体,由于单晶体的杂乱排列,使晶体的各向异性消失。\n3-3晶体的基本类型根据晶体中质点以及质点之间的作用力,可以把晶体分为:金属晶体离子晶体原子晶体分子晶体混合晶体\n1.金属晶体(1)-金属键理论金属原子价电子少,不足以使金属晶体中原子间形成正规的共价键或离子键,金属在形成晶体时倾向于组成极为紧密的结构,使每个原子拥有尽可能多的相邻原子,通常是8或12个原子。例如金属钠,它只有1个价电子,它在晶格中的配位数是8,属体心立方结构,那么它是怎样同相邻的8个原子结合起来的呢?为了说明金属键的本质,现在发展起来两种金属键理论。体心立方六方紧堆\n1.改性共价键理论金属原子和金属正离子沉浸在“电子海(electronsea)”中。1.金属晶体(1)-金属键理论\n2.能带理论从分子轨道理论发展金属键能带理论。在金属晶体中,原子轨道组合形成分子轨道,称为能带。原来等能量的原子轨道在能带中分裂成许多能量间隔差别很小的连续能级,电子按照充填规则占入各能级中。1.金属晶体(1)-金属键理论\n2.能带理论金属锂的1s原子轨道组成1s能带,每个能级可以充入2个电子,所以1s能带是全充满的,叫做满带,满带对导电性没有贡献。1.金属晶体(1)-金属键理论\n2.能带理论金属锂的2s轨道组合成2s能带,锂原子的2s轨道上只有1个电子,在能带中能级只能半充满,有一半能级是空的,可供电子自由驰骋,这个能带叫做价带。1.金属晶体(1)-金属键理论\n2.能带理论金属锂的2p轨道组成2p能带,锂原子的2s与2p轨道能级接近,发生能带的重叠,组合成为一个能带,共有4n个原子能级,能容纳8n个电子,而金属锂的该能带只有1/8充满,电子自由活动的空间大为广阔,这个2p能带叫做导带。1.金属晶体(1)-金属键理论\n2.能带理论能带之间的能量间隔叫做禁带,即电子不可能逾越的区域,例如电子不易从1s能带跃迁到2s能带。1.金属晶体(1)-金属键理论\n2.能带理论在金属晶体中,电子占用或部分占用的价带与未被占用的导带相重叠,电子只需要很少的能量就可以向较高的能级跃迁,所有的能级是连续的和靠近的。因此金属有高导电性,高导热性和有金属光泽的外貌。1.金属晶体(1)-金属键理论\n2.能带理论1.金属晶体(1)-金属键理论\n一般共价键:两电子两中心金属键:少电子多中心金属键没有方向性和饱和性金属中自由电子能很好说明金属的导电性、导热性、延展性、可塑性、有金属光泽等;金属原子自由电子越多,金属键就越强,金属的熔沸点就越高,相对密度和硬度越大。1.金属晶体(1)-金属键理论\n成键时价电子必须是“离域”的,所有的价电子应该属于整个金属晶格的原子所共有;金属晶格中原子很密集,能组成许多分子轨道,而且相邻的分子轨道间的能量差很小,以致形成“能带”;“能带”也可以看成是紧密堆积的金属原子的电子能级发生的重叠,这种能带是属于整个金属晶体的;以原子轨道能级的不同,金属晶体中可有不同的能带,例如导带、价带、禁带等;金属中相邻的能带有时可以互相重叠。1.金属晶体(1)-金属键理论\n金属的结构特点金属晶体中,晶格结点上排列着金属原子,晶格结点间以金属键相结合;金属键没有方向性、饱和性,属晶体的结构可以看作等径圆球的密堆积;金属晶体中金属原子的配位数高;不同的金属单质,可能有不同的晶格类型,同种金属在不同的温度下,也可能发生晶格类型的转变。1.金属晶体(2)-金属晶体\n金属型晶体的晶格体心立方面心立方密堆积六方密堆积\n密置层与非密置层如果将等径园球在一平面上排列,有两种排布方式,如图:按(a)图方式排列,园球周围剩余空隙最小,称为密置层;按(b)图方式排列,剩余的空隙较大,称为非密置层。由密置层按一定方式堆积起来的结构称为密堆积结构。\n两层球的堆积情况图八面体空隙四面体空隙\n面心立方最密堆积六方最密堆积\n面心立方最密堆积分解图\n六方最密堆积分解图\n体心立方密堆积非最密堆积体心立方晶胞堆积情况配位情况\n堆积方式及性质小结堆积方式晶胞类型空间利用率配位数实例面心立方最密堆积面心立方74%12Cu、Ag、Au六方最密堆积六方74%12Mg、Zn、Ti体心立方密堆积体心立方68%8(14)Na、K、Fe金刚石型堆积面心立方34%4Sn简单立方堆积简单立方52%6Po\n2.离子型晶体(1)半径比规则(2)几种简单的离子型晶体(3)离子型晶体的特点(4)离子型晶体的晶格能由离子键形成的化合物叫做离子型化合物,离子型化合物主要以晶体状态出现,由正、负离子通过离子键结合成的晶体称为离子型晶体。离子键的强度可以用晶格能的大小来度量。\n由于原子核外电子不是沿着固定的轨道运动,电子云没有明确的边界,因此原子或离子的半径无法严格确定;当正、负离子间的吸引力和核外电子与电子之间以及原子核与原子核之间的排斥力达到平衡时,正、负离子之间保持着一定的平衡距离,这个距离叫核间距(nuclearseparation),结晶学上以d来表示。核间距可以用X射线衍射的方法测得,由此可计算出离子或原子半径(作用范围)的大小。正、负离子半径与核间距的关系.d=r1+r2.r1r2.(1)半径比规则\n离子半径变化规律:①同族元素,自上而下,具有相同电荷数的离子的半径依次增大;Li+<Na+<K+<Rb+<Cs+;F¯<Cl¯<Br¯<I¯②同一周期,自左向右,随正离子电荷数的依次增大,离子半径依次减小;Na+>Mg2+>Al3+③同一元素负离子半径大于原子半径,正离子半径小于原子半径,不同价态的正离子,半径随离子电荷升高而减小;Fe(117pm)>Fe2+(76pm)>Fe3+(67pm)F¯(136pm)>F(64pm)(1)半径比规则\nLi+60pmMg2+65pm④负离子的半径一般较大,约为130~250pm,正离子半径一般较小,约为10~170pm;⑤周期表中处于相邻族的左上方和右下方斜对角线上的正离子半径近似相等;Na+95pmCa2+99pm离子半径变化规律:(1)半径比规则\n(1)半径比规则以正、负离子配位数为6的晶体的一层为例令r-=1,则ac=4;ab=bc=2r++2因ab2+bc2=ac2r+=0.414;即r+/r-=0.414\n(1)半径比规则当r+/r-0.414时,负离子接触,正、负离子彼此不接触。体系的排斥力大于吸引力,该构型不稳定,趋向于形成配位数少的构型。当r+/r-0.414时,负离子彼此不接触,正、负离子之间接触,此时,吸引力大于排斥力,该构型可以稳定存在。当r+/r-0.732时,正离子表面可以接触更多的负离子,晶体的配位数增大。r+/r-<0.414r+/r->0.414\n(2)几种简单的离子型晶体面心立方晶格,每个离子被6个相反电荷的离子包围着,配位数为6。LiF、CsF、NaI等属于NaCl型。简单立方晶格,每个离子被8个相反电荷的离子包围着,配位数为8。CsBr、CsI等晶体属于CsCl型。NaCl型CsCl型\n(2)几种简单的离子型晶体面心立方晶格,S2-按面心立方密堆积排布,Zn2+均匀地填充在一半四面体的空隙中,正、负离子的配位数均为4,ZnO、HgS、CuCl、BeO等晶体属于ZnS型。六方晶系,S2-作六方最密堆积,Zn2+填充在一半四面体空隙之中,填隙时互相间隔开,使填系四面体不会出现共面连接或共边连接,配位数为4。闪锌矿(立方ZnS)纤锌矿(六方ZnS)\n(2)几种简单的离子型晶体与闪锌矿结构类似。Ca2+的配位数为8,F¯的配位数为4,正负离子数比为4:8=1:2,BaF2,SrCl2,ThO2等具有CaF2型结构。四方晶体,正离子Ti4+的配位数为6,负离子O2-的配位数为3。Ti4+处于配位数为6的八面体中。CaF2型(萤石)金红石型(TiO2)\n空间构型晶胞类型正、负离子的配位数每个晶胞中的分子数示例CsCl型简单立方81TlCl、CsBr、CsINaCl型面心立方64NaF、MgO、NaBr、KIZnS型由Zn2+和S2-各组成的面心立方在轴向1/4处穿插形成44BeO、ZnSe(2)几种简单的离子型晶体AB型离子晶体离子半径比与晶体构型的对应关系\n(3)离子型晶体的特点①离子型晶体中,正、负离子通过离子键结合,离子的电荷越高,半径越小(核间距越小),正、负离子间的静电作用力越强,其熔、沸点也就越高;离子型晶体一般具有较高的熔、沸点和硬度;化合物NaClKClCaOMgO半径pmNa+95Cl-181K+133Cl-181Ca2+99O2-140Mg2+65O2-140熔点K1074104128453073沸点K1686169031233873\n(3)离子型晶体的特点②离子型晶体的硬度虽大,但比较脆,延展性较差;当晶体受到冲击力时,各层离子位置发生错动(位错),使吸引力大大减弱而易破碎;+-+-+-+--+-+-+-+-+-+-+-++-+-+-+-位错\n(3)离子型晶体的特点③离子型晶体在熔融状态或在水溶液中都具有良好的导电性,但在固体状态,由于离子被限制在晶格的一定位置上振动,所以固体状态不导电;④离子型晶体中,不存在单个分子,整个晶体就是一个巨型分子;严格说NaCl、CsCl不能叫分子式,只能叫化学式或最简式。\n(4)离子型晶体的晶格能晶格能定义:★相互远离的气态正离子和负离子结合成离子晶体时所释放的能量,以符号U表示,单位为kJ·mol-1。★有些书上将晶格能定义为在100kPa、298K标准条件下,将1mol离子型晶体拆散为1mol气态阳离子和1mol气态阴离子所需要的能量。★晶格能不能用实验的方法直接测得,可以通过热化学计算从有关的实验数据间接计算得到。\n(4)离子型晶体的晶格能玻恩-哈伯循环法计算NaCl晶格能\n晶格能与物理性质对晶体结构相同的离子化合物,离子电荷越多,核间距越短,晶格能就越大,相应物质的熔点就高,硬度就大。(4)离子型晶体的晶格能\n3.原子晶体亦称共价晶体,晶格结点上是中性原子,原子与原子之间以共价键相结合(非密堆积),不断向周围空间延伸,形成一个巨大的分子。共价键有方向性和饱和性,因此原子晶体一般硬度大,熔点高,不导电,溶解性差,不具延展性。代表:金刚石、Si、Ge、Sn等的单质,SiC、SiO2等\n金刚石的晶体结构与晶胞金刚石的晶体结构金刚石的晶胞(面心立方)\n石英的晶体结构与晶胞\n4.分子晶体定义:单原子分子或以共价键结合的有限分子,由范德华力凝聚而成的晶体。范围:全部稀有气体单质、许多非金属单质、一些非金属氧化物和绝大多数有机化合物都属于分子晶体。特点:以分子间作用力结合,相对较弱。除范德华力外,氢键是有些分子晶体中重要的作用力。\n干冰及其晶胞\n冰-Ⅶ的晶胞结构示意图\n富勒烯由于分子间作用力没有方向性和饱和性,所以对于那些球形和近似球形的分子,通常也采用配位数高达12的最紧密堆积方式组成分子晶体,这样可以使能量降低。最典型的球形分子是1985年才发现的C60分子,60个C原子组成一个笼状的多面体园球,球面有20个六元环,12个五元环。经X射线衍射法确定,球烯C60也是面心立方密堆积结构。\n5.混合晶体晶格的结点之间含有2种或2种以上结合力的晶体称为混合晶体层状晶体(石墨、云母、黑磷)链状晶体(石棉)\n层状晶体石墨C为sp2杂化,同一平面的C形成离域大键沿层面导电、导热能力好熔点高,性质稳定兼具原子晶体、金属晶体和分子晶体特征\n[M2+1-xM3+x(OH)2][An-x/n·mH2O](M2+=Fe,Co,Ni,Cu,Zn;M3+=Fe,Co,Alet.alMa,R.Z.J.Am.Chem.Soc.,2007,129,5257-5263.\n链状晶体石棉是镁、铁、钙硅酸盐矿物的总称。链内硅氧原子间为带共价性的离子键,链状阴离子之间通过相隔较远的金属阳离子以离子键相结,因此链间结合力比链内结合力弱,故解理时易形成纤维。\n3-4晶体缺陷完美晶体只有在绝对零度时才存在,在0K以上,晶体中不规则、不完整的结构,称之为晶体缺陷。按来源分为结构缺陷和化学缺陷按几何形式分为点缺陷、线缺陷、面缺陷和体缺陷\nAgBr晶体缺陷示意图完美晶体缺陷晶体\n化学缺陷由于外来原子进入晶体内部而产生的缺陷,有置换和填隙两种方式,\n3-5物质的其它聚集形态非晶体、准晶体、液晶、纳米材等\n非晶体非晶态物质内部结构没有周期性特点,而是杂乱无章地排列,如:玻璃、松香、明胶等等。非晶体不具有晶体物质的共性,某些非晶态物质具有优良的性质。\n准晶体\n准晶体(1)准晶体是1984年科学家发现的一种新的物质聚集形态。一种介于晶体和非晶体之间的固体。准晶体具有完全有序的结构,然而又不具有晶体所应有的平移对称性,因而可以具有晶体所不允许的宏观对称性,例如五次对称轴等。\n准晶体(2)准晶体的发现一方面极大地深化了我们对晶体学、衍射物理和凝聚态物理地的认识;另一方面,准晶体的各种独特性质使准晶体具有潜在的应用价值。\n液晶\n液晶的发现1888年,奥地利植物学家莱尼茨尔在做加热胆甾醇苯甲酸脂结晶的实验时发现:在145.5摄氏度时,结晶凝结成浑浊粘稠的液体,加热到178.5摄氏度时,形成了透明的液体.德国物理学家莱曼用偏光显微镜观察时,发现这种材料有双折射现象,他阐明了这一现象并提出了“液晶”这一学术用语.\n液晶材料液晶的发现已经有100多年的历史,但近20年来才获得了快速的发展。这是因为液晶材料的光电效应被发现。因而被应用在低电压和轻薄短小的显示组件上。目前液晶材料已被广泛应用于计算机显示屏,电子表,手机,计算器等电子产品上。成为显示工业不可或缺的重要材料。\n按照液晶的形成条件分类采用降温的方法,既将熔融的液体降温,当降温到一定程度后分子的取向有序化,从而获得液晶态.有机分子溶解在溶剂中,使溶液中溶质的浓度增加,溶剂的浓度减小,有机分子的排列有序而获得液晶.熔致液晶热致液晶\n构成液晶态的结构单元1.棒状分子2.盘状分子3.由长链或盘状分子连接而成的柔性长链聚合物4.由双亲分子自组装而成的膜\n生活中的液晶显示材料back查看更多