- 2022-08-16 发布 |
- 37.5 KB |
- 49页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
大学化学05卤代烷
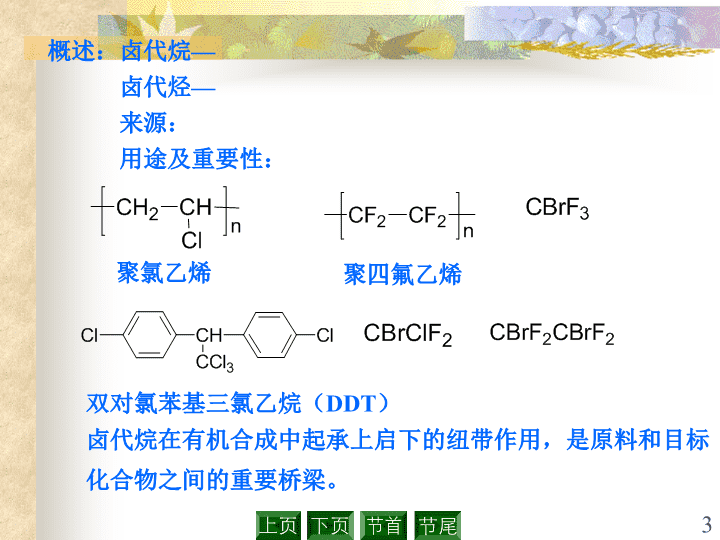
第五章卤代烷(Alkylhalides)1\n一.卤代烷的命名二.一卤代烷的反应三.亲核取代反应机理四.一卤代烷的制备五.有机金属化合物第五章卤代烷(Alkylhalides)2\n概述:卤代烷—卤代烃—来源:用途及重要性:聚氯乙烯聚四氟乙烯双对氯苯基三氯乙烷(DDT)卤代烷在有机合成中起承上启下的纽带作用,是原料和目标化合物之间的重要桥梁。3\n一.卤代烷的命名(NomenclatureofAlkylHalides)1.习惯命名规则:先叫取代基后叫卤素。叔丁基氯环己基溴仲丁基溴氯仿溴仿碘仿全氟丙烷注意:4\n2.系统命名规则:卤素原子作为取代基,母体为烷烃。1-氯丁烷2-甲基-3-溴丁烷7,7-二甲基-1-氯二环[2.2.1]庚烷7,7-二氯二环[4.1.0]庚烷5\n顺-1-甲基-2-氯环己烷R,S命名?(S)-2-甲基-3-溴丁烷二氟二氯甲烷氟里昂-12,即F12注意:多氟化合物的商品名。注意:卤素原子和伯碳原子相连的叫伯卤代烷。卤素原子和仲碳原子相连的叫仲卤代烷。卤素原子和叔碳原子相连的叫叔卤代烷。6\n二.一卤代烷的反应(ChemicalReactionsofAlkylHalides)结构特点:负性试剂X带一对电子离去取代反应负性试剂消去反应1.取代反应1).与水作用例:7\n2).与醇钠作用用于制备混合醚Williamson反应3).与氰化钠、氰化钾作用例:NaCN增长碳链的方法4).与氨作用8\n5).与卤离子作用(Cl、Br)(Cl、Br)除了上述负性试剂外还有:等上述试剂的特点:负性基团或多电子基团负性基团或多电子基团在反应中进攻反应物的正性部分,叫亲核取代反应,用SN(NucleophilicSubstitution)表示。9\n把负性基团或多电子基团叫亲核试剂。亲核试剂底物离去基团2.消去反应从一个分子中消去一个小分子的反应,例:HX。常用的催化剂是强碱,例:乙醇钠的乙醇溶液。消去方式:1,1-消去、1,2-消去。1).1,1-消去(α-消去)卡宾10\n卡宾:及其衍生物的总称,例:二氯卡宾。2).1,2-消去(β-消去)是制备烯烃的一种重要方法。例:例:11\n注意①.消去与取代的竞争21%79%取代产物和消去产物的多少主要取决于反应条件和底物结构。②.消去方向的问题例:81%19%扎衣切夫(Saytzeff)规则:在β-消去中,当有两种β-H时,总是从含H最少的β-C上消去H,即得到双键碳上取代基较多的烯烃—扎衣切夫烯烃。12\n3.还原反应1).一卤代烷被还原为烷烃,是制备烷烃的一种重要方法。2).常用还原剂:四氢铝锂(LiAlH4),硼氢化钠(NaBH4)或硼氢化钾(KBH4)。+++反应活性:>>伯卤代烷仲卤代烷叔卤代烷>>机理:13\n三.亲核取代反应机理(MechanismforNucleophilicSubstitutionReactions)概述:SN1:单分子亲核取代反应。SN2:双分子亲核取代反应。20世纪30年代英国伦敦大学教授英果(C.Ingold)就提出了:14\n1.双分子亲核取代机理(SN2)以溴甲烷碱性水解为例:根据实验事实:在决定反应速度步骤中一定包含有两种粒子的碰撞。过渡态1).机理:亲核试剂底物产物δ–δ–15\n2).SN2的特点不分阶段,协同进行,一步完成。反应中经过一个过渡态,没中间体。3).反应动力学二级反应V=K[RX][Nu-]4).反应能线图过渡态EEact反应坐标δ–δ–16\n5).SN2的立体化学++实验:旋光性的2-碘辛烷与放射性碘负离子进行卤素交换反应,发现在反应过程中,外消旋化的速度是卤素交换反应的2倍。由此说明,反应是按下列机理进行:即亲核试剂I*是从背面进攻,发生骨架构型转变。根据机理,SN2立体化学的特点是:骨架构型转变。因为骨架构型转变是瓦尔登发现的,所以叫瓦尔登转变。设想:亲核试剂I*是从前面进攻或前后进攻机会相等会怎样?17\n例:+(R)(S)注意:瓦尔登转变是指骨架构型转变,不是指R转为S或S转为R。例:+(R)(R)18\n19\n6).位阻效应由机理可知:伯卤代烷一般按SN2反应。仲卤一般按SN1、SN2反应。叔卤一般不按SN2反应,而按SN1反应。7).试剂的亲核性亲核试剂一般是多电子或带负电荷的基团,具有碱性。碱性:提供电子对和质子结合的能力。结论:试剂的亲核性越强,越易和底物发生SN2反应。怎样判断试剂亲核性强弱呢?试剂的亲核性与下列因素有关:①.试剂的碱性20\n碱性与亲核性共同点:提供电子对和带正电荷的实体结合。所以一般碱性与亲核性一致,试剂碱性强,亲核性就强。例:碱性:亲核性:>>>>>>>>>例:碱性:亲核性:亲核性:提供电子对和带部分正电荷的碳结合的能力。21\n试剂的可极化性越大,其亲核性就越强。试剂的可极化性:指它的外层电子云在外界电场作用下发生变形的难易程度。>>例:②.试剂的可极化性③.溶剂的影响亲核试剂的强弱还与溶剂有一定的关系,主要指亲核试剂溶剂化作用的影响。例:在非质子性溶剂(DMF)中:碱性:>>>亲核性:>>>22\n8).离去基团结论:离去倾向越大,SN2越易进行。离去倾向:>>>例:在质子性溶剂(C2H5OH,H2O)中:碱性:>>>亲核性:>>>卤代烷的亲核取代反应一般是在质子性溶剂中进行,所以常常说I–是较强的亲核试剂。离去基团的碱性弱(不易给出电子,有较强的承受负电荷的能力),离开中心碳原子的倾向强。I–是较好的离去基团。23\n好的离去基团有:不好的离去基团有:硫酸根、硫酸酯的酸根、磺酸根都是好的离去基团。这是因为:氧上的负电荷可以通过硫离域到整个酸根上,从而使负离子稳定,所以负离子易离去。24\n以叔丁基溴碱性水解为例:根据实验事实:在整个反应过程中决定反应速度步骤与碱的浓度无关。2.单分子亲核取代机理(SN1)1).机理第一步过渡态1中间体第二步过渡态225\n第一步为决定反应速度的步骤。2).反应特点分两步进行,有中间体碳正离子生成。碳正离子的稳定性:>>>(用σ–p超共轭效应解释)即:3oC+>2oC+>1oC+>+CH3电子效应:有利于正电荷分散的取代基使碳正离子稳定。空间效应:当碳与三个大的基团相连时,有利于碳正离子的形成。26\n3).反应动力学一级反应V=K[RX]在决定反应速度步骤中,有一个分子参加。例:3oC+>2oC+,烯丙基C+>1oC+>+CH3注意:(a)虽为二级碳正离子,但未受到桥键的影响,所以相对较稳定。(b)(c)(d)均为三级碳正离子,但受到桥键的影响,与(a)相比,相对较不稳定。桥越短,张力越大,越不稳定,因此(d)最不稳定,另外也要考虑构象,椅型较船型稳定,故(b)比(c)稳定。27\n4).反应能线图Eact1Eact2过渡态1过渡态2E反应坐标从反应的活化能可看出:第一步为决定反应速度的步骤。28\n5).立体化学SN1反应的活性中间体为碳正离子,结构为:sp2杂化:平面结构若底物旋光,取代后得到的产物是外消旋的。但在大多数实验中,只得到部分外消旋产物。29\n30\n①.离子对机理认为底物在溶剂中解离是分步的,并按如下方式形成离子对:+分子骨架构型转化紧密离子对骨架构型转化典型SN2溶剂分割离子对部分外消旋化碳正离子外消旋化典型SN1碳正离子越稳定,解离程度越大,碳正离子起的作用就越突出。若碳正离子不稳定,而试剂的亲核性又比较强,那么分子和紧密离子对的作用就越突出。例:α–苯基氯乙烷水解时,87%发生外消旋化,13%发生构型转化。31\n②.邻基参与实验事实:S–乳酸盐S–2–溴丙酸盐这一实验现象无法用SN2、SN1及离子对机理解释。后来研究这个反应的过程如下:32\n33\n邻基参与:当能够提供电子的基团处于中心碳原子邻近位置时,它们通过某种环状中间体参与亲核取代反应,其结果不仅加快了反应速度,而且使产物具有一定的立体化学特征,有时还会得到重排产物。6).溶剂的影响溶剂极性越强,越易发生SN1反应。对于SN1反应,决定反应速度步骤为卤代烷离解为碳正离子,从反应物到碳正离子的变化过程,正负电荷集中,使体系极性增强,极性溶剂有利于稳定它们的过渡态,降低活化能使反应速度加快。极性溶剂有利于SN1反应。34\n7).卤代烷类型由机理可知:叔卤代烷一般按SN1反应。仲卤一般按SN1、SN2反应。伯卤一般按SN2反应。8).离去基团结论:离去倾向越大,SN1越易进行。注意:①稀丙型、苄型卤代烷都很容易进行SN1和SN2反应。因为:若按SN1进行,中间体C+稳定。若按SN2进行,过渡态稳定。140120VSN235\n②苯型、乙稀型卤代烃较难发生亲核取代(SN)反应。因为:若按SN1进行,C–X键不易断裂。若按SN2进行,不能发生瓦尔登转化。③桥头卤素,不利于SN反应(比苯型、乙稀型卤代烃更难)。因为:若按SN1进行,不利于形成平面结构。若按SN2进行,不利于亲核试剂从背面进攻。110-310-6VSN110-1336\n四.一卤代烷的制备(PreparationsofAlkylHalides)1.烷烃的卤代烷烃卤代比较复杂,得到一个混合物,少数情况才用。2.烯烃与卤化氢加成例:+84%例:37\n可以用来制备伯、仲、叔卤代烷。3.醇的取代常用试剂:HX、PX3、PX5和SOCl2。例:++95%4.卤素交换反应是由氯代烷、溴代烷制备碘代烷的好方法。++38\n五.有机金属化合物(OrganometallicCompounds)1.有机锂化合物++例:++2.有机镁化合物+Grignard试剂(格利雅试剂或格氏试剂)有极性很强的C—Mg键,可提供负碳离子。①.常用溶剂:干乙醚②.格氏试剂可与活性氢反应39\n+′′′+′′′、③.可以和羰基加成。④.和活泼卤代烃反应。例:++用于制备炔化物格氏试剂40\n⑤.合成上的应用例:实现下列转变:解:41\n例:从相应的环烷烃制备下列化合物:解:解:42\n3.二烷基铜锂++应用:常用来合成+++一般为伯卤代烷例:+98%+84%43\n75%例:用6个碳以下的卤化物合成解:44\n4.有机锌化合物(自学)练习:HI解:注意:格氏试剂只能和活泼的卤代烃:发生偶联反应得到烃类化合物,而伯卤代烷、仲卤代烷不发生此反应。45\n英果是伦敦大学学院教授,物理有机化学的创始人,著作很多。他是中介论的创立者。当鲍林和威兰特的关于共振论论文发表之后,英果立即于1934年对共振论表示赞同,并称为“物理学原理”,而他把自己的理论称之为“化学原理”,而他表示,“中介”一词是更为合理的概念。到1938年,英果在《关于苯的结构》一文中进一步把中介论和共振论融合起来。附录:英果(C.Ingold,1893~1970,英国化学家)返回46\n返回扎依切夫是有机结构理论奠基人布特列洛夫的学生。从1869年起任喀山大学的讲师,1870年任教授。培养了无数卓越的有机化学家。他曾致力于布特列洛夫的第二,第三醇合成法的研究,不饱和酸和羟基酸的研究,曾发现过环状内酯。在1875年第一次提出脱卤化氢反应的取向"法则"。这种优先形成稳定异构体取向称为"扎依切夫取向"。扎依切夫(A.M.Saytzeff,1841–1910,俄国)47\n瓦尔登生于1863年7月26日,是帝俄时代的拉脱维亚人。幼年丧父母成为孤儿。在当地以优异的成绩小学毕业后,被公费保送到拉脱维亚的里加(Riga)上中学,成绩优异。1882年19岁中学毕业,进入里加很有名的工业大学。1887年他跟着他的老师,当时颇有名望的化学教授威廉·奥斯特瓦尔德去德国莱比锡大学,一面从事研究工作,一面做私人教师来维持生活,所以他于28岁时才获得博士学位。后来他回到母校工作,从助教、讲师、教授、教务长一直到校长。主要从事有机化学教学,并从事物理化学研究。1897–1899年这三年间,他从事有机立体化学研究,发现了著名的瓦尔登转化现象。由此引起英、美、德、意等国许多化学家进行类似的研究,使他成为国际上知名的化学家。瓦尔登(PaulWalden,1863--1957)48\n瓦尔登在1906年被选为俄罗斯科学院院士。从1919年起被德国的罗斯托克大学聘任为教授。从此他成为国际化学界很活跃的一位化学家。1929年受聘为美国康乃克大学的客座教授。1934年他曾担任第九届国际“纯粹和应用化学联合会”的会长,历时四年。1942年第二次世界大战期间,他在罗斯托克的家被毁,他不得不逃到德国土宾根,成了土宾根大学的客座教授。 瓦尔登一生的著作很多,发表论文将近二百篇。他写的书有《瓦尔登转化》(1919),《非水溶液》(1924),《作为化学家的歌德》(1932),《化学简史》(1947)等。他一生名誉很多,得过许多国外大学授予的荣誉学位,得过很多国外学术机构赠的奖章。他之所以取得惊人的成就是勤奋努力的结果,他自己说,曾经有些年每天只睡上3-4小时,而大部分时间用来读书和做实验研究。 瓦尔登于1957年1月22日在土宾根因病逝世,享年94岁。返回49查看更多