- 2022-08-16 发布 |
- 37.5 KB |
- 65页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
大学化学第3章-1
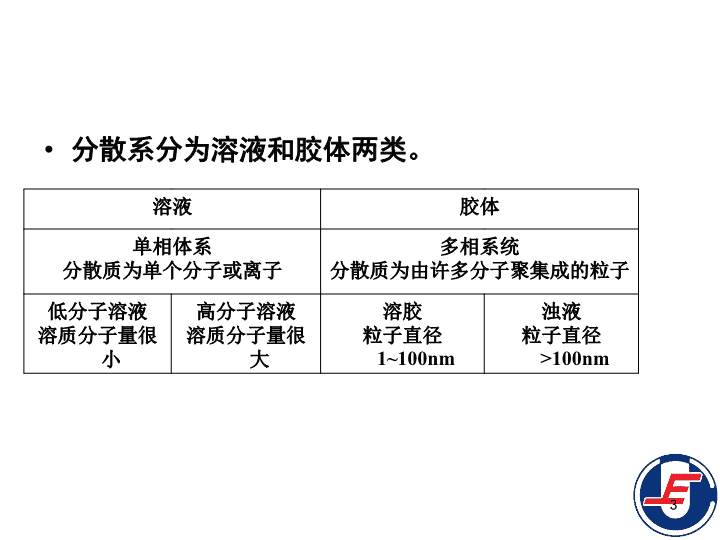
第3章溶液和胶体3.1溶液3.2均相离子平衡3.3酸碱的质子理论3.4沉淀—溶解平衡3.5胶体3.6表面活性剂1\n3.1.1分散系统的基本概念分散系:一种物质的微小粒子分散在另一种物质中组成的系统称为分散系。分散系由分散质和分散剂组成。被分散的物质称为分散质;起分散作用的物质,即分散质周围的介质称为分散剂。例如食盐水糖水泥浆牛奶2\n分散系分为溶液和胶体两类。溶液胶体单相体系分散质为单个分子或离子多相系统分散质为由许多分子聚集成的粒子低分子溶液溶质分子量很小高分子溶液溶质分子量很大溶胶粒子直径1~100nm浊液粒子直径>100nm3\n3.1.2溶液浓度的表示方法(1)物质B的质量浓度ρB=mB/VmB—溶质B的质量;V—溶液总体积。ρB单位:SI:kg·m-3,常用:g·L-1。(2)物质B的量浓度cB=nB/VnB—溶质B的物质的量。cB单位:SI:mol·m-3,常用:mol·L-1。4\n3.1.2溶液浓度的表示方法(3)物质B的质量摩尔浓度bB=nB/mAmA—溶剂A的质量,kg。bB单位:mol·kg-1。(4)物质B的摩尔分数xB=nB/nn—溶液中各组分的物质的量之和,mol。xB的量纲为1。5\n3.1.3稀溶液通性稀溶液具有一些共同的特性,如:溶液的蒸气压下降沸点升高凝固点下降产生渗透压这些通性都和溶液中溶质的粒子数(浓度)有关,而与溶质的本性无关,这类性质称为稀溶液的依数性。6\n(1)蒸汽压下降如果在某一液体中溶解少量难挥发的溶质后,溶液的蒸汽压就会下降。1886年,拉乌尔通过实验提出了溶液蒸气压下降的关系式:pA=xApA*pA—溶液上方溶剂的蒸气压;xA—溶液中溶剂的摩尔分数;pA*—纯溶剂的饱和蒸气压。纯溶剂A溶液溶剂A+溶质BpA*pA7\n如果溶液中只有一种溶质,其摩尔分数为xB,则xA=1-xBpA=(1-xB)pA*pA*-pA=△pA=xBpA*即蒸汽压下降值△pA等于同温度下纯溶剂的饱和蒸汽压pA*与溶液中溶质的摩尔分数xB的乘积。这就是拉乌尔定律。拉乌尔定律适用的范围溶质为难挥发的非电解质的稀溶液。pA=xApA*8\n溶液蒸气压下降的原因,可用分子运动论来解释:液体的蒸气压是液体和蒸气建立平衡时的蒸气压力,所以液体的蒸气压与单位时间内由液面蒸发的分子数有关。由于溶质的加入,必然会降低单位体积溶液内所含溶剂分子的数目,溶液的部分表面也被难挥发的溶质分子所占据。因此单位时间内逸出液面的溶剂分子数相应减少,这样蒸气中含有较少的溶剂分子已能和溶液处于平衡状态,所以溶液的蒸气压要比纯溶剂的蒸气压低。溶液的蒸气压下降必然引起沸点升高、凝固点下降和产生渗透压。9\n从这张图中可以看出,在任何温度下,溶液的蒸汽压总是低于纯水的蒸气压。液体的沸点是液体的蒸气压等于外界压力时的温度。因此,在水的标准沸点100℃时,水溶液的蒸气压一定小于101.3kPa,换句话说,在101.3kPa外界压力下,水溶液不能在100℃下沸腾。若要溶液的蒸气压等于外界压力而沸腾,必须将溶液加热到更高温度,因而溶液的沸点较纯溶剂为高。(2)溶液的沸点升高和凝固点下降10\n某物质的凝固点是它的固态蒸气压等于液态蒸气压时的温度。纯水冷到0℃结冰,这时,冰的蒸气压等于水的蒸气压。如果在水中加入难挥发的溶质,由于溶液的蒸气压下降,在0℃时,溶液的蒸气压小于冰的蒸气压,溶液和冰不能共存,溶液在0℃不能结冰。11\n从图中可以看出冰的蒸气压曲线较溶液的为陡,这表明在0℃以下时,冰和溶液的蒸气压虽然都随着温度的下降而减少,但冰的蒸气压的减小要比溶液蒸气压的减小要快,最终它们可以相交于一点。因此在0℃以下的某一温度,会出现冰的蒸气压和溶液的蒸气压相等,这个温度就是溶液的凝固点,它比纯水的凝固点要低。12\n溶液的沸点上升和凝固点下降的根本原因是溶液的蒸气压下降。而溶液蒸气压下降的程度与溶液的浓度成正比,因此溶液的沸点上升和凝固点下降也与溶液的浓度成正比。13\n拉乌尔用实验确定了下列关系溶液的沸点上升和凝固点下降与溶液的质量摩尔浓度成正比,而和溶质的本性无关。这也是拉乌尔定律。它的数学表达式为:沸点上升:△Tbp=KBbB凝固点下降:△Tfp=KfbB式中:bB是溶液的质量摩尔浓度。KB和Kf分别是沸点上升常数和凝固点下降常数。当K和△T已知时,利用溶液的沸点上升和凝固点下降与浓度关系式,就可以求得溶质的摩尔质量。14\n凝固点下降效应是抗冻剂的作用基础。最常用的抗冻剂是乙二醇。其沸点197℃,凝固点-17.4℃。等体积的乙二醇和水组成溶液,凝固点-36℃。采用乙二醇作抗冻剂是由于它具有高沸点、高化学稳定性,以及水从溶液结出时形成淤泥状而不是块状冰等优点。如果不加抗冻剂,水结冰时体积膨胀11%,产生的力(-22℃时2.068x105kPa)足以使散热泵、甚至金属发功机破裂。15\n在有机化合物合成中,常用测定沸点和熔点来检验化合物的纯度。含杂质的化合物可看作是一种溶液,化合物本身是溶剂,杂质是溶质,所以含杂质的物质的熔点比纯化合物低,沸点比纯化合物高(溶质不挥发)。16\n(3)渗透压像细胞膜、羊皮纸之类的半薄膜,能有选择地允许水或某些分子透过,而不允许其他分子透过,称为半透膜的选择性。由于半透膜的存在,使两种不同浓度溶液间产生水的扩散现象,叫做渗透现象。17\n实验发现,稀溶液中的水总是要向浓溶液中渗透。这是由于稀溶液水分子通过半透膜的速度大于水分于从浓溶液通过半透膜而进入稀溶液的速度,结果使浓溶液体积增大,液面上升。渗透作用达到平衡时,半透膜两边的静压力差称为渗透压。在一定温度下,溶液越浓,渗透压越大。浓溶液稀溶液渗透压半透膜水18\n1886年,范特霍夫发现非电解质稀溶液的渗透压可用与气体状态方程相似的方程式来计算,称范特霍夫方程式,即ΠV=nRT或Π=cRTΠ—溶液的渗透压;n—溶质的物质的量;V—溶液的体积;c—溶液的物质的量浓度。如果外加在溶液上的压力超过渗透压,反而会使浓溶液中的溶剂向稀溶液中扩散,这种现象叫做反渗透。反渗透为海水淡化、工业废水或污水处理和溶液浓缩等提供了重要的方法。19\n第3章溶液和胶体3.1溶液3.2均相离子平衡3.3酸碱的质子理论3.4沉淀—溶解平衡3.5胶体3.6表面活性剂20\n3.2.1弱电解质的解离平衡(1)一元弱酸、弱碱的解离平衡一元弱酸如HAc和一元弱碱如NH3·H2O,它们在水溶液中只是部分解离,绝大部分以未电离的分子存在。溶液中始终存在着未解离的弱电解质分子与解离产生的正、负离子之间的平衡。这种平衡称为解离平衡。如果用通式AB来表示一元弱酸或弱碱,则AB在溶液中存在下列解离平衡:ABA++B-21\n由于cӨ=1mol·L-1,一般不考虑K的单位时,可简写为c(A+)、c(B-)、c(AB)—A+、B-、AB—的平衡浓度,mol·L-1KABӨ—AB的解离常数。通常用KaӨ表示弱酸的解离常数,KbӨ表示弱碱的解离常数。根据解离常数的大小可以判断弱电解质的相对强弱。对于给定的电解质而言,解离常数与温度有关而与浓度无关。但一般来说温度的影响也不大,而且研究多为常温下的电离平衡。22\n设弱电解质AB的物质的量浓度为c(mol·L-1),电离度为α,则平衡时每种离子的浓度为cα,未电离的AB分子的浓度为c-cα。ABA++B-平衡浓度(mol·L-1)c-cαcαcα当α很小时,1-α≈1,则即溶液电离度与其浓度的平方根成反比。此关系是称为稀释定律。23\nα和KABӨ都可以表示酸、碱的强弱,但一定T下,α随c而变,而KABӨ不随c而变,是常数。对于一元弱酸,平衡时c(H+)=cαmol·L-1,则对于一元弱碱,平衡时c(OH-)=cαmol·L-1,则水是一种很弱的电解质H2OH++OH-KW=c(H+)c(OH-)=1.4×10-14,称为水的离子积常数。在稀溶液中,KW不随离子浓度变化而变化。24\n(2)多元弱电解质的分级电离分子中含有两个或两个以上可解离氢原子的酸,称为多元酸。氢硫酸(H2S)、H2CO3为二元弱酸,H3PO4为三元酸中的强酸,它们都属于多元酸。一元弱酸的解离平衡是一步完成的。而多元弱酸的解离分级进行,氢离子是依次电离出来的,其解离常数分别用Ka1Ө,Ka2Ө,……表示。25\n例如H2S电离:一级解离:H2SH++HS-二级解离:HS-H++S2-在一般情况下,二元弱酸的Ka1>>Ka2,表示第二步解离比第一步解离困难得多。因此,溶液中c(HS-)>>c(S2-),溶液的酸性主要由第一步解离所决定。因此,比较无机多元酸的酸性强弱时,只要比较一级解离常数即可;近似计算H+浓度时,可忽略二级解离。26\n例:计算298K时0.100mol·L-1H2S溶液中H+、HS-、S2-的浓度。解:设c(H+)=x,按一级解离:H2SH++HS-平衡浓度(mol·L-1)0.100-xxx因为Ka1很小,0.100-x≈0.100,x2=9.10×10-8x=c(H+)=c(HS-)=9.54×10-5mol·L-1严格地讲c(H+)略大于9.54×10-5mol·L-1,c(HS-)略小于9.54×10-5mol·L-1一级解离与二级解离同时存在于溶液中,c(H+)与c(HS-)只能有一个数值同时满足两个平衡。做近似计算时,第二级解离很小,c(H+)≈c(HS-)。c(S2-)=1.10×10-12mol·L-1由上式可知,在H2S溶液中c(S2-)在数值上约等于Ka2Ө。一般来说,任何单一的二元弱酸中两价负离子的浓度约等于Ka2Ө。27\n解离常数Ka1Ө与Ka2Ө的乘积:并不表示氢硫酸是按H2S2H++2S2-解离,只是表示平衡时H+、HS-、S2-浓度三者之间的关系。28\n例:在氢硫酸饱和溶液(0.100mol·L-1)中,加入足够的HCl,使该溶液的c(H+)=1mol·L-1。计算c(S2-)。解:上例中,c(S2-)=1.10×10-12mol·L-1。由于溶液中酸度变大,致使c(S2-)降低,约是原来的10-8倍。mol·L-129\n3.2.2配离子的离解平衡(1)配合物的基本概念由一定数量配位体(负离子或分子)通过配位键结合于中心离子(或中心原子)周围而形成复杂的、与原来组分性质不同的分子或离子。带正电荷的配离子称为配正离子,如:[Cu(NH3)4]2+;带负电荷的配离子称为配负离子,如[Fe(CN)6]4-。含有配离子的化合物称为配位化合物。30\n1)配合物的组成①中心离子(或中心原子)占据中心位置的正离子或原子叫做中心离子(或中心原子),也称为配合物的形成体。例如,[Cu(NH3)4]2+中,Cu2+是中心离子;[Ni(CO)4]2+中,Ni是中心原子。31\n②配体和配位原子配合物中与中心离子结合的中性分子或简单负离子,称为配位体(或配体)。在配位体中与中心离子直接结合的原子叫配位原子。例如,[Cu(NH3)4]2+中,NH3是配位体,而N原子直接与中心离子Cu相结合,是配位原子。32\n②配体和配位原子一个配位体中只有一个配位原子,称为单齿配位体。如一个配位体中含有两个以上配位原子,称为多齿配位体。如形成配合物时,多齿配体的配位原子可以同时与中心离子结合成键。33\n③配位数在配位体中与中心离子结合的配位原子总数称为中心离子的配位数。例如,[Cu(NH3)4]2+中,中心离子Cu2+的配位数是4。单齿配位体,配位体数目与中心离子或原子的配位数相同。如[Co(NH3)6]3+、[Cu(H2O)4]2+的中心离子的配位数分别为6、4。多齿配位体,配位体数目不等于中心离子的配位数。34\n④配离子的电荷配离子的电荷数等于组成它的中心离子与配体二者电荷数的代数和。例如,Cu2+与4个NH3分子配位生成[Cu(NH3)4]2+,该配离子的电荷为+2。35\n⑤配合物的内界和外界从配合物的整体来看,配合物的组成可划分为内界和外界两部分。内界为配合物的特征部分,由中心离子(或中心原子)与配体结合而成的一个相对稳定的整体,即配离子。在配合物的化学式中,用方括号表示。内界以外的其他离子称为外界或外配位层。其电荷数与配离子相等,符号相反。36\n37\n2)配合物的命名若配合物为配离子化合物,命名时阴离子在前,阳离子在后。若为配位阳离子化合物,则叫某化某或某酸某。若为配位阴离子化合物,则配位阴离子与外界阳离子之间用“酸”字连接。各配体命名的顺序按以下规则进行。①配离子中配体的名称放在中心原子名称之前,在配体中先列出阴离子,后列出中性分子的名称,无机配体列在前面,有机配体列在后面,不同配体名称间以中间的圆点“·”分开,在最后一个配体名称之后加“合”字,中心原子的氧化值用带括号的罗马数字表示。②同类配体的名称按配位原子元素符号的拉丁文字母顺序排列。③配体个数用倍数词头二、二、四等数字表示。38\n三氯化六氨合钴(Ⅲ)硫酸四氨合铜(Ⅱ)一氯化二氯·三氨·水合钴(Ⅲ)六氰合铁(Ⅲ)酸钾三氯·氨合铂(Ⅱ)酸钾二氯·二羟基合锌(Ⅱ)酸四羰基合镍三硝基·三氨合钴(Ⅲ)39\n[Co(NH3)6]Cl3[Cu(NH3)4]SO4[CoCl2(NH3)3(H2O)]ClK3[Fe(CN)6]K[PtCl3(NH3)]H2[Zn(OH)2Cl2][Ni(CO)4][Co(NH2)3(NH3)3]三氯化六氨合钴(Ⅲ)硫酸四氨合铜(Ⅱ)一氯化二氯·三氨·水合钴(Ⅲ)六氰合铁(Ⅲ)酸钾三氯·氨合铂(Ⅱ)酸钾二氯·二羟基合锌(Ⅱ)酸四羰基合镍三硝基·三氨合钴(Ⅲ)40\n(2)配离子的解离平衡配合物在水溶液中,内、外界间的解离与强电解质相同。[Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-解离出来的配离子在水溶液中有一小部分会再解离为它的组成离子和分子。[Cu(NH3)4]2+Cu2++4NH3这种解离如同弱电解质在水溶液中的情形一样,存在着解离平衡,即配位平衡。配离子的解离度是很小的。41\n1)配离子的稳定常数配位平衡与其他化学平衡—样,服从质量作用定律并且有其相应的平衡常数。[Cu(NH3)4]2+Cu2++4NH3对相同配位数的配离子来说,KӨ越大,解离越容易,即配离子越不稳定。这个平衡常数称为配离子的不稳定常数,以KӨ不稳表示。配离子的解离过程与多元酸类似,也是分步进行的,有其相应的逐级解离常数。42\n第一步[Cu(NH3)4]2+[Cu(NH3)3]2++NH3第二步[Cu(NH3)3]2+[Cu(NH3)2]2++NH3第三步[Cu(NH3)2]2+[Cu(NH3)]2++NH3第四步[Cu(NH3)]2+Cu2++NH3逐级解离常数的乘积等于该配离子的总的不稳定常数。43\n实际上在溶液中配离子的生成也是逐步进行的,相应的每一步的平衡常数,称为逐级稳定常数。Cu2++NH3[Cu(NH3)]2+KӨ稳1=1/KӨ不稳4[Cu(NH3)]2++NH3[Cu(NH3)2]2+KӨ稳2=1/KӨ不稳3[Cu(NH3)2]2++NH3[Cu(NH3)3]2+KӨ稳3=1/KӨ不稳2[Cu(NH3)3]2++NH3[Cu(NH3)4]2+KӨ稳4=1/KӨ不稳4逐级稳定常数的乘积等于该配离子的总的稳定常数KӨ稳=KӨ稳1KӨ稳2KӨ稳3KӨ稳4=1/KӨ不稳=2.5×101344\n2)配位平衡的移动①与酸碱平衡的关系—配合物的酸效应在[Cu(NH3)4]2+配离子系统中加入酸后,由于NH3与H+生成更稳定的NH4+配离子,溶液中NH3浓度减小,平衡向[Cu(NH3)4]2+解离方向移动。[Cu(NH3)4]2+Cu2++4NH3+4H+4NH4+离子方程式:[Cu(NH3)4]2++4H+Cu2++4NH4+深蓝浅蓝45\n②与多相离子平衡的关系—金属离子的水解效应向氯化银沉淀的溶液中加入氨水,沉淀即溶解而转变为[Ag(NH3)2]+配离子;再加入溴化钠溶液时,又有淡黄色的溴化银沉淀生成。AgClAg++Cl-2NH3·H2O2NH3+2H2O[Ag(NH3)2]+Ag++2NH3NaBr→Br-+Na+AgBr↓(淡黄色)当配位剂争夺金属离子的能力大于沉淀剂争夺金属离子的能力时,沉淀平衡转化为配位平衡;反之则配位平衡转化为沉淀平衡。46\n③与氧化还原平衡的关系金属离子形成配离子后,可使溶液中金属离子的浓度降低,因而改变其氧化还原稳定性。例如Pb4+很不稳定,这表现在PbO2与浓盐酸反应后产物不是PbCl4而是PbCl2,但形[PbCl6]2-配离子后,Pb就能保持氧化值为+4。47\n③与氧化还原平衡的关系配位反应还能改变氧化还原反应的方向。例如.Fe3+可以氧化I-:2Fe3++2I-2Fe2++I2如果在溶液中加入F-,由于形成[FeF6]3-配离子,溶液中Fe3+的浓度降低,导致电对Fe3+/Fe2+的电极电势降低,使反应方向发生改变,平衡左移。2Fe3++2I-2Fe2++I2+12F-2[FeF6]3-48\n④配合物之间的转化在一种配位剂能同时与两种金属离子生成配离子的场合,就会发生相互干扰。这主要取决于配合物稳定性的差异,即平衡向生成更难解离的配离子方向移动。49\n例如,在Co2+溶液中,若含有少量的Fe3+,当加入NH4SCN鉴定Co2+时,就会同时发生下列两个反应:Co2++4SCN[Co(SCN)4]2-(蓝紫)Fe3++SCN[Fe(SCN)]2+(血红)血红色的[Fe(SCN)]3-干扰了对Co2+的鉴定。为了消除这种干扰现象,可以加入NH4F,与F-生成更稳定的[FeF6]3-,这种起掩蔽作用的试剂(如NH4F)称为掩蔽剂。[Fe(SCN)]2++F-[FeF6]3-50\n3.2.3共同离子效应与缓冲溶液(1)共同离子效应在弱电解质溶液中,加入与弱电解质具有相同离子的强电解质时,可使弱电解质的解离度降低,这种现象叫做共同离子效应。51\n在氨水中加一些NH4Ac,NH4Ac→NH4++Ac-NH3H2ONH4++OH-由于NH4Ac是强电解质因而完全解离,使溶液中NH4+浓度大大增加,氨水解离平衡向左移动,从而降低了氨水的解离度。如果在HAc溶液中加入NH4Ac时,NH4Ac→NH4++Ac-HAcH++Ac-Ac-浓度大大增加,使HAc解离平衡向左移动,解离度降低。同离子效应可以控制弱酸或弱碱溶液中的H+和OH-浓度,所以经常利用同离子效应来调节溶液的酸碱性。52\n解:(1)两种溶液等体积混合后浓度各减小一半,均为0.200mol·L-1,设已解离的NH3的浓度为x,则开始浓度(mol·L-1)0.2000.2000平衡浓度(mol·L-1)0.200-x0.200+xxNH3·H2ONH4++OH-因Kb值很小,0.200±x≈0.200,所以x=c(OH-)=1.79×10-5mol·L-1pH=14-pOH=14+lg[c(OH-)]=9.30(2)由于溶液中氨的浓度为0.200mol·L-1,所以氨的电离度为α=x/c=1.79×10-5/0.200=8.95×10-5≈9.00×10-5=0.009%由于共同离子效应,氨水的电离度从0.95%降低到0.009%,pH值由11.3降低到9.30。pH=14-pOH=14+lg[c(OH-)]=11.353\n(2)缓冲溶液溶液的pH值是影响化学反应的重要条件之一。定义:能够抵抗外来少量酸、碱、水的影响而保持溶液的相对稳定的溶液,称为缓冲溶液。定义:缓冲溶液稳定溶液pH的作用称为缓冲作用。定义:一种溶液要具有缓冲作用,一般必须要有两种物质,这一对物质称为缓冲对。弱酸及其盐(如HAc与NaAc),弱碱及其盐(如NH3与NH4Cl),以及多元弱酸的两种不同的盐(如NaH2PO4与Na2HPO4)均可组成缓冲对,起到缓冲作用。54\n以弱酸及其盐组成缓冲溶液为例,存在弱酸的解离平衡:HAH++A-由于共同离子效应,弱酸的解离更弱,因此平衡时c(HA)≈原始弱酸浓度,令为c酸;溶液中c(A-)≈原始盐浓度,令为c盐,则55\n对于弱碱及其盐组成的缓冲溶液,存在着下列电离平衡由于共同离子效应,BOH的解离度很小,因此平衡时c(BOH)≈原始碱浓度,令为c碱;溶液中c(B+)≈原始盐浓度,令为c盐56\n弱酸及其盐组成缓冲溶液弱碱及其盐组成的缓冲溶液可见,一个缓冲溶液的pH,由pKa(或pKb)和c盐/c酸(或c盐/c碱)两项决定。当缓冲溶液的缓冲对确定后,pKa(或pKb)的值也就确定,故缓冲溶液的pH变化完全由c盐/c酸(或c盐/c碱)项决定。当加入酸、碱时,由于平衡的移动,导致c盐、c酸(或c盐、c碱)浓度的变化,但由于原来溶液中缓冲对的含量较大,少量外来的酸、碱不会导致c盐/c酸(或c盐/c碱)大幅度变化,因此pH值能保持稳定。57\n若在缓冲溶液中加入的酸、碱量过大,缓冲溶液也会丧失作用。缓冲溶液的缓冲对的浓度越大,缓冲能力越强。58\n几种常见的缓冲对类型缓冲对pKa或pKb弱酸-弱酸盐HAC-NaAc4.75H2CO3-NaHCO36.37H3PO4-NaH2PO42.12HCOOH-HCOONa3.75多元酸的酸式盐-次级盐NaH2PO4-Na2HPO47.21NaHCO3-Na2CO310.25弱碱-弱碱盐NH3H2O-NH4Cl4.7459\n缓冲溶液的选择与配制选择时注意事项:a.所选缓冲对与反应物、产物之间不发生反应;b.所选缓冲对的pKa或pKb要与所要求的pH值接近;c.选择缓冲对中各组分浓度较大的缓冲对60\n配制:a.对给定浓度的缓冲对,按各自所需体积混合即可;b.在一定量的弱酸、弱碱中加入强酸、强碱配成缓冲溶液;c.在一定量的弱酸、弱碱中加入相应的盐构成缓冲溶液61\n例:在100ml的0.100mol·L-1HAc和0.100mol·L-1的NaAc缓冲溶液中,加入1.0mL的1.0mol·L-1HCl,求加入HCl前后的pH值。62\n可见,加入少量的HCl后,pH值变化不大,只有4.75-4.66=0.0963\nP105:思考题1-10作业:P106:习题4,5,6,764\nTheENDThanksforlisteningAnyquestions…65查看更多