- 2022-08-12 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
细胞生物学杂志
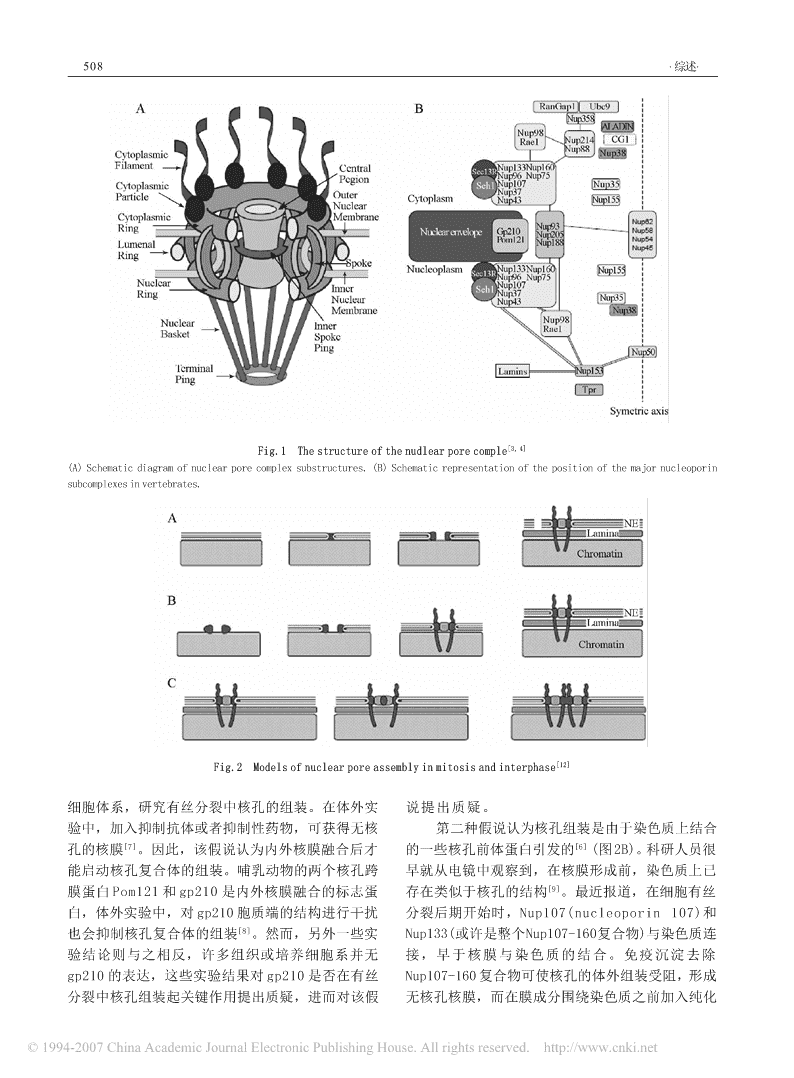
细胞生物学杂志ChineseJournalofCellBiology2006,28:507-512http://www.cjcb.org核孔复合体的动态组装管 慧 张艳萍 宋 晶 朱宝长*(首都师范大学生命科学学院,北京100037)摘要 核孔是介导所有大分子入核出核的唯一通道。在整个生命活动中,核孔复合体的组成蛋白总是处于动态变化中。核孔复合体的动态组装改变了核质转运状态,并最终改变了细胞的功能。关键词 核孔复合体;核孔蛋白;动态组装;核质转运所有真核细胞的核膜都具有核孔,核孔是多种环及转运复合体从核孔释放或调节小G蛋白Ran的蛋白质组成的复合体。核孔复合体组成一个有功能功能等。核孔蛋白的运动规律目前还不是非常清的孔道,是所有核质转运物的唯一通道。在结构楚。核孔复合体的组装和动态变化的研究是揭示核上,核孔复合体主要由胞质环(cytoplasmicring)、质转运机制的关键点之一,同时这方面的研究也是核质环(nuclearring)、辐(spoke)等结构组成[1]。胞目前国际研究热点之一。核孔复合体通过重组装来质环、核质环都呈八蛋白中心对称结构,从胞质环调节核质转运,从而赋予细胞新的功能来应对不同上发出纤维伸向胞质,核质环上也有纤维发出,并生理变化,本文对核孔动态组装方面进行综述。在核质远端构成一个小环,形成吊篮结构。八条辐位于核质环和胞质环之间的核膜内,也呈中央对称1核孔复合体的动态组装假说(图1A)。哺乳动物核孔复合体含有约30多种核孔蛋在细胞新陈代谢中,新的核孔需要组装到核膜白(nucleoporin,nup),其中有些蛋白质具有多个上应对细胞分裂或其他生理变化。在哺乳动物和酵拷贝形成100多个蛋白组成的大分子复合体,分子母细胞的细胞周期中,核孔数量在G1期到G2期增量约125mDa[1,2]。在脊椎动物中,只有两个核孔[5]加,为细胞分裂做准备。同样,卵母细胞在核蛋白Pom121和gp210是跨膜蛋白,具有将核孔锚膜和胞质中积聚数百万的核孔复合体,为早期快速定在核膜上的作用[3]。其他核孔蛋白均为可溶性蛋胚胎发育提供物质储备。白,且多数在胞质和核质中对称分布[2]。还有一些高等真核生物在有丝分裂中经历了核膜、核孔极少数的核孔蛋白仅在一面分布或倾向于一面分的解聚和重组装过程[6],即大量核孔需要在分裂末布,它们可能是胞质和核质的纤维组分。有些核孔期同时重新组装在一起。间期细胞和分裂期细胞的蛋白紧密联接在一起,形成核孔亚复合体,它们是核孔组装是否具有相同的机制目前还不清楚,这两核孔组装的组件(图1B)。此外大多数核孔蛋白具有种核孔组装发生在完全不同的细胞时期。有丝分裂FG(Phe-Gly)多态重复片段,是核质转运中转运受后核孔复合体的组装发生在M期细胞的胞质中,早体(如importinb)的停泊位点。于或至少与核膜同步形成;分裂间期核孔复合体的核孔是高效繁忙的交通孔道,每个核孔每秒钟组装在间期细胞质内完成,此时细胞已具有完整的有几百次转运事件发生,同时物质进出核孔是被高双层核膜结构。度精确调控的。现在人们还不完全清楚核孔怎样介第一种核孔复合体组装假说认为局部内外核膜导大型分子流的进出。目前存在两种不同的观点,的预先融合引发了核孔组装(图2A)。研究人员用非一种认为,核孔复合体静止不动,在核质转运中,洲爪蟾卵(Xenopusegg)提取物和精细胞染色体组成无只为转运受体提供停泊位点。而另一种观点则认为,许多核孔蛋白是动态变化的,甚至在胞质与核收稿日期:2005-11-23 接受日期:2006-03-13质中快速穿梭。这些动态变化的核孔蛋白可能参与国家自然科学基金资助项目(No.30270197,No.39970553)核质转运过程的许多重要事件,如定位、转运、循*通讯作者。Tel:010-68903623,E-mail:baochang@mail.cnu.edu.cn\n508·综述·Fig.1Thestructureofthenudlearporecomple[3,4](A)Schematicdiagramofnuclearporecomplexsubstructures.(B)Schematicrepresentationofthepositionofthemajornucleoporinsubcomplexesinvertebrates.Fig.2Modelsofnuclearporeassemblyinmitosisandinterphase[12]细胞体系,研究有丝分裂中核孔的组装。在体外实说提出质疑。验中,加入抑制抗体或者抑制性药物,可获得无核第二种假说认为核孔组装是由于染色质上结合孔的核膜[7]。因此,该假说认为内外核膜融合后才的一些核孔前体蛋白引发的[6](图2B)。科研人员很能启动核孔复合体的组装。哺乳动物的两个核孔跨早就从电镜中观察到,在核膜形成前,染色质上已膜蛋白Pom121和gp210是内外核膜融合的标志蛋存在类似于核孔的结构[9]。最近报道,在细胞有丝白,体外实验中,对gp210胞质端的结构进行干扰分裂后期开始时,Nup107(nucleoporin107)和也会抑制核孔复合体的组装[8]。然而,另外一些实Nup133(或许是整个Nup107-160复合物)与染色质连验结论则与之相反,许多组织或培养细胞系并无接,早于核膜与染色质的结合。免疫沉淀去除gp210的表达,这些实验结果对gp210是否在有丝Nup107-160复合物可使核孔的体外组装受阻,形成分裂中核孔组装起关键作用提出质疑,进而对该假无核孔核膜,而在膜成分围绕染色质之前加入纯化\n管 慧等:核孔复合体的动态组装509的Nup107-160复合物,核孔能恢复组装[10]。这表在有丝分裂核膜解聚时它们才能相互接触作用,这明Nup107-160复合物是核孔组装前体,它必须先种作用导致有丝分裂下游事件依次启动。典型的例与染色质结合然后才能引发后续的核孔组装。子如核膜解聚时,cdc2/cyclinB进入核内[16],而核Nup155也是核孔复合体组装所必须的前体蛋白[11]。内微管调节蛋白(如TPX2,NuMA和NuSAP)却进入也许还有其他核孔蛋白参与核孔前体的组装,这些胞质[17]。除有丝分裂核膜解聚外,通过蛋白质磷酸蛋白质按照一定顺序依次整合,形成有功能的核化和蛋白质降解也可实现关键蛋白质的重定位,如孔。对某些蛋白质核定位信号(nuclearlocalizationsequences,第三种核孔组装的假说是针对已经有完整核膜NLS)的磷酸化作用等。的间期细胞提出的,认为已存在的核孔做模板,复最近的研究表明,在某种真菌中,通过有丝制生成新核孔,然后按一种“分裂机制”进行分分裂末期核孔复合体变构,核膜通透性发生变化,离,形成两个核孔[12](图2C)。也导致有丝分裂的重要调节分子入核[18]。如在一种前两种引发核孔组装、膜融合、核孔前体形曲霉菌中,有丝分裂激酶NIMA可能具有调节核孔复成的假说也同样适用于间期细胞。除了核孔蛋白在合体组成的功能,它通过对Gle2/Rae1和Nup98的核孔组装中的重要作用外,大量研究表明importinb磷酸化而改变核孔结构[19]。核孔复合体的这种重和RanGTP也直接参与调控核孔复合体组装的启组,是cdc2/cyclinB复合体入核所必须的。重组作动[13]。RanGTP可以将importinb从Nup107和用不仅影响少数几个特异分子,以及可溶性微管蛋Nup153中释放出来,并且诱导这些核孔蛋白形成白的入核,而且也导致核膜通透性整体上升。在其复合体,进而这些复合体启动核孔的组装。有丝分他真菌中,也观察到分裂前期,GFP标记物入核的裂末期,一旦核孔复合体启动组装,其他核孔蛋白现象。就会相继结合,但Tpr和gp210是例外,这两个蛋白综上所述,在有丝分裂末期,核孔复合体的质只有在核孔转运活动开始后才会组装到核孔上[13],核心骨架(corescaffold)还没有改变,核膜在细胞提示这两个蛋白质对转运活动起重要作用。此外,分裂过程中保持了完整性,但核孔复合体的外围结核孔复合体的组装具有空间特异性,由于小G蛋白构(peripheralstructure)发生了变化,核孔通透性改Ran聚集在核内,因此过低浓度的RanGTP或过高变,造成胞质、核质的分子融合,这对于调节细浓度的importinb会抑制核孔组装,相反,过高浓胞周期进程具有重要作用。度的RanGTP或过低浓度的importinb将导致胞质2.2有丝分裂前期核孔复合体的去组装中核孔复合体组装的异常现象[14]。一些多细胞生物(metazoanorganisms)有丝分裂最近,来自生物信息学方面的分析发现,核前期,核膜先解聚,随后整个核孔复合体包括核心孔复合体在进化上与囊泡外被(vesiclecoat)同源。酵核孔蛋白依次解聚。而在果蝇胚胎中则相反,观察母Nup84复合物(哺乳动物Nup107-160复合物的同到核孔先解聚,核膜后解聚。对海星卵细胞的研究源物)与囊泡外被某些成分在蛋白质高级结构上高度表明,部分核孔复合体的去组装诱导核膜解聚[20]。同源,这些结构与膜的弯曲有关,在囊泡出芽在早前期,外周核孔蛋白如Nup98、Nup153和(vesiclebudding)和核孔内外核膜融合过程中起重要作Nup214陆续从核孔复合体上释放,然而核孔骨架用[15]。今后来自进化方面的研究也将为核孔组装的蛋白如Pom121仍然稳定的连接于核膜上。相似的发生提供有力证据。机制也在哺乳动物体细胞中发现了。在海星和果蝇的研究中,虽然核孔复合体已渐渐的失去了其外周2细胞周期中核孔复合体的动态变化结构,但核孔的框架仍然完整,可见环状结构镶嵌2.1有丝分裂末期核孔复合体的重组装于核膜上。同时,带有NLS的报告分子从核中释在分裂细胞中,当新的核孔合成受阻时,核放出来,被动扩散的通透性也大大增加。在曲霉孔数量就会随着细胞的多次连续分裂而减少[16],这中,此时cdc2/cyclinB也进入核内。这里有丝分裂表明新的细胞需要一定数量的核孔组装。在间期,的开始阶段和结束阶段变得非常相似,这表明在细与有丝分裂相关的关键蛋白质被完整的细胞核膜分胞分裂的早期核孔复合体已开始解聚。离,这些蛋白质分别位于细胞质和细胞核中,只有有丝分裂过程中的核孔解聚被认为主要由磷酸\n510·综述·化作用引起。多种核孔蛋白在有丝分裂过程中被磷在核孔复合体上的滞留时间,将核孔蛋白分为三酸化[21]。在体外,cdc2可使某些核孔蛋白磷酸化,组。即滞留时间大于35h的核孔骨架蛋白(scaffold),曲霉菌的有丝分裂激酶NIMA在哺乳动物细胞和非如Pom121、Nup107-160复合物的组成蛋白等;2.5~洲爪蟾卵母细胞中的表达可导致核膜解聚[22]。体外30h的连接蛋白(adaptor),如Nup62等,这些蛋白实验中,磷酸化作用可使核孔转运状态改变,但在质可能作为接头将其他核孔蛋白与骨架相连;以及体状态目前还不知道。在脊椎动物NIMA的同源物小于2.5h,甚至只有几秒钟的动态核孔蛋白(dy-中还没发现类似现象。namic),如Nup153、Nup50等[28]。这些核孔蛋白在哺乳动物体细胞中,带有核孔复合体和核纤的运动与核质转运的关系目前还不清楚,但人们已层的核膜残片,在微管的作用下,从染色体快速移提出很多假设,包括定位、转运、再循环、从核动到中心体附近[23],在此过程中,核孔复合体持续孔复合体上释放转运复合体[29],以及小G蛋白Ran解聚。在分裂中期,gp210和Pom121分布在内质的调节等。最近对核孔微细结构的研究中也发现核网上,另外一些核孔蛋白重新定位于着丝粒,其他孔处于高度动态变化中,科研人员用冷冻电子X射核孔蛋白则均散落在细胞质中。线断层摄影技术(cryoelectrontomography)对核孔进对于核孔蛋白怎样从核膜上解聚现在还知之甚行观察后提出,由于核孔转运活动如此频繁,过去少。通过活细胞成像并配合电镜技术,人们有望直认为的中央栓(centralplug)也许只是转运过程中的转接观察到单个核孔复合体解聚的细节。运复合体,而并非核孔永久结构,而且在转运复合体通过核孔的整个过程中,核孔结构也不断变化[30]。3不同生理状态下核孔复合体的动态变化这些实验提示,核孔复合体处在高度动态变化中,3.1不同生理状态下核孔的数量变化而不仅仅是被动的通道。核孔复合体可以通过组装和去组装改变核孔数3.3不同生理状态下核孔蛋白的结构变化量,来应对不同生理需要。高等真核生物核孔在核核孔复合体可以通过内部分子重组来调整转运膜上是完全固定的,这也许和核纤层的相互作用有状态。目前还不清楚这种调控只限于单个核孔,还关。核孔一旦组装好,就形成看上去在整个间期都是整个细胞核的所有核孔都发生了改变。一般认非常稳定的结构。但在没有经历有丝分裂或细胞凋为,大多数的核孔复合体同时具有输入与输出能力[31],亡时,核孔数量也会根据生理变化增减。例如在我但最近在酵母中的研究发现,靠近核仁的核孔可能们以往的研究中发现,哺乳动物睾丸支持细胞核孔不能输出mRNA[32]。由此可见,不同细胞的核孔类的数量和分布与曲细精管上皮周期的活动有密切关型可能不同,单个细胞核的核孔类型也可能不系[24,25]。该细胞的核孔数量还受到赖氏细胞的雄激同。素或细胞因子的影响[26],即核孔复合体在这些生理此外,核孔的通透性是可调控的,细胞可以变化过程中发生了组装和去组装的活动。通过调整核孔复合体的分子结构来满足不同核质转3.2不同生理状态下核孔蛋白的数量变化运的需要。分裂细胞和静止细胞核孔的通透性不不同的核孔蛋白对入核(出核)蛋白的亲和力不同。在出芽酵母整个细胞周期中,核膜不裂解,核同,生物体通过更换核孔组分来调控转运效率。目孔复合体结构完整,大多数的核孔复合体和入核分前已发现有组织特异表达的核孔蛋白,如NupBS-子也没有位置变化,但在核孔上发生了更为精细的63(RanBP2/Nup358的剪切异构体)是人精细胞和精子调整。在有丝分裂中,Nup153p通过变构改变其结中特异表达的核孔蛋白。又如睾丸中Npap60的表合对象,使依赖Kap121p的入核通路受到抑制,同达量是其他组织的10倍[27]。时Nup153p的变构也启动了有丝分裂下游事件,如组成核孔复合体的30多种核孔蛋白功能不同,Mad2p从核孔复合体上释放,并与着丝粒结合等[18]。它们处在不同程度的动态变化中。最近研究人员得在细胞凋亡的研究中也发现,凋亡过程中核孔功能到19种分别在哺乳动物细胞中正确表达的GFP-Nup受损,但电镜下核孔的形态结构始终完整。这主要融合蛋白,利用光漂白后逆向荧光恢复技术(inverse是由于caspase只降解少数核心核孔蛋白中某些肽段fluorescencerecoveryafterphotobleaching,iFRAP)对(如Nup93和Nup96N端的部分多肽),它们的降解这些活细胞中的核孔蛋白进行动态监测,根据它们引起广泛的核质转运通路受阻和核孔通透性改变,\n管 慧等:核孔复合体的动态组装511但并未导致核孔整体结构的瓦解[33]。最后,一些病可以利用扫描电镜观察转运过程中的蛋白质结构,毒可以改变核孔复合体的组成,进而破坏正常细胞但是核孔的组装速度和动态变化太快,这些大分子RNA和蛋白质的转运[34]。例如,脊髓灰质炎病毒是按什么顺序精确组装的,分裂期和间期细胞的核和鼻病毒感染过程中降解Nup153和Nup62,导致孔组装是否具有相同机制,不同生理状态下,核孔核蛋白不能入核[35]。这些例子说明,核孔内部分子组成和结构是怎样变化的等许多问题目前还不清的精细调控可以改变其通透性和转运状态,最终改楚。这些关键问题的解决有待于今后活细胞显微成变整个细胞的生理状况。像技术和亚细胞水平的蛋白质定量技术的进一步发值得注意的是,即使同一蛋白质,在不同生展。理状态下也会发生变化,活跃的扮演着各种角色,如Nup153即是核质转运中的关键分子,也是有丝参考文献(References)分裂中核孔组装的前体,还是细胞凋亡中蛋白酶和[1]CronshawJMetal.JCellBiol,2002,158:915[2]RoutMPetal.JCellBiol,2000,148:635某些病毒的作用位点[36]。[3]SuntharalingamMetal.DevCell,2003,4:775[4]BaptesteEetal.GenomeBiol,2005,6:R854小结与展望[5]WineyMetal.MolBiolCell,1997,8:2119[6]BurkeBetal.NatRevMolCellBiol,2002,3:487最近出现了核孔复合体动态组装的新观点。[7]MacaulayCetal.JCellBiol,1996,132:5核孔骨架蛋白及组装所必须的某些核孔蛋白相当稳[8]DrummondSPetal.JCellBiol,2002,158:53[9]MaulGG.JCellBiol,1977,74:492定,而其他核孔蛋白则与核孔复合体动态结合。我[10]WaltherTCetal.Cell,2003,113:195们推测,这些与核孔结合的蛋白质受到某种调控,[11]FranzCetal.EMBOJ,2005,24:3519从而改变核孔复合体的组成和转运状态,使不同生[12]RabutGetal.CurrOpinCellBiol,2004,16:314理状态下细胞核与细胞质中的蛋白质分布发生改[13]BodoorKetal.JCellSci,1999,112:2253[14]WaltherTCetal.Nature,2003,424:689变,最终导致整个细胞生理状态改变。[15]AntoninWetal.NatCellBiol,2005,7:10核孔复合体动态变化的研究为核质转运的研究[16]TakizawaCGetal.CurrOpinCellBiol,2000,12:658指出了新的方向。过去10年中,核质转运方面的[17]HetzerMetal.NatCellBiol,2002,4:E177[18]MakhnevychTetal.Cell,2003,115:813工作进展迅速,但许多核质转运的模型是建立在带[19]DeSouzaCPetal.Genetics,2003,165:1071有NLS及核输出信号序列(nuclearexportsequences,[20]LenartPetal.JCellBiol,2003,160:1055NES)的分子与转运受体识别、并与核孔蛋白FG重[21]MillerMWetal.ArchBiochemBiophys,1999,367:51[22]LuKPetal.Cell,1995,81:413复序列相互作用这一基础上的,在转运受体与入核[23]BeaudouinJetal.Cell,2002,108:83(出核)分子相互作用中,Ran是关键的调节分子[37]。[24]CavicchiaJCetal.TissueCell,1998,30:268以前认为核质转运的调控主要发生在入核分子和出核[25]ZhuBetal.TissueCell,1998,30:485[26]OrtizHEetal.AnatRec,1990,226:129分子的修饰上,但最新的研究发现一种新的机制,[27]PoonIKetal.Traffic,2005,6:173即通过核孔复合体的分子重组来调控核质转运[18],[28]RabutGetal.NatCellBiol,2004,6:1114也许这是更为高效的核质转运调控方式,这方面的[29]LindsayMEetal.Cell,2002,110:349[30]BeckMetal.Science,2004,306:1387工作将是今后核质转运研究领域的一个热点。[31]NewmeyerDDetal.Cell,1988,52:641目前无论在细胞分化、不同生理状态,还是[32]GalyVetal.Cell,2004,116:63在病毒感染、细胞不同周期,或是在单个细胞的某[33]PatreMetal.JBiolChem,2006,281:1296[34]GustinKE.VirusRes,2003,95:35一特异细胞核膜的表面,人们发现的核孔调控现象[35]GustinKEetal.EMBOJ,2001,20:240还不多,不足以获得规律性的结论,因此不能肯定[36]BallJRetal.Chromosoma,2005,114:319这些现象是特例,还是生命的共同特征。虽然人们[37]WeisK.Cell,2003,112:441\n512·综述·DynamicsofNuclearPoreComplexOrganizationHuiGuan,Yan-PingZhang,JingSong,Bao-ChangZhu*(CollegeofLifeScience,CapitalNormalUniversity,Beijing100037,China)AbstractNuclearporesareonlygatesforallmacromoleculesthattrafficbetweenthenucleusandthecytoplasm.Thenuclearporecomplexesconsistofvariedproteinsthatalwaysareindynamicassemblyduringthewholelifeofthecells.Presentarticleelucidatedynamicsofnuclearporecomplexesorganizationsthatalterproper-tiesofnuclearporesintransportationand,ultimately,thecellularfunctions.Keywordsnuclearporecomplexes;nucleoporin;dynamicorganization;nucleartransportReceived:November23,2005Accepted:March13,2006ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(No.30270197,No.39970553)*Correspondingauthor.Tel:86-10-68903623,E-mail:baochang@mail.cnu.edu.cn~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~第五届亚太地区细胞生物学代表大会将于2006年10在北京举行我们热诚欢迎细胞生物学及相关领域的同行和朋友们前来参加2006年10月28~30日在北京国际会议中心召开的第五届亚太地区细胞生物学代表大会。大会主要议题包括:细胞运动与细胞骨架,细胞膜结构与功能,基因调控,细胞增殖与细胞周期,细胞分化衰老与凋亡,肿瘤细胞生物学,细胞蛋白质组学与系统生物学,新技术(细胞影像及活细胞技术),细胞信号转导,干细胞及细胞(组织)工程,免疫细胞生物学。此次大会将有来自亚太地区16个国家与地区以及其他国家与地区的代表约1000人参加。会议将为您提供一次难得的机会来听取多位杰出科学家的精彩报告,报告人包括诺贝尔奖获得者、美国科学院院士、英国、瑞士、日本、新加坡等国家的专家学者。欢迎大家踊跃提交摘要,被接受的摘要将被刊入会议文集(SCI收录),提交截止日期8月5日。正在准备中而到截止日期过后才能提交摘要的与会者,请在截止日期前与大会联系说明。摘要格式可以下载样本。下载地址:http://www.apocb2006.org.cn/download.htm联系人:北京师范大学细胞生物学研究所从羽生教授Tel:010-58809729;Fax:010-58805042;E-mail:yscong@apocb2006.org.cn;http://www.apocb2006.org.cn/cn会议日程10月27日,星期五晚上6点~9点就业与招聘洽谈会注册上午9点~晚上7点晚上6点~9点细胞生物学教育与课程交流会招待会晚上6点~晚上9点10月29日,星期日10月28日,星期六上午9点~12点学术报告上午8点~晚上7点注册下午2点~5点30分学术报告上午8点30分~9点开幕式晚上6点~7点30分仪器公司技术讲座上午9点~12点大会报告晚上7点30分~9点晚宴中午12点~1点30分APOCB理事会10月30日,星期一下午2点~5点30分学术报告上午8点30分~11点大会报告晚上6点~9点仪器公司技术讲座上午11点~12点闭幕式查看更多