- 2022-08-12 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
专题介绍-中国细胞生物学学报(原名细胞生物学杂
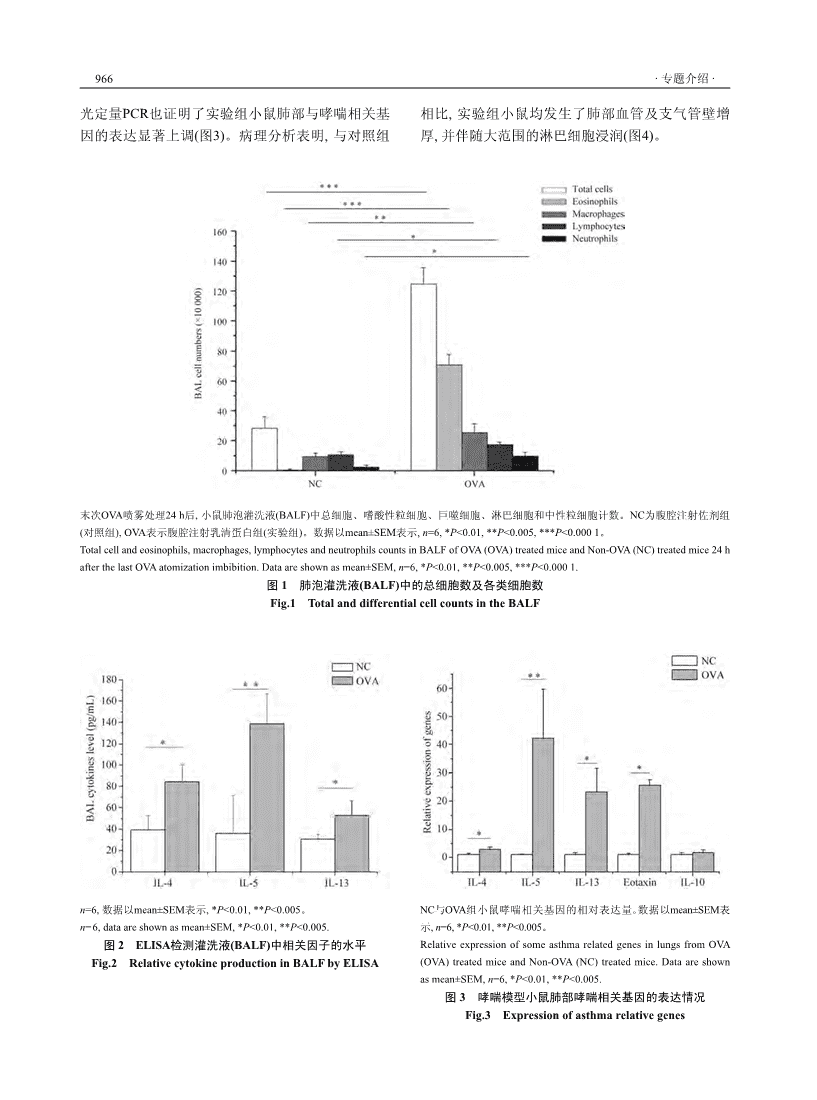
中国细胞生物学学报ChineseJournalofCellBiology2011,33(9):964–968http://www.cjcb.org专题介绍小鼠动物实验方法系列专题(六)小鼠是生命科学研究和医学研究的重要模式生物。随着小鼠基因组测序计划的完成,国际上明显加速了在这方面研究的投入和部署。从2005年起,美国、欧盟、加拿大等批准了一系列重大科学计划,开展基因工程小鼠的大规模研制,这些项目包括美国国立卫生院的小鼠基因剔除计划(KOMP,http://www.nih.gov/sci-ence/models/mouse/knockout)、欧盟第七框架的欧洲小鼠条件性剔除计划(EuCOMM,http://www.eucomm.org)和加拿大的北美小鼠条件性剔除计划(NorCOMM,http://norcomm.phenogenomics.ca/index.htm)等。中国也在2006年由科技部立项、上海南方模式生物研究中心牵头启动了中国的小鼠条件性基因敲除计划,该计划支持了国内几十个高校和研究所150种条件性基因敲除小鼠模型的建立。随着这些研究计划的快速进展,大量基因工程小鼠模型成为科学界的共同资源,这将对功能基因组和人类疾病治疗的机制以及新药的研发产生重大而深远的影响。为帮助读者能更好地利用这些小鼠资源开展研究,我们以专栏形式陆续刊登介绍小鼠动物实验技术的文章,也欢迎读者能够踊跃投稿,把自己手头正在做的小鼠动物实验技术方法和心得体会介绍给大家,一起来分享实验过程中的得失和快乐。卵清蛋白诱导129Sv小鼠建立哮喘模型的方法林志荣1 王维刚1 严惠敏2 吴友兵2 任建科2*12(同济大学生命科学与技术学院,上海200092;上海南方模式生物研究中心,上海201210)摘要近年来,哮喘发病率有逐年增长的趋势,因此利用动物模型研究哮喘发生的分子生物学机制及治疗方案具有重要的意义。利用卵清蛋白(ovalbumin,OVA)致敏诱导动物发生哮喘是比较成熟的方法。常用的实验动物有小鼠、大鼠、豚鼠、家兔等。该文主要介绍一种可以有效致敏129Sv品系小鼠、建立哮喘疾病模型的技术路线,并对模型指标进行了具体的描述,供从事相关研究的人员参考。关键词哮喘;卵清蛋白;雾化吸入;129Sv哮喘属于Ⅰ型超敏反应,也称为速发型超敏反在哮喘的发病机制中,Thl和Th2淋巴细胞亚群应,是由多种炎性细胞如嗜酸性粒细胞、肥大细数目功能失衡,以及Thl/Th2比例失调起到了重要[1-2][7]胞、T淋巴细胞、中性粒细胞、气道上皮细胞等作用。Th2分泌的细胞因子(IL-4、IL-5、IL-10、[3-4]和Th2细胞因子(IL-4、IL-5、IL-10、IL-13)参与IL-13)对哮喘具有促进作用,Th1分泌的细胞因子[5,8-13]的气道慢性炎症疾病。引起哮喘的抗原也称变应(IFN-γ、IL-12)对哮喘的发生有抑制作用。原。已确认的变应原有相似的物理特性,如易溶于迄今,研究人员对于动物哮喘模型建立及运用[14]水、分子量在10~40kDa之间,但它们的生物学性质已有100多年,其中运用腹腔注射卵清蛋白(oval-不同,主要包括植物花粉、真菌孢子、菌丝和螨虫bumin,OVA)预致敏,随后进行喷雾吸入OVA,已成[15]等。哮喘作为一种慢性气道炎症,反复发作使气道为建立小鼠哮喘模型应用最为广泛的方法。本文壁结构发生变化,包括气道平滑肌增厚、细胞外基质沉积、基底膜增厚、炎症细胞浸润和腺体增生肥收稿日期:2011-05-16接受日期:2011-07-05国家863计划(No.2008AA02Z126)和上海市科委(No.10140901400)大,导致持续非特异性的支气管高反应性(bronchial资助项目[5-6]hyperresponsiveness,BHR)。*通讯作者。Tel:021-50793648-82022,E-mail:renjk98@163.com\n林志荣等:卵清蛋白诱导129Sv小鼠建立哮喘模型的方法965就这一方法的实施及相关评价指标做一详细介绍。转移到新的离心管中,置于–20ºC保存用于分析细胞因子水平;沉淀用PBS悬浮后用于细胞计数和涂1材料与方法片观察(瑞氏—姬姆萨染色,Wright-Giemsastaining),1.1试剂和仪器根据染色后细胞的形态、大小以及核的形态区分成OVA(Sigma公司),用生理盐水配制成1%的溶嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞。液;生理盐水(丰原涂山制药有限公司);氢氧化铝佐体积从小到大是:淋巴细胞、中性粒细胞、巨噬细剂(国药);戊巴比妥钠(Sigma公司);980超声雾化仪胞和嗜酸细胞。嗜酸性粒细胞颗粒呈鲜红至桔红色;器(上海新天缘医疗设备有限公司);荧光定量PCR仪巨噬细胞核呈浅紫色,胞质呈灰蓝色;淋巴细胞核呈(Eppendorf公司);ELISAkit(eBioscience公司);眼科深蓝紫色,胞质呈天蓝色;中性粒细胞核为蓝紫色,剪;旋转石蜡切片机(Thermo公司);Synergy2多功能颗粒呈蓝紫至紫红色。酶标仪(BioTek公司)。1.5.2肺部基因表达水平测定及肺组织切片HE染色1.2实验动物灌洗液回收结束后立即处死小鼠。肺部组织一部分SPF级别的129Sv小鼠12只(上海南方模式生提取RNA并用荧光定量RT-PCR分析基因表达水平,[17]物研究中心保种供应),均为雄性,6~8周龄,体重另一部分用于HE染色观察组织病理情况。24~30g,分为实验组6只,对照组6只。小鼠饲养在1.6实验数据处理恒温(21~22ºC)和具备空气过滤的房间,每隔12h光实验所得数据采用OriginPro7.0软件进行数据暗循环。非实验期间小鼠自由进食及饮水,食物为处理,统计学分析采用students’t-test。辐照消毒后的标准鼠粮,饮水为高温消毒后的纯净水。本文的动物实验方案获得单位动物伦理委员会2结果的批准。经过OVA致敏及喷雾处理后,实验组小鼠可以1.3OVA哮喘模型的建立观察到烦躁不安,出现频繁瘙痒的行为改变。实验组在第0天和第5天分别给每只小鼠腹腔注通过对小鼠支气管肺泡灌洗液(BALF)中的细射含有20μgOVA和2mg氢氧化铝佐剂的生理盐水。胞进行瑞氏—姬姆萨染色,根据染色后细胞的形态、对照组仅给予佐剂。从第12天开始实验组小鼠用1%大小以及核的形态区分成嗜酸性粒细胞、巨噬细胞、的OVA生理盐水溶液进行喷雾处理,激发小鼠的过敏淋巴细胞和中性粒细胞,通过计数统计后发现,OVA反应,每天2次,每次1h,2次间隔4h,共进行5天。对实验组BALF中总细胞及上述各种细胞类型的数目照组仅给予生理盐水雾化吸入。喷雾过程在规格为与对照组小鼠相比有显著的提高(图1)。同时,实验27cm×20cm×10cm的透明塑料容器中进行。容器一组小鼠BALF中细胞因子IL-4、IL-5和IL-13的水平头连接超声雾化器,经超声振荡产生的OVA气雾剂进显著高于对照组小鼠(图2),说明OVA抗原致敏能激入容器,在容器另一头有两个小孔,便于气体流通。发小鼠中跟哮喘相关的Th2类细胞因子的上调。荧1.4临床观察表1炎症因子RT-PCR引物主要观察小鼠是否出现烦躁不安、呼吸急促、Table1Primersforinflammatorycytokine腹肌抽搐、大小便失禁等症状。引物序列1.5炎症标本采集及分析PrimerSequence1.5.1支气管肺泡灌洗(bronchoalveolarlavage,BAL)IL-4F5’-ACAGGAGAAGGGACGCCAT-3’IL-4R5’-GAAGCCCTACAGACGAGCTCA-3’最后一次OVA喷雾处理24h后对小鼠进行支气管IL-5F5’-AGCACAGTGGTGAAAGAGACCTT-3’肺泡灌洗。小鼠称重后注射戊巴比妥钠进行全身麻IL-5R5’-TCCAATGCATAGCTGGTGATTT-3’醉。麻醉后固定在解剖台上,用手术刀纵向切开颈IL-10F5’-GGTTGCCAAGCCTTATCGGA-3’部肌肉暴露气管进行气管插管,用1mL注射器向IL-10R5’-ACCTGCTCCACTGCCTTGCT-3’IL-13F5’-GGAGCTGAGCAACATCACACA-3’气管内缓慢注射1mLPBS并反复抽吸2次,回收率IL-13R5’-GGTCCTGTAGATGGCATTGCA-3’50%~90%,回收液即为肺支气管肺泡灌洗液(BALEotaxinF5’-TGTCTCCCTCCACCATGCA-3’liquid,BALF)。灌洗液3000r/min离心10min,上清EotaxinR5’-GATCTTCTTACTGGTCATGATAAAGCA-3’\n966·专题介绍·光定量PCR也证明了实验组小鼠肺部与哮喘相关基相比,实验组小鼠均发生了肺部血管及支气管壁增因的表达显著上调(图3)。病理分析表明,与对照组厚,并伴随大范围的淋巴细胞浸润(图4)。末次OVA喷雾处理24h后,小鼠肺泡灌洗液(BALF)中总细胞、嗜酸性粒细胞、巨噬细胞、淋巴细胞和中性粒细胞计数。NC为腹腔注射佐剂组(对照组),OVA表示腹腔注射乳清蛋白组(实验组)。数据以mean±SEM表示,n=6,*P<0.01,**P<0.005,***P<0.0001。Totalcellandeosinophils,macrophages,lymphocytesandneutrophilscountsinBALFofOVA(OVA)treatedmiceandNon-OVA(NC)treatedmice24hafterthelastOVAatomizationimbibition.Dataareshownasmean±SEM,n=6,*P<0.01,**P<0.005,***P<0.0001.图1肺泡灌洗液(BALF)中的总细胞数及各类细胞数Fig.1TotalanddifferentialcellcountsintheBALFn=6,数据以mean±SEM表示,*P<0.01,**P<0.005。NC与OVA组小鼠哮喘相关基因的相对表达量。数据以mean±SEM表n=6,dataareshownasmean±SEM,*P<0.01,**P<0.005.示,n=6,*P<0.01,**P<0.005。图2ELISA检测灌洗液(BALF)中相关因子的水平RelativeexpressionofsomeasthmarelatedgenesinlungsfromOVAFig.2RelativecytokineproductioninBALFbyELISA(OVA)treatedmiceandNon-OVA(NC)treatedmice.Dataareshownasmean±SEM,n=6,*P<0.01,**P<0.005.图3哮喘模型小鼠肺部哮喘相关基因的表达情况Fig.3Expressionofasthmarelativegenes\n林志荣等:卵清蛋白诱导129Sv小鼠建立哮喘模型的方法967箭头所指表示小鼠经OVA致敏激发后肺部血管壁及支气管壁增厚,发生了淋巴细胞浸润。10倍视野下,图A和图B的标尺=100μm;20倍视野下,图C和图D的标尺=40μm。ArrowindicatesthatvesselwallandbronchialwallofOVAtreatedmiceincreasedthickness,andtheinfiltratinglymphocyte.A,B,bar=100μm;C,D,bar=40μm.图4哮喘模型小鼠肺病理切片及HE染色Fig.4PathologicalsectionandHEstainingofmouselungtissue3讨论我们参考了文献[16-17]的报道,进行了实验研与其它动物相比,小鼠哮喘模型具有许多优势,究,结果表明,OVA致敏129Sv小鼠,出现了哮喘的典如成本较低、易于获得、繁殖力强、遗传背景清楚、型分子生物学特征。Th2细胞因子的表达显著增加,相关研究较为丰富等。尤其是小鼠可以利用基因剔其中IL-5能使嗜酸细胞活化与增殖,在形成气道嗜[18][19]除技术和转基因技术方便地获得各种突变体,易于酸粒细胞炎症中起到重要的作用。国外学者已研究哮喘的分子机制。证实IL-4可诱导B淋巴细胞合成IgE,本文中实验组实验小鼠品系很多,常用的品系有C57BL/6、BALF及肺部因子分析均表明IL-4均比对照组高,也129Sv、BALB/c、CBA等。不同小鼠品系在气道反提示着IgE的滴度会上调,研究人员可以对最后一次应性、T淋巴细胞免疫等方面有自身不同的特点。OVA喷雾处理24h后的小鼠采取血清检测IgE,也可C57BL/6小鼠对尘螨和豚草抗原的反应性较强,而以用BALF检测IgE。气道高反应性也是作为哮喘疾BALB/c小鼠较易产生针对卵白蛋白(OVA)和花粉的病模型的一个指标,利用该模型深入研究哮喘机理,气道高压反应(airwayhyper-responsiveness,AHR)和如:平滑肌重塑及气道重塑等变化的研究人员,可以高滴度IgE。检测这个指标,目前,国内外大多采用全身性体积描当前,制备基因剔除小鼠的ES细胞常来源于记法测定方法。129Sv,因此观察用129Sv品系的小鼠是否易于建立该哮喘模型可以用来研究气道嗜酸性细胞炎小鼠哮喘模型具有一定的指导意义。OVA预致敏症、气道高压反应、气道黏液产生、化学介质和细制作动物哮喘模型,有不同的致敏激发方式。OVA胞因子分泌变化以及基因及相关药物作用等。但该的使用浓度也不尽相同,不同的文献报道的模型制模型往往只形成急性炎症,缺少肺组织纤维化、平作有不同的差异。本文摸索出以致敏剂量为20μg滑肌增生、微血管增多、气道壁增厚等慢性炎症表OVA和2mg氢氧化铝佐剂的生理盐水建立129Sv小现,AHR也只持续至末次雾化激发后72h,以后逐渐鼠哮喘模型。恢复至正常水平,这些特点需要在研究中注意。\n968·专题介绍·参考文献(References)airwaysbyinhibitingtheinfiltrationofCD41Tcells.JExpMed1993;177(2):573-6.1BusseWW,CoffmanRL,GelfandEW,KayAB,Rosenwasser11ShibataY,FosteLA,BradfieldJF,MyrvikQN.Oraladministra-LJ.Mechanismsofpersistentairwayinflammationinasthma.Ationofchitindown-regulatesserumIgElevelsandlungeosino-roleforTcellsandT-cellproducts.AmJRespirCritCareMedphiliaintheallergicmouse.JImmunol2000;164(3):1314-21.1995;152(1):388-93.12ShibataY,FosterLA,KurimotoM,OkamuraH,NakamuraRM,2PiccinniMP,MaggiE,RomagnaniS.EnvironmentalfactorsKawajiriK,etal.ImmunoregulatoryrolesofIL-10ininnateim-favoringtheallergen-specificTh2responseinallergicsubjects.munity:IL-10inhibitsmacrophageproductionofIFN-gamma-AnnNYAcadSci2000;917:844-52.inducingfactorsbutenhancesNKcellproductionofIFN-gamma.3RayA,CohnL.Th2cellsandGATA-3inasthma:NewinsightsJImmunol1998;161(8):4283-8.intotheregulationofairwayinflammation.JClinInves1999;13HasegawaA,HayashiK,KishimotoH,YangM,TofukujiS,104(8):985.SuzukiK,etal.Color-codedreal-timecellularimagingoflung4ZhuZ,ZhengT,HomerRJ,KimYK,ChenNY,CohnL,etal.T-lymphocyteaccumulationandfocusformationinamouseAcidicmammalianchitinaseinasthmaticTh2inflammationandasthmamodel.JAllergyClinImmunol2010;125(2):461-8.e6.IL-13pathwayactivation.Science2004;304(5677):1678-82.14KucharewiczI,Bodzenta-LukaszykA,BuczkoW.Experimental5SiddiquiS,MartinJG.Structuralaspectsofairwayremodelinginasthmainrats.PharmacolRep2008;60(6):783-8.asthma.CurrAllergyAsthmaRep2008;8(6):540-7.15KungTT,JonesH,AdamsGK3rd,UmlandSP,KreutnerW,6BosseY,ParePD,SeowCY.Airwaywailremodelinginasthma:EganRW,etal.Characterizationofamurinemodelofaller-Fromtheepitheliallayertotheadventitia.CurrAllergyAsthmogicpulmonaryinflammation.IntArchAllergyImmunol1994;2008;8(4):357.105(1):83-90.7MosmannTR,CoffmanRL.TH1andTH2cells:Differentpat-16YangL,CohnL,ZhangDH,HomerR,RayA,RayP.Essentialternsoflymphokinesecretionleadtodifferentfunctionalproper-roleofnuclearfactorkappaBintheinductionofeosinophiliainties.AnnuRevImmunol1989;7:145-73.allergicairwayinflammation.JExpMed1998;188(9):1739-50.8SurS,LamJ,BouchardP,SigounasA,HolbertD,Metzger17BraddingP,WallsAF,HolgateST.TheroleofthemastcellinWJ.ImmunomodulatoryeffectsofIL-12onallergiclungthepathophysiologyofasthma.JAllergyClinImmunol2006;inflammationdependontimingofdoses.JImmunol1996;117(6):1277-8.157(9):4173-80.18MattesJ,FosterPS.RegulationofeosinophilmigrationandTh29GavettSH,O’HearnDJ,LiX,HuangSK,FinkelmanFD,Wills-cellfunctionbyIL-5andeotaxin.CurrDrugTargetsInflammAl-KarpM.Interleukin12inhibitsantigen-inducedairwayhyperrelergy2003;2(2):169-74.sponsiveness,inflammation,andTh2cytokineexpressionin19DelpreteG,MaqqiE,ParronchiP,ChrétienI,TiriA,MacchiaD,mice.JExpMed1995;182(5):1527-36.etal.IL-4isanessentialfactorfortheIgEsynthesisinducedin10IwamotoI,NakajimaH,EndoH,YoshidaS.Interferongregu-vitrobyhumanTcellclonesandtheirsupernatauts.JImmunollatesantigen-inducedeosinophilrecruitmentintothemouse1998;140(12):4193-8.AMethodtoInduceAsthmaModelbyOVAin129SvMiceStrain11222*LinZhirong,WangWeigang,YanHuimin,WuYoubing,RenJianke1(SchoolofLifeScienceandTechnology,TongjiUniversity,Shanghai200092,China;2ShanghaiResearchCenterforModelOrganisms,Shanghai201203,China)AbstractAsmorbidityofasthmaisincreasinginrecentyears,itisnecessarytoinvestigatethemolecularmechanismandtreatmentmethodsofasthma.OVAisoneofseveralsensitinogensforinducingasthmainmice,rat,guineapigandrabbit.Inthisarticle,weintroducedamethodtoinduceasthmamodelin129SvstrainbyOVAanddescribedtheevaluationindexforthismodel,whichprovidereferenceforresearchist.Keywordsasthma;OVA;ultrasonicatomizinginhalation;129SvReceived:May16,2011Accepted:July5,2011ThisworkwassupportedbytheGrant863ProgramofChina(No.2008AA02Z126)andProgramofScienceandTechnologyCommissionFoun-dationofShanghai(No.10140901400)*Correspondingauthor.Tel:86-21-50793648-82022,E-mail:renjk98@163.com查看更多