- 2022-08-12 发布 |
- 37.5 KB |
- 54页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
细胞生物学02细胞生物学研究方法
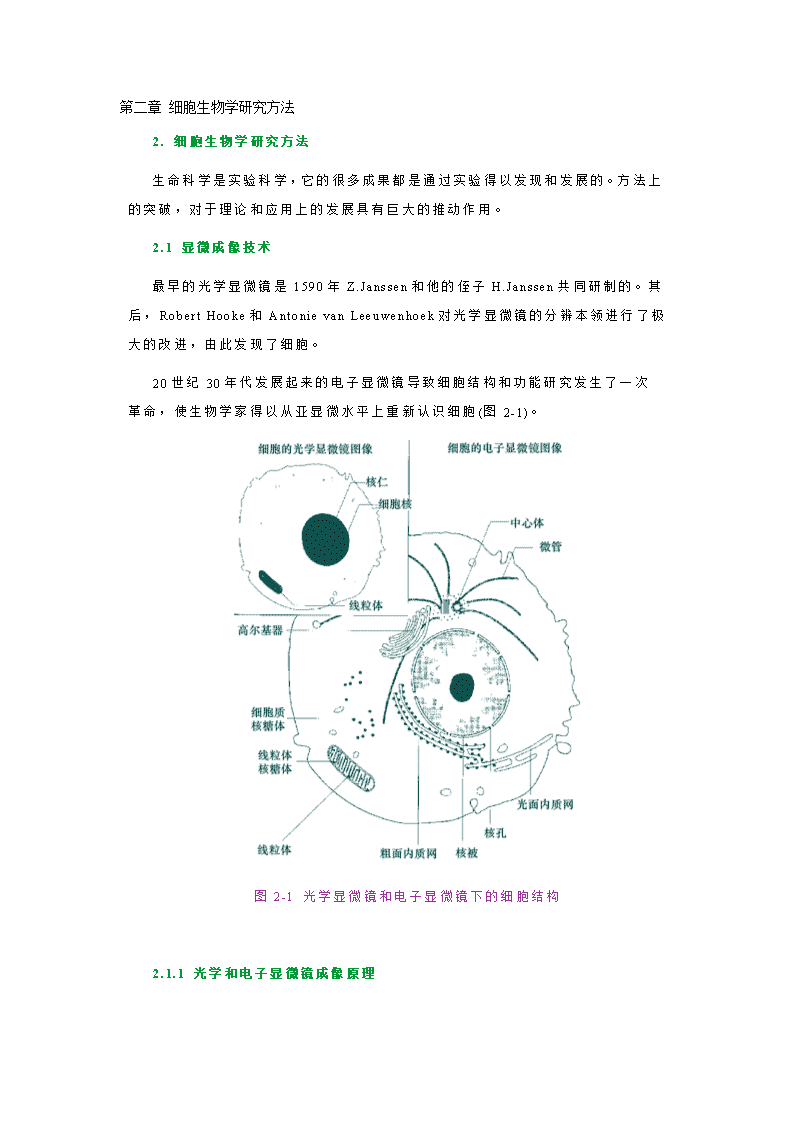
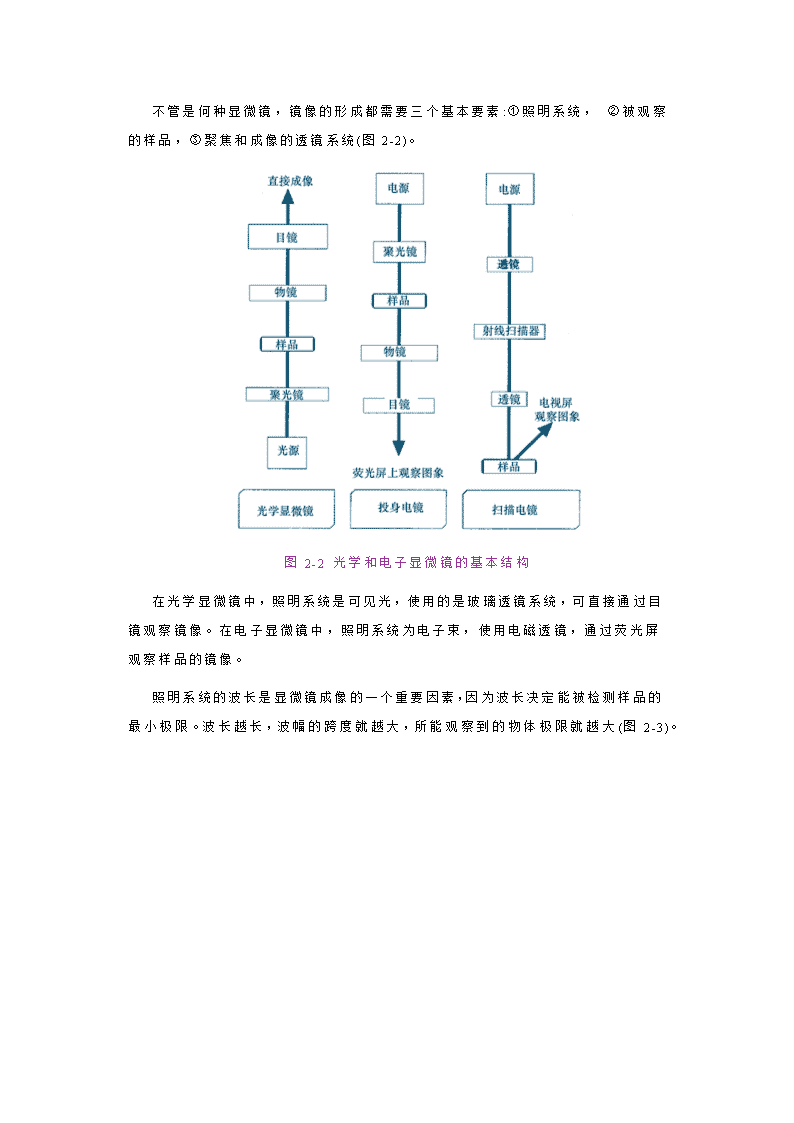
第二章细胞生物学研究方法2.细胞生物学研究方法生命科学是实验科学,它的很多成果都是通过实验得以发现和发展的。方法上的突破,对于理论和应用上的发展具有巨大的推动作用。2.1显微成像技术最早的光学显微镜是1590年Z.Janssen和他的侄子H.Janssen共同研制的。其后,RobertHooke和AntonievanLeeuwenhoek对光学显微镜的分辨本领进行了极大的改进,由此发现了细胞。20世纪30年代发展起来的电子显微镜导致细胞结构和功能研究发生了一次革命,使生物学家得以从亚显微水平上重新认识细胞(图2-1)。图2-1光学显微镜和电子显微镜下的细胞结构 2.1.1光学和电子显微镜成像原理\n不管是何种显微镜,镜像的形成都需要三个基本要素:①照明系统,②被观察的样品,③聚焦和成像的透镜系统(图2-2)。图2-2光学和电子显微镜的基本结构在光学显微镜中,照明系统是可见光,使用的是玻璃透镜系统,可直接通过目镜观察镜像。在电子显微镜中,照明系统为电子束,使用电磁透镜,通过荧光屏观察样品的镜像。照明系统的波长是显微镜成像的一个重要因素,因为波长决定能被检测样品的最小极限。波长越长,波幅的跨度就越大,所能观察到的物体极限就越大(图2-3)。\n图2-3波的移动、波长和干扰 请对图2-3作出说明1.图2-3的解释(答案)\n答:两个儿童共同振动一根绳子产生的波动类似于光子光子和电子形成的波,以此说明物体的大小对波的干扰。(a)两个儿童振动绳子产生的特征波长;(b)向绳子波中扔进一个球或一个物体,如果扔进物体的直径与绳子波长相近,就会干扰绳子波的移动;(3)如果扔进一个垒球或其他物体比绳子波长小得多,对绳子波的移动只有很小或没有干扰;(d)如果将绳子快速振动,波长就会大大缩短;(e)此时扔进垒球就会干扰绳子波的移动。●光学和电子显微镜成像的光学原理是相同的,其中最重要的是光子和电子都具有波的行为。当光子和电子穿过透镜到达聚焦点时,由于波的干涉(interference)性质而成像。实际上通过透镜观察到的样品的镜像是通过透镜波的干涉累加或消除,即衍射(diffraction)的结果。●焦距与角孔径焦距(focallength)是透镜的中心平面到焦点的距离(图2-4),而角孔径(angularaperture)是光从样品进入显微镜的物镜半角α(图2-5),因此角孔径实际表示有多少光离开样品通过透镜,最好的光学显微镜的角孔径大约是700。图2-4透镜的焦距\n图2-5透镜的角孔径角孔径是光从样品进入透镜的半角α。(a)小孔径透镜;(b)大角孔径透镜。角孔径越大,透过透镜的信息越多,最好的玻璃透镜的角孔径大约是700 ■分辨率(resolution)(分辨率是指能分辨出的相邻两个物点间最小距离的能力,这种距离称为分辨距离。分辨距离越小,分辨率越高。一般规定∶显微镜或人眼在25cm明视距离处,能清楚地分辨被检物体细微结构最小间隔的能力,称为分辨率。人眼的分辨率是100μm;光学显微镜的最大分辨率是0.2μm)透镜最重要的性质就是它的分辨率,分辨率(R)可用以下公式计算: R=0.61λ/nSinα其中:n=聚光镜和物镜之间介质的折射率.空气为1.油为1.5; α=样品对物镜角孔径的半角,sinα的最大值为1; λ=照明光源的波长。 0.61是一个恒定的参数,表示成像的点虽被重叠但仍能被区别的程度。上式中nSinα的量称为物镜的数值孔径(numericaperture),缩写为NA,因此显微镜的分辨率的表示公式可改为:R=0.61λ/NA\n从上式可知,角孔径越大,进入物镜的光越多;介质的折射率越大,则数值孔径越大,这些都可以使分辨率提高。由于分辨率表示的是能够区别两个点间最近距离的能力,所以R值越小,分辨率越高。从分辨率的表达式来看,NA越大,分辨率越高,或者波长越短,分辨率越高。 ■分辨极限(limitresolution)与放大率(magnification)●一般地说,一定波长的射线不能用以探查比它本身波长短得多的结构细节,这是一切显微镜的一个基本限度。对可见光来说,能清楚地分辨出相邻两点之间的最小间隔是0.2μm,称之为分辨极限(limitresolution)。●最终成像的大小与原物体大小的比值称为放大率。总放大率=物镜放大率×目镜放大率,放大率同样受分辨极限的限制。一般来说,光学显微镜的最大放大率只能是透镜的数值孔径的1000倍。由于透镜的数值孔径的范围是1.0~1.4,所以光学显微镜在用空气作介质时最大放大倍数为1000倍,用油镜则为1400倍。●增大角孔径或缩短波长可提高光学显微镜的分辨率。如果用波长比普通波长短得多的电子波代替光波,分辨率可大大提高,电子显微镜就是在这种需求下被发明的。表2-1是光学显微镜与电子显微镜某些特性的比较。表2-2电子显微镜与光学显微镜的基本区别 分辨本领光源透镜真空光学显微镜300nm可见光玻璃透镜不需真空200nm(油镜)可见光玻璃透镜不需真空100nm紫外光玻璃透镜不需真空电子显微镜0.1nm电子束电磁透镜真空2.1.2常用的光学显微镜光学显微镜(lightmicroscope)是光学显微技术的主要工具,自问世以来已有400多年历史。光学显微镜是利用光线照明,使微小物体形成放大影像的仪器。现今使用的光学显微镜都是由几个透镜组合而成,所以又称为复合显微镜(compoundmicroscope)(图2-6)。\n图2-6普通光学显微镜的基本结构■普通双筒显微镜(binocularmicroscope)比较高级的显微镜上都设有倾斜式的双目镜筒(图2-7)。在物镜转换器上方装有四个棱镜,使经过物镜的光线平分为两路到达目镜,故双筒显微镜的亮度要比单筒者为暗。双筒显微镜的优点为同时用两眼观察,有较强的立体感。\n图2-7双筒显微镜■荧光显微镜(fluorescencemicroscope)(以紫外线为光源,用以照射被检物体,使之发出荧光,然后在显微镜下观察物体的形状及其所在位置。荧光显微镜用于研究细胞内物质的吸收、运输、化学物质的分布及定位等)荧光显微镜的工作原理是利用紫外线发生装置(如弧光灯、水银灯等)发出强烈的紫外线光源,通过照明设备把显微固定的切片或活染的细胞透视出来,基本成像原理示于图2-8。\n图2-8荧光显微镜的光通路■相差显微镜(phasecontrastmicroscope)(相差显微镜是荷兰科学家Zermike于1935年发明的,用于观察未染色标本的显微镜。活细胞和未染色的生物标本,因细胞各部细微结构的折射率和厚度的不同,光波通过时,波长和振幅并不发生变化,仅相位发生变化(振幅差),这种振幅差人眼无法观察。而相差显微镜通过改变这种相位差,并利用光的衍射和干涉现象,把相差变为振幅差来观察活细胞和未染色的标本。相差显微镜和普通显微镜的区别是:用环状光阑代替可变光阑,用带相板的物镜代替普通物镜,并带有一个合轴用的望远镜。相差显微镜具有两个其他显微镜所不具有的功能:①将直射的光(视野中背景光)与经物体衍射的光分开;②将大约一半的波长从相位中除去,使之不能发生相互作用,从而引起强度的变化)相差显微镜在结构上进行了特别设计,尤其是光学系统有很大的不同(图2-9),可用于观察未染色的活细胞(图2-10)。\n图2-9相差显微镜的光学部件及光线通路\n图2-10相差显微镜观察的活细胞■暗视野显微镜(darkfieldmicroscope)暗视野显微镜是利用特殊的聚光器使照明光线不能进入物镜被放大,在黑暗的背景下呈现明亮的像。这种特殊的照明方式,使反差增大,分辨率提高,用以观察未经染色的活体或胶体粒子(图2-11)。\n图2-11暗视野显微镜的光学暗视野显微镜主要观察的是物体的轮廓,分辨不清内部的微细构造,适合于观察活细胞内的细胞核、线粒体、液体介质中的细菌和霉菌等。■倒置显微镜倒置显微镜的结构组成与普通显微镜一样,所不同的只是它的物镜与照明系统的位置颠倒过来。前者置于载物台之下,而后者在载物台的上方。集光器与载物台之间的工作距离提高,可以放置培养皿、培养瓶等容器,直接对培养的细胞进行照明和观察(图2-12)\n图2-12倒置显微镜2.1.3光学显微镜的样品制备与观察由于大多数细胞的成分不影响光线的穿透,无法形成反差,所以在一般光学显微镜下,几乎看不清未经处理的细胞。为了看清细胞内含物,就必须对细胞样品进行一些特殊的处理,为此建立和发展了样品的各种制备技术。 ■样品的固定(fixation)●目的:生物组织在染色前先进行固定的目的是杀死细胞,稳定细胞的化学成份,并且使样品硬化以便在进一步的处理和切片时不会受到破坏。●做法:样品固定的最简单做法是将样品直接浸泡在固定液中。固定使得大分子交联而保持在一定的位置上,不致于在以后的染色等处理过程中移位或丢失而产生人工假象。一般用具有缓冲作用的醛类固定液,用甲醛或戊二醛作固定剂,能够与蛋白质的游离氨基形成共价键,从而将邻近的蛋白质分子牢固地交联在一起。\n ■包埋和切片(embeddingandsectioning)样品制备的第二步是将固定的组织制备成切片。为此,样品首先要被包埋在介质中,通常用液态的石蜡或树脂做包埋剂,使之渗入整块组织,然后将之硬化成固体的包埋块,随后用专门的切片机切割包埋块,制备成薄切片(图2-13)。适用于光学显微镜观察的切片厚度为l~10μm。图2-13用切片机进行样品切片 ■染色(staining)大多数细胞总重量的70%是水,对可见光几乎是透明的,只有很少的内含物不透光。染色的目的就是给细胞的不同组分带上可区别的颜色特征。19世纪初,发现某些有机染料可染生物组织,并对细胞特殊部位的着色具有选择性。如苏木精(hematoxylin)对负电荷分子有亲和性,能显示出细胞内核酸的分布;酸性染料如伊红(eosin)可使细胞质染色;苏丹染料(Sudandyes)在脂肪中的溶解度比在乙醇中大,所以苏丹染料的乙醇饱和溶液能使脂肪着色。但对许多染料的特异性染色机理尚不清楚。 ■细胞化学技术(cytochemistry)●采用比有机染料更为特异的染色剂及酶细胞化学方法,可以了解细胞和组织中大致的化学组成,及某些活性基团或酶的存在。\n●为了测定蛋白质、核酸、多糖和脂类,常利用一些显色剂与所检测物质中特殊基团的特异性结合,通过显色剂在细胞中出现的部位和颜色显示的程度,从而判断被检物质在细胞中的分布和含量。例如,利用Feulgen反应(图2-14)可特异性检测细胞中的DNA,PAS反应可用于检测植物中的淀粉、纤维素及动物细胞中的糖原、粘蛋白等。●将细胞或组织切片与适宜的底物共同温育,切片中的酶会水解底物,再将所释放物质转变成不溶性有色化合物,后者所在部位即是组织细胞中酶的活性部位。图2-14Feulgen反应 ■放射自显影(autoradiography)(放射自显影的原理是利用放射性同位素所发射出来的带电离子(α或β粒子)作用于感光材料的卤化银晶体,从而产生潜影,这种潜影可用显影液显示,成为可见的"像",因此,它是利用卤化银乳胶显像检查和测量放射性的一种方法。放射性核素的原子不断衰变,当衰变掉一半时所需要的时间称为半衰期。各种放射性核素的半衰期长短不同(表),在自显影实验中多选用半衰期较长者。对于半衰期较短的核素,应选用较快的样品制备方法,所用剂量也应加大。 \n表自显影实验中常用核素的半衰期与能量名称半寿期粒子类型能量(MeV)名称半寿期粒子类型能量(MeV)3H12.3yrβ0.01845Ca152dβ0.2611C20minβ0.98159Fe45dβ0.4614C5700yrβ0.155 γ1.3032P14.3dβ1.7160Co5.3yrβ0.30835S87.2dβ0.16764Cu12.8hrβ0.657131I8.0dβ0.25 γ1.35)放射自显影技术是用感光胶片测定细胞内某种被放射性标记的物质在细胞固定时所在的位置,基本过程如图2-15所示。图2-15放射自显影术2.1.4电子显微镜(electronmicroscope)\n光源与分辨率的关系同样适于电子束,由于电子束的波长比光的波长短100,000倍,因而用电子束代替光波,可大大提高显微镜的分辨率。1932年德国学者MaxKnolls和ErnstRuska发明了第一台电子显微镜,开拓了超微世界,发现了许多光镜下看不到的结构,如细胞膜、线粒体、细胞核、高尔基体、中心粒等细胞器的细微结构。将在光学显微镜中观察不到而只能在电子显微镜下观察的结构称为亚显微结构(submicroscopestructure),或超微结构(ultrastructure)。电子显微镜与光学显微镜在总体结构的设计上有很大的差别(图2-16)。在种类上,电镜可分为两大类:透射电子显微镜和扫描电子显微镜。图2-16光镜与电子显微镜(透射电镜)的结构 ■透射电子显微镜(transmissionelectronmicroscope,TEM)透射电子显微镜主要是让电子束穿透样片而成像。电子显微镜基本结构由三大部分组成∶电子光学系统(镜筒)、真空系统、电子学系统(供电系统)。电子光学系统由照明系统、样品室、成像系统、观察窗和记录用的照相机等组成。由于电子显微镜必需在高度真空条件下进行工作,阴极与阳极之间会放电,\n灯丝也会因受到氧化或被阳离子轰击而缩短寿命,所以设计了真空系统。电子学系统即供电系统,需要高压稳压。为什么电子显微镜需要真空系统?为什么电子显微镜需要真空系统(vacuumsystem)?(答案)答:由于电子在空气中行进的速度很慢,所以必须由真空系统保持电镜的真空度,否则,空气中的分子会阻挠电子束的发射而不能成像。用两种类型的真空泵串连起来获得电子显微镜镜筒中的真空,当电子显微镜启动时,第一级旋转式真空泵(rotarypump)获得低真空,作为二级泵的预真空;第二级采用油扩散泵(oildiffusionpump)获得高真空。 ■扫描电子显微镜(scanningelectronmicroscopy,SEM)(扫描电子显微镜是1965年发明的较现代的细胞生物学研究工具,主要是利用二次电子信号成像来观察样品的表面形态,即用极狭窄的电子束去扫描样品,通过电子束与样品的相互作用产生各种效应,其中主要是样品的二次电子发射。二次电子能够产生样品表面放大的形貌像,这个像是在样品被扫描时按时序建立起来的,即使用逐点成像的方法获得放大像)扫描电子显微镜(图2-17)使用与透射电子显微镜完全不同的方式成像,即用电视的方式成像。扫描电子显微镜主要由电子光学系统和显示单元组成,它的光学系统结构示于图2-18。图2-17扫描电子显微镜\n图2-18扫描电子显微镜的光学系统 ■扫描透射电镜(既有透射电子显微镜又有扫描电子显微镜的显微镜。象SEM一样,STEM用电子束在样品的表面扫描,但又象TEM,通过电子穿透样品成像。STEM能够获得TEM所不能获得的一些关于样品的特殊信息。STEM技术要求较高,要非常高的真空度,并且电子学系统比TEM和SEM都要复杂)与高压电镜(同透射电子显微镜基本相同,只是电压特别高。TEM使用的加速电压是50~100kV,而HVEM使用的电压是200~1000kV。由于电压高,就会大大减少造成染色体畸变的可能,因此,可以用较厚的细胞切片研究细胞的结构,切片的厚度最大可达1μm,相当于普通TEM样品厚度的10倍)(图2-19,2-20)\n图2-19扫描透射电子显微镜图2-20高压电镜 \n■电子显微镜的样品制备如同光学显微镜,电子显微镜的样品也需固定、包埋、切片、染色等(图2-21)。与光镜相比,用于电子显微镜的组织固定有什么特殊的要求?与光镜相比,用于电子显微镜的组织固定有什么特殊的要求?(答案)答:比光镜的要求更高。首先是样品要薄,这是因为电子的穿透能力十分有限,即使是100~200kV高压,电子穿透厚度仅为1μm。通常把样品制成50~100nm厚的薄片(一个细胞切成100~200片),称超薄切片(ultrathinsection)。其次是要求很好地保持样品的精细结构,特别是在组织固定时要求既要终止细胞生命,又不破坏细胞的结构。第三是要求样品要具有一定的反差。电子显微镜的样品切片最后被放置在载网上而不是玻片上。图2-21电子显微镜样品的制备过程●负染色(negativestainning)(用重金属盐(如磷钨酸钠、醋酸铀等)对铺展在载网上的样品进行染色,使整个载网都铺上一层重金属盐,而有凸出颗粒的地方则没有染料沉积。由于电子密度高的重金属盐包埋了样品中低电子密度的背景,增强了背景散射电子的能力以提高反差,这样,在图像中背景是黑暗的,而未被包埋的样品颗粒则透明光亮,这种染色称为负染技术。负染色是只染背景而不染样品,与光学显微镜样品的染色正好相反)\n一些生物大分子组成的结构,如病毒、线粒体基粒、核糖体和蛋白质组成的纤维等可以通过负染色电镜技术观察其精细结构,还可以从不同角度观察三维结构(图2-22)。图2-22烟草rattle病毒的负染色●铸型技术(shadowcasting)铸型技术(铸型技术是电子显微镜中一种重要的增强背景和待观察样品反差的方法。基本过程包括:①将样品置于云母的表面,然后干燥;②在真空装置中将样品镀上一层重金属(金或铂金),喷镀时的加热丝具有一定的角度;③将样品镀上一层碳原子,以增加铸型的强度和稳定性;④将铸型置于酸池中,破坏样品,只留下金属铸型;⑤将铸型漂洗后置于载网上进行电子显微镜观察)是电子显微镜中一种重要的增强背景和待观察样品反差的方法(图2-23)。\n图2-23铸型技术●冰冻断裂复型(先将生物样品在液氮中(-196℃)进行快速冷冻,防止形成冰晶。然后将冷冻的样品迅速转移到冷冻装置中,并迅速抽成真空。在真空条件下,用冰刀横切冰冻样品,使样品内层被分开露出两个表面。如用冰刀切开细胞膜时,分开的两个面分别称为P面(protoplasmicface)和E面(exoplasmicface),P面是靠近细胞质一面的半层膜,而E面则是靠近细胞外基质面的半层膜,可清楚地观察到镶嵌蛋白)和冰冻蚀刻(是在冰冻断裂技术的基础上发展起来的更复杂的复型技术。如果将冰冻断裂的样品的温度稍微升高,让样品中的冰在真空中升华,而在表面上浮雕出细胞膜的超微结构。当大量的冰升华之后,对浮雕表面进行铂-碳复型,并在腐蚀性溶液中除去生物材料,复型经重蒸水多次清洗后,置于载网上作电镜观察)是专门观察样品外表面的投影复型术(图2-24)。\n图2-24冰冻断裂与冰冻蚀刻技术2.1.5间接成像技术\n光学显微镜和电子显微镜是利用质子和电子使样品直接成像的技术,还有一些显微方法是间接成像。所谓间接成像,举一个例子,假定你拿起一个物体,非常靠近你的眼睛进行观察,你或许觉得该物体有六个平面、十二条边和八个角,然后将你感觉到的画出来,可能是一个盒子,这就是间接成像。下面讨论的是几种间接成像的方法,这些方法都具有原子级分辨力,它们的分辨率比最好的电子显微镜还高10倍。虽然这些方法目前都还有一定的缺陷限制着在生物学中的应用,但具有发展潜力。■扫描隧道显微镜(scanningtunnelingmicroscope,STM)(扫描隧道显微镜使用电子学的方法,用一个金属针尖在在样品表面扫描。当针尖和样品表面距离很近时(1nm以下),针尖和样品表面之间会产生电压。当针尖沿X和Y方向在样品表面扫描时,就会在针尖和样品表面第一层电子之间产生电子隧道。该显微镜设计的沿Z字形扫描,可保持电流的恒定。因此,针尖的移动是隧道电流的作用,并且可以反映在荧光幕上。连续的扫描可以建立起原子级分辨率的表面像。与电子显微镜或X线衍射技术研究生物结构相比,扫描隧道显微镜具有以下特点∶①高分辨率扫描隧道显微镜具有原子级的空间分辨率,其横向空间分辨率为lÅ,纵向分辨率达0.1Å,②扫描隧道显微镜可直接探测样品的表面结构,可绘出立体三维结构图像。③扫描隧道显微镜可在真空、常压、空气、甚至溶液中探测物质的结构。由于没有高能电子束,对表面没有破坏作用(如辐射,热损伤等)所以能对生理状态下生物大分子和活细胞膜表面的结构进行研究,样品不会受到损伤而保持完好。④扫描隧道显微镜的扫描速度快,获取数据的时间短,成像也快,有可能开展生命过程的动力学研究。⑤不需任何透镜,体积小,有人称之为"口袋显微镜"(pocketmicroscope)。)扫描隧道显微镜由IBM公司瑞士苏黎世研究所的两位学者BinningG.和Rohrer\nH.等在1981年发明的具有原子显像力的显微镜,是根据量子力学中的隧道效应原理而制成的。这种显微镜对生物、物理、化学等学科均有推动作用,可用于研究表面的原子结构和电子结构(图2-25),故于1986年获得了诺贝尔物理学奖。图2-25扫描隧道显微镜DNA双螺旋结构的建立是根据X射线衍射结果推导出来的,至今还没有直接观察DNA结构的方法,所以对其中的微细结构还不够了解。用STM观察了DNA的双螺旋结构,见到DNA分子上的大沟(majorgroove)和小沟(minorgroove),并且了解DNA的结构随染色体长度而异(图2-26)。\n图2-26扫描隧道显微镜观察的DNA双螺旋结构■X-射线衍射(X-raydiffraction)X-衍射技术并不涉及显微镜,但是能够根据X-射线通过结晶样品形成的衍射样式成像。这一技术可用于在原子分辨的水平上推测分子的结构。实际上X-射线衍射技术是目前在原子水平上分析蛋白质、核酸和其他生物分子的惟一方法。Watson和Crick提出DNA双螺旋结构模型的主要依据之一就是根据Franklin对DNA晶体衍射的结果(图2-27)。\n图2-27DNA分子结构X-衍射分析2.2细胞化学技术(cytochemistry)细胞生物学的一个主要特点是将细胞形态观察与细胞成分分析结合起来,其中一个重要的研究手段就是细胞化学技术。细胞化学技术不是单一的技术,而是一整套有关联的技术,包括酶细胞化学技术、免疫细胞化学技术、放射自显影技术、示踪细胞化学技术等。 2.2.1酶细胞化学技术(enzymecytochemistry)(将细胞内的酶与底物相互作用,再将酶反应的产物作为反应物质,在酶的作用部位进行捕捉,使其在显微镜下具有可见性。这种在酶作用下产生反应产物,经捕捉反应来间接证明酶定位的反应称为酶的细胞化学反应。酶的细胞化学反应包括两个反应:第一反应是酶作用于底物的反应,称酶反应,形成的产物称为初级反应产物;第二反应是捕捉剂与初级反应产物的作用,称捕捉反应,产生最终反应产物:┌────酶的细胞化学反应─────┐│酶+条件 初级 捕捉剂 │底物──→反应产物──→最终反应产物 (酶反应) (捕捉反应))\n酶细胞化学技术就是通过酶的特异细胞化学反应来显示酶在细胞内的定位。由于酶的细胞化学定位对研究细胞的生理功能和病理过程具有重要作用,而且很多酶可以作为细胞膜和各种细胞器的标志酶,这为研究细胞器的结构与功能、细胞器的相互关系以及细胞的鉴别等提供有力的手段,这一技术越来越受到重视。2.2.2免疫细胞化学技术(immunocytochemistry)免疫细胞化学技术是利用免疫反应定位组织或细胞中抗原成分分布的一类技术。主要分为两大类:免疫荧光技术和免疫电镜技术。 ■免疫荧光技术(immunofluorescence)(将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位)将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。■免疫电镜(immunoelectronmicroscopy)(将抗体进行特殊标记后用电子显微镜观察免疫反应的结果。根据标记方法的不同,分为免疫铁蛋白技术、免疫酶标技术和免疫胶体金技术。如免疫铁蛋白技术是将含铁蛋白通过一种低分子量的双功能试剂与抗体结合,成为一种双分子复合物,它既保留抗体的免疫活性,又具有电镜下可见的高电子密度铁离子核心,因此用铁蛋白标记的抗体可通过电镜免疫化学的方法在电镜下定位细胞中的抗原。由于某些固定技术(如锇酸固定)对抗体抗原的结合有干扰,因此应采取较为温和的样品制备方法)2.2.3细胞分选技术(cellsorting)细胞分选技术是细胞生物学研究中一个全新的技术领域,主要用流式细胞计(flowcytometer,FCM)对细胞(图2-28)或染色体(图2-29)进行分选,并进行定量分析。 ■流式细胞计流式细胞计主要由以下几部分组成∶\n●激光光源:可发出合适波长的光。●流室(flowchamber):生物颗粒在此与鞘液(sheathfluid)相混。鞘液包裹着细胞的液滴经喷嘴(tip)流出,当液滴下流至适当位置,受激光照射可发射出不同的光讯号。●讯号接受器(detector)∶由光学透镜装置和光电倍增管组成,接收放大各种光讯号,并把它们转变成电脉冲讯号。●讯号分析部件∶为微型电子计算机装置,对讯号作出分析。 ■细胞分选(cellsorting)图2-28流式细胞计分选细胞示意图什么是细胞分选?原理是什么?什么是细胞分选?基本原理是什么?(答案)答:用流式细胞计将特定的细胞分选分选出来的技术,分选前,细胞要被戴上特殊的标记。所用的标记细胞的探针是能够同待分选细胞表面特征性蛋白(抗原)结合的抗体,而这种抗体又能够同某种荧光染料结合。当结合有荧光染料的探针与细胞群温育时,探针就会同具有特异表面抗原的细胞紧紧结合,由于抗体的结合,被结合的细胞带上了荧光标记。细胞被标记之后,除去游离的抗体,并将细胞进行稀释。当稀释的细胞进入超声波振荡器时,极稀的细胞悬浮液形成很小的液滴,一个液滴中只含有一个细胞。液滴一旦形成并通过激光束时,激光束激发结合在细胞表面抗体分子成为一种标签。当液滴逐个通过激光束时,受到两种检测器的检测:如果液滴中含有细胞就会激活干涉检测器(interference\ndetector),只有带有荧光标记细胞的液滴才会激活荧光检测器(fluorescencedetector)。当带有荧光标记的液滴通过激光束时,将两种检测器同时激活,引起液滴充电信号使鞘液带上负电荷。由于液滴带有负电荷,移动时就会向正极移动,进入到荧光标记细胞收集器中。如果是含有非荧光标记细胞的液滴进入激光束,只会被干涉检测器检测到,结果使充电信号将液滴的鞘液带上正电荷,从而在移动时偏向负极,被非荧光标记细胞收集器所收集。如果是不含有细胞的液滴进入激光束,则不会被任何检测器所检测,因而不会产生充电信号,液滴的鞘液不会带上任何电荷,所以在移动时不受任何影响直接进入非检测的收集器。 ■染色体分选(chromosomesorting)图2-29用于染色体分选的染色体荧光探针标记2.2.4其他细胞化学技术 ●显微分光光度术(microspectrophotometry)(将显微镜技术与分光光度计结合起来的技术。它以物质分子的光吸收、荧光发射和光反射特性作为测定基础,可用来分析生物样品细微结构中的化学成分,同时进行定位、定性和定量)●显微荧光光度术(microfluorometry)(利用显微分光光度计对细胞内原有能发光的物质或对细胞内各种化学成分用不同的荧光经荧光探针标记后进行定位、定性和定量地测定,称为显微荧光光度术,\n也称细胞荧光光度术(cytofluorometry)。它是一种微观而灵敏的方法,对于研究细胞的结构、功能及其变化具有重要意义)●核磁共振技术(nuclearmagneticresonance,NMR)(核磁共振技术可以直接研究溶液和活细胞中相对分子质量较小(20,000道尔顿以下)的蛋白质、核酸以及其它分子的结构,而不损伤细胞。核磁共振的基本原理是:原子核有自旋运动,在恒定的磁场中,自旋的原子核将绕外加磁场作回旋转动,叫进动(precession)。进动有一定的频率,它与所加磁场的强度成正比。如在此基础上再加一个固定频率的电磁波,并调节外加磁场的强度,使进动频率与电磁波频率相同。这时原子核进动与电磁波产生共振,叫核磁共振。核磁共振时,原子核吸收电磁波的能量,记录下的吸收曲线就是核磁共振谱(NMR-spectrum)。由于不同分子中原子核的化学环境不同,将会有不同的共振频率,产生不同的共振谱。记录这种波谱即可判断该原子在分子中所处的位置及相对数目,用以进行定量分析及分子量的测定,并对有机化合物进行结构分析)2.3细胞工程技术(cellengineering)(细胞工程技术是细胞生物学与遗传学的交叉领域,主要利用细胞生物学的原理和方法,结合工程学的技术手段,按照人们预先的设计,有计划地改变或创造细胞遗传性的技术。包括体外大量培养和繁殖细胞,或获得细胞产品、或利用细胞体本身。主要内容包括:细胞融合、细胞生物反应器、染色体转移、细胞器移植、基因转移、细胞及组织培养)主要内容包括:细胞融合、细胞生物反应器、染色体转移、细胞器移植、基因转移、细胞及组织培养。 2.3.1细胞培养(cellculture)在体外模拟体内的生理环境,培养从机体中取出的细胞,并使之生存和生长的技术为细胞培养技术。培养中的细胞不受体内复杂环境的影响,人为改变培养条件(如物理、化学、生物等外界因素的变化)即可进一步观察细胞在单因素或多因素的影响下的生理功能变化。\n体外细胞培养的条件●物质营养●生存环境●废物的排除 ■原代培养(primaryculture)原代培养(原代培养是指直接从机体取下细胞、组织和器官后立即进行培养。因此,较为严格地说是指成功传代之前的培养,此时的细胞保持原有细胞的基本性质,如果是正常细胞,仍然保留二倍体数。但实际上,通常把第一代至第十代以内的培养细胞统称为原代细胞培养。最常用的原代培养有组织块培养和分散细胞培养。组织块培养是将剪碎的组织块直接移植在培养瓶壁上,加入培养基后进行培养。分散培养则是将组织块用机械法或化学法使细胞分散。如欲从胎儿或新生儿的组织分离到活性最好的游离细胞,经典的方法是用蛋白水解酶(如胰蛋白酶和胶原酶)消化细胞间的结合物,或用金属离子螯合剂(如EDTA)除去细胞互相粘着所依赖的Ca2+,再经机械轻度振荡,使之成为单细胞)是指直接从机体取下细胞、组织和器官后立即进行培养。细胞培养的一般过程如图2-30所示。\n图2-30人的细胞培养 ■细胞系和细胞株(celllineandcellstrain)●细胞系:原代培养物经首次传代成功后即为细胞系,有无限的传代能力。●细胞株:通过原代培养或经过细胞克隆与选择而建立的、具有特异的性质或标记的细胞系,但是它们具有有限的传代能力。 ■动物细胞培养方法●贴壁培养分散的细胞悬浮在培养瓶中很快(几十分钟至几小时)就贴附在瓶壁上,称为细胞贴壁,贴壁后的细胞形态形成多态性,呈单层生长,所以此法又叫单层细胞培养。单层培养的细胞保持接触抑制(contactinhibition)的特性。●悬浮培养\n悬浮培养的细胞在培养过程中不贴壁,一直悬浮在培养液中生长,如T细胞的培养就是如此。悬浮培养的条件较为复杂,难度也大一些,但是容易同时获得大量的培养细胞。 ■植物组织培养(planttissueculture)物组织培养是根据植物细胞的全能性发展起来的利用植物植株的不同组织培养成完整植株方法。例如叶片、茎段、根等都可以通过诱导形成愈伤组织(植物受创伤后,在伤面新生的组织称为愈伤组织。其原因是由于受创伤的刺激后,伤面附近的生活组织恢复了分裂机能,加速增生而将伤面愈合。在植物组织培养中的愈伤组织是指植物细胞在组织培养过程中形成的无一定结构的组织团块,在适宜的条件下,愈伤组织可再分化,形成芽、根,再生成植株),而后培养成植株(图2-231)。图2-31植物组织培养用打孔器将植物的叶片打成小圆片,然后与农杆菌进行共培养,接着放在诱导生芽的培养基上进行诱导培养,待芽长出后再转移到生根培养基上,诱导生根,最后移植到土壤中培养成完整的再生植株。 ■植物原生质体培养(图2-32)一般采用植物的体细胞(二倍体细胞),先经纤维素酶处理去掉细胞壁,\n这种脱去细胞壁的细胞称为原生质体。将原生质体放在合适的培养基上,经过诱导分化可以重新长成植株。原生质体也可用于植物细胞融合,然后诱导形成新的植株。图2-32植物原生质体培养2.3.2细胞融合与单克隆抗体技术\n■细胞融合(cellfusion)(在自发或人工诱导下,两个不同基因型的细胞或原生质体融合形成一个杂种细胞。基本过程包括细胞融合形成异核体(heterokaryon)、异核体通过细胞有丝分裂进行核融合、最终形成单核的杂种细胞。有性繁殖时发生的精卵结合是正常的细胞融合,即由两个配子融合形成一个新的的二倍体。自发的动物细胞融合机率很低,1962年Okada和Tadokoro发现灭活的仙台病毒有促进细胞融合的作用。这是由于病毒的磷脂外衣与动物细胞的膜十分相似的缘故。病毒外壳上的某些糖蛋白可能还有促进细胞融合的功能。此外,用聚乙二醇(polyethyleneglycol,PEG)作为细胞融合剂,它可引起邻近的细胞膜的粘合,继而使细胞融合成为一个细胞)指自发或人工诱导下,两个不同基因型的细胞或原生质体融合形成一个杂种细胞(图2-33)。有性繁殖时发生的精卵结合是正常的细胞融合,即由两个配子融合形成一个新的的二倍体。图2-33细胞融合\n■单克隆抗体技术(monoclonalantibodytechnique)(1975年英国科学家Milstein和Kohler所发明,并获得1984年诺贝尔医学奖。它是将产生抗体的单个B淋巴细胞同肿瘤细胞杂交,获得既能产生抗体,又能无限增殖将杂种细胞,并以此生产抗体的技术。其原理是:B淋巴细胞能够产生抗体,但在体外不能进行无限分裂;而瘤细胞虽然可以在体外进行无限传代,但不能产生抗体。将这两种细胞融合后得到的杂交瘤细胞具有两种亲本细胞的特性)1975年英国科学家Milstein和Kohler发明了单克隆抗体技术,因此获得1984年诺贝尔医学奖。1975年英国科学家Milstein和Kohler发明的单克隆抗体技术(monoclonalantibodytechnique)的实验原理和技术细节有哪些?(答案)[播放动画]答:1975年英国科学家Milstein和Kohler发明了单克隆抗体技术,因此获得1984年诺贝尔医学奖。它是将产生抗体的单个B淋巴细胞同肿瘤细胞杂交的技术,其原理是:B淋巴细胞能够产生抗体,但在体外不能无限分裂;而瘤细胞虽然可以在体外进行无限传代,但不能产生抗体。将这两种细胞融合后得到的杂交瘤细胞具有两种亲本细胞的特性,既能产生抗体,又能无限增殖。图E2-1所示是单克隆抗体制备流程。首先用一种抗原注射小鼠,引起产生特异抗体的细胞大量增殖,取出小鼠的脾,分离产生抗体的淋巴细胞,同骨髓瘤细胞进行融合,在HAT培养基上进行初步筛选后,经过进一步鉴定,得到生产单克隆抗体的细胞。\n图E2-1单克隆抗体技术筛选用的HAT培养基是选择性培养基,含有氨基喋呤(aminopterin,A)、次黄嘌呤(hypoxanthine,H)和胸腺嘧啶(thymidine,T)。在HAT培养基中,只有肿瘤细胞和正常细胞融合形成的杂交瘤细胞才能生存,而未融合的肿瘤细胞、正常细胞及非肿瘤细胞和正常细胞融合形成的细胞都会死亡。因为,正常的未融合细胞具有核酸合成主要通路和旁路所必需的酶但不能在体外长期生长;突变后的肿瘤细胞只具有RNA和DNA合成所必需的主通路的酶,而缺乏利用胸腺嘧啶核苷合成DNA的胸腺嘧啶核苷激酶(TK)或缺乏利用次黄嘌呤合成\nRNA的磷酸核糖转移酶(HGPRT)。当这些细胞的核酸合成主通路被培养基中氨基喋呤阻断后,则因核酸合成障碍而死亡。只有肿瘤细胞和具有合成旁路酶的正常细胞形成的融合细胞,才能在氨基喋呤、次黄嘌呤和胸腺嘧啶核苷存在的情况下利用其中的次黄嘌呤和胸腺嘧啶核苷合成核酸而得以生存。由于融合细胞具有肿瘤细胞和抗体分泌细胞双重特征,所以在去除氨基喋呤这一核酸阻断剂后即可在正常培养基中长期传代增殖,并分泌抗体。在HAT培养基中生存下来的细胞,可以是各种正常细胞与瘤细胞的融合体,还可能是多克隆杂交瘤细胞的混合群体,因此须进一步用稀释法分离出单克隆的杂交瘤细胞和筛选出识别特异性抗原的抗体分泌克隆,才能最终得到特异性单克隆抗体杂交瘤细胞株。图2-34所示是单克隆抗体制备流程。一旦有了抗体就可以从事多种研究。例如,抗体可用于蛋白质的纯化。将抗体添加到蛋白质的粗提取液中,相应的蛋白就会同抗体结合,然后一起沉淀下来。抗体还可用于许多免疫反应,以及应用于医学和临床。\n图2-34单克隆抗体技术■显微操作术(micromanipulation)(在显微镜下,用显微操作装置对细胞进行解剖手术和微量注射的技术属显微操作技术。显微操作仪是在显微镜下对细胞进行显微操作的装置,可用于细胞核移植、基因注入、染色体微切和胚胎切割等手术)\n在显微镜下,用显微操作装置对细胞进行解剖手术和微量注射的技术属显微操作技术。显微操作仪是在显微镜下对细胞进行显微操作的装置(图2-35),可用于细胞核移植、基因注入、染色体微切和胚胎切割等手术。图2-35显微操作仪2.3.3动物细胞核移植克隆技术1997年,英国苏格兰罗斯林研究所I.WI.Wilmut等首次成功通过细胞融合技术利用成年动物彻底分化的体细胞克隆出子代个体,开创了动物体细胞克隆的新时代。I.Wilmut等从成年个体母羊的乳腺组织分离单个乳腺细胞,然后与去核的羊的卵细胞融合,克隆得到一头绵羊"Dolly"(图2-36)。体细胞克隆技术有什么意义?动物体细胞克隆有什么意义?(答案)答:动物体细胞克隆技术的成功对生命科学的发展具有重要的推动作用,不仅证明了动物的体细胞具有全能性,\n而且有巨大的应用前景。例如结合转基因技术生产药物。现在很多药物如胰岛素、生长激素、表皮生长因子等都是动物细胞体内正常的代谢物,某些病人由于产生这些物质的功能发生缺陷,导致了相应疾病的发生,目前的治疗方法就是给这些病人注射这类药物。由于这类药物本身是来自动物的某些脏器,制备这种药物就需要大量的动物提供脏器,因此成本就很高,如果通过转基因技术把相应的基因转入到哺乳动物,让动物的乳汁生产具有疗效的蛋白质就会降低成本,再结合动物体细胞克隆技术,将这种转基因动物大量无性繁殖克隆,就可以大大提高产量,大幅度降低成本,同时也保证了所转基因的稳定。该项技术也可以生产供动物本身和人类器官移植的动物,解决器官捐赠长期缺乏的问题。另外,动物体细胞克隆技术在基因结构和功能、基因治疗、遗传病及人类衰老等的研究方面都具有巨大的潜力。图2-36细胞核移植克隆绵羊。2.4分离技术分离技术是一大类技术的总称,包括细胞组分的分离和生物大分子的分离。 2.4.1离心分离技术离心分离细胞组分和生物分子是最常用的分离方法,因为不同的细胞器和分子有不同的体积和密度(图2-37),可在不同离心力的作用下沉降分离。常用的两类离心分离方法是速度离心(velocitycentrifugation)和等密度离心(isodensitycentrifugation)(等密度离心分离样品主要是根据被分离样品的密度。在这种离心分离方法中,要用介质产生一种密度梯度,这种密度梯度覆盖了待分离物质的密度,这样,通过离心使不同密度的颗粒悬浮到相应的介质密度区。在这种梯度离心中,颗粒的密度是影响最终位置的惟一因素,因此用这种方法分离颗粒,主要是根据被分离颗粒的密度差异。只要被分离颗粒间的密度差异大于1%就可用此法分离。蔗糖或者甘油(它们的最大密度是1.3g/cm3\n)通常可用于分离膜结合的细胞器,如高尔基体、内质网、溶酶体和线粒体。在等密度梯度离心中蔗糖或甘油的梯度的作用与移动区带离心中梯度原理是不同的,在移动区带离心中梯度的惟一目的是减少样品的扩散,即使是在离心管的底部,颗粒的密度也比介质大。相反,在等密度梯度离心中,使用的密度是足以阻止颗粒移动的密度,当颗粒达到与本身密度相同的密度区时就会停留在该区域。离心分离密度大于1.3g/cm3的样品,如DNA、RNA,需要使用密度比蔗糖和甘油大的介质。重金属盐氯化铯(CsCl)是目前使用的最好的离心介质,它在离心场中可自行调节形成浓度梯度,并能保持稳定。在氯化铯形成的密度梯度中,离心管顶部的密度为:1.65g/cm3,底部为:1.75g/cm3。因为DNA的密度是1.70g/cm3,会停留在离心管的中部)。图2-37不同的细胞器、大分子和病毒的密度及相应的沉降系数 ■速度离心分离细胞器和大分子在速度离心分离中有两种不同的方法:●差速离心(differentialcentrifugation)(图2-38)。(主要是采取逐渐提高离心速度的方法分离不同大小的细胞器。起始的离心速度较低,让较大的颗粒沉降到管底,小的颗粒仍然悬浮在上清液中。收集沉淀,改用较高的离心速度离心悬浮液,将较小的颗粒沉降,以此类推,达到分离不同大小颗粒的目的)图2-38差速离心的原理\n●移动区带离心(moving-zonecentrifugation)(图2-39)(这一方法需要用蔗糖或甘油制备轻微的连续密度,然后将待分离的样品加在离心管的最上层,形成一狭窄的带,再通过较长时间的离心。在离心过程中,大小、形状、密度不同的颗粒就会分开,最后收集各区带得到要分离的物质。在此方法中,分离介质对被分离的物质必须是中性无害的,并且密度梯度较低,底部的密度比管顶部的密度大,建立密度梯度的目的是防止扩散。重要的是,待分离颗粒的密度比离心管中任何部分介质的密度都要大。常用的是蔗糖密度梯度离心(sucrosedensitygradientcentrifugation))图2-39移动区带离心分离将含有两种体积稍微不同的颗粒样品小心加在有轻微梯度的离心管介质的液面上(蔗糖或甘油)。离心适当时间,样品中的颗粒向管底部移动(不能离心太久,太久了两种颗粒都会沉淀到底部),由于体积的不同,移动的区带速度不同。然后收集不同区带的样品进行分析。 ■等密度离心(图2-40)\n图2-40密度梯度离心分离溶酶体、线粒体和微体离心分离密度大于1.3g/cm3的样品,如DNA、RNA,需要使用密度比蔗糖和甘油大的介质。重金属盐氯化铯(CsCl)是目前使用的最好的离心介质,它在离心场中可自行调节形成浓度梯度,并能保持稳定(图2-41)。图2-41CsCl密度梯度离心分离DNA蔗糖、甘油和氯化铯都是密度离心分离中的介质,它们在性质上、使用上和原理上有什么不同?蔗糖、甘油和氯化铯都是密度离心分离中的介质,它们在性质上和使用上有什么不同?(答案)答:CsCl可自行形成密度梯度,所以不必特别制备密度梯度,只要将待分离的样品与之混匀即可。在离心的过程中,具有不同密度的颗粒随CsCl密度梯度的形成重新分配;而蔗糖和甘油要人工置备密度梯度。蔗糖和甘油的最大密度为1.3g/cm3,所以只能用于分离密度在1.3g/cm3以下的细胞器或细胞结构;而氯化铯的最大密度可达1.9g/cm3以上,可用于分离密度大于1.3g/cm3的DNA分子。\n在原理上,由于具有不同密度的颗粒随CsCl密度梯度的形成重新分配,所以又称为浮力密度离心(buoyantdensitycentrifugation);而蔗糖和甘油则是在被离心的物质在下降的过程中由于密度的不同而被阻止在不同的部位,故是重力密度离心。在速度离心时,被分离的分子越小,需要的离心速度越高。但是,离心机中影响速度高低的是转子的半径。离心力(g)是表示某种颗粒沉淀的最好方式,一般根据离心力和离心机转子的半径决定离心速度。常见细胞器离心沉淀所需的离心力列于表2-3。 表2-3不同的细胞结构分离所需的离心力结构离心力细胞核800-1000g线粒体20,000-30,000g叶绿体20,000-30,000g溶酶体20,000-30,000g微体20,000-30,000g粗面内质网50,000-80,000g质膜和光面内质网80,000-100,000g游离核糖体、病毒粒子150,000-300,000g2.4.2层析分离技术(chromatography)(根据蛋白质的形态、大小和电荷的不同而设计的物理分离方法。各种不同的层析方法都涉及共同的基本特点:有一个固定相和流动相,当蛋白质混合溶液(流动相)通过装有珠状或基质材料的管或柱(固定相)时,由于混合物中各组份在物理化学性质(如吸引力、溶解度、分子的形状与大小、分子的电荷性与亲和力)等方面的差异使各组分在两相间进行反复多次的分配而得以分开。流动相的流动取决于引力和压力,而不需要电流。用层析法可以纯化得到非变性的、天然状态的蛋白质。层析的方法很多,其中凝胶过滤层析、离子交换层析、亲和层析等是目前最常用的层析方法)\n层析是广泛使用的分离蛋白质的方法,它是根据蛋白质的形态、大小和电荷的不同而设计的物理分离方法。凝胶过滤层析、离子交换层析、亲和层析等是目前最常用的层析方法。 ■凝胶过滤层析(gelfiltrationchromatography)(凝胶过滤层析法又称排阻层析或分子筛方法,主要是根据蛋白质的大小和形状,即蛋白质的质量进行分离和纯化。层析柱中的填料是某些惰性的多孔网状结构物质,多是交联的聚糖(如葡聚糖或琼脂糖)类物质,使蛋白质混合物中的物质按分子大小的不同进行分离)凝胶过滤层析法又称排阻层析或分子筛方法,主要是根据蛋白质的大小和形状,即蛋白质的质量进行分离和纯化(图2-42)。图2-42凝胶层析法三种不同的蛋白质根据它们大小的不同在层析柱中被分离。 ■亲和层析(affinitychromatography)(将具有特殊结构的亲和分子制成固相吸附剂放置在层析柱中,当要被分离的蛋白混合液通过层析柱时,与吸附剂具有亲和能力的蛋白质就会被吸附而滞留在层析柱中。那些没有亲和力的蛋白质由于不被吸附,直接流出,从而与被分离的蛋白质分开,然后选用适当的洗脱液,改变结合条件将被结合的蛋白质洗脱下来,这种分离纯化蛋白质的方法称为亲和层析。\n在生物分子中有些分子的特定结构部位能够同其他分子相互识别并结合,如酶与底物的识别结合、受体与配体的识别结合、抗体与抗原的识别结合,这种结合既是特异的,又是可逆的,改变条件可以使这种结合解除。生物分子间的这种结合能力称为亲和力。亲和层析就是根据这样的原理设计的蛋白质分离纯化方法)在生物分子中有些分子的特定结构部位能够同其他分子相互识别并结合,如酶与底物的识别结合、受体与配体的识别结合、抗体与抗原的识别结合,这种结合既是特异的,又是可逆的,改变条件可以使这种结合解除。生物分子间的这种结合能力称为亲和力。亲和层析就是根据这样的原理设计的蛋白质分离纯化方法(图2-43)。图2-43亲和层析(a)琼脂糖珠的表面吸附剂(如胰岛素配体)只能同特异的受体结合(胰岛素);(b)亲和层析的基本步骤。 ■离子交换层析(ion-exchangechromatography)\n离子交换层析的原理是什么?离子交换层析的原理是什么?(答案)答:离子交换层析是根据蛋白质所带电荷的差异进行分离纯化的一种方法。蛋白质的带电性是由蛋白质多肽中带电氨基酸决定的。由于蛋白质中氨基酸的电性又取决于介质中的pH,所以蛋白质的带电性也就依赖于介质的pH。当pH较低时,负电基团被中和,而正电基团就很多;在pH较高时,蛋白质的电性与低pH时相反。当蛋白质所处的pH,使蛋白质的正负电荷相等,此时的pH称为等电点。离子交换层析所用的交换剂是经酯化、氧化等化学反应引入阳性或阴性离子基团制成的,可与带相反电荷的蛋白质进行交换吸附。带有阳离子基团的交换剂可置换吸附带负电荷的物质,称为阴离子交换剂,如DEAE-纤维素树脂;反之称为阳离子交换剂,如CM-纤维素树脂。不同的蛋白质有不同的等电点,在一定的条件下解离后所带的电荷种类和电荷量都不同,因而可与不同的离子交换剂以不同的亲和力相互交换吸附。当缓冲液中的离子基团与结合在离子交换剂上的蛋白质相竞争时,亲和力小的蛋白质分子首先被解吸附而洗脱,而亲和力大的蛋白质则后被解吸附和洗脱。因此,可通过增加缓冲液的离子强度和/或改变酸碱度,便可改变蛋白质的吸附状况,使不同亲和力的蛋白质得以分离。离子交换层析是根据蛋白质所带电荷的差异进行分离纯化的一种方法(图2-44)。\n图2-44离子交换层析通过DEAE-纤维素将两种不同带电性的蛋白质分离开。图中显示的是带正电的离子交换树脂结合带负电的蛋白。2.5分子生物学方法分子生物学是用于在分子水平上研究生物大分子的结构和功能的一系列方法,包括基因重组技术、基因转移、分子杂交、PCR反应、序列分析等等,本节摘要介绍几种。 2.5.1基因工程技术(geneengineering)(基因工程是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因(DNA分子),按预先设计的蓝图,在体外构建杂种DNA分子,然后导入活细胞,以改变生物原有的遗传特性、获得新品种、生产新产品。基因工程技术为基因的结构和功能的研究提供了有力的手段)基因克隆(genecloning)(是70年代发展起来的一项具有革命性的研究技术,可概括为∶分、切、连、转、选。"分"是指分离制备合格的待操作的DNA,包括作为运载体的DNA和欲克隆的目的DNA;"切"是指用序列特异的限制性内切酶切开载体DNA,或者切出目的基因;"连"是指用DNA连接酶将目的DNA同载体DNA连接起来,形成重组的DNA分子;"转"是指通过特殊的方法将重组的DNA分子送入宿主细胞中进行复制和扩增;"选"则是从宿主群体中挑选出携带有重组DNA分子的个体。基因工程技术的两个最基本的特点是分子水平上的操作和细胞水平上的表达,而分子水平上的操作即是体外重组的过程,实际上是利用工具酶对DNA分子进行"外科手术")技术是70年代发展起来的一项具有革命性的研究技术,它的发明和发展,使生物学家能够在体外进行基因操作、基因转移、基因定点突变等研究。这项技术可概括为∶分、切、连、转、选。基因工程技术的两个最基本的特点是分子水平上的操作和细胞水平上的表达,而分子水平上的操作即是体外重组的过程,实际上是利用工具酶对DNA分子进行"外科手术"(图2-45)。\n图2-45DNA的分子操作2.5.2PCR技术PCR是英文聚合酶链式反应(polymerasechainreaction)的简称,是80年代发展起来的一项具有重大意义的分子生物学技术(图2-46)。图2-46PCR技术示意图2.5.3选择性基因敲除(geneknockout)(是指一个有功能的基因通过基因工程方法完全被剔除的人工突变技术。人为的将小鼠的某一种有功能的基因完全缺失的技术就称为基因敲除技术。这项技术是Marrio\nCapecchi于八十年代末在Utah大学发展起来的。实验的动物通常是小鼠,被敲除了功能基因的小鼠就称为敲除小鼠(knockoutmice)。基因敲除技术已成功地应用于几种遗传病的研究,还可用于研究特定基因的细胞生物学活性以及研究发育调控的基因作用等,因此是研究基因功能的一项非常有用的技术。基因敲除是一套组合技术,包括基因重组、细胞分离培养、转基因等)与转基因鼠基因工程技术的建立使人们能够对DNA先进行克隆,随后筛选鉴定特定功能的基因,而不必预先知道所克隆的DNA具有何种功能,基因敲除是最有效的方法之一。基因敲除是一套组合技术,包括基因重组、细胞分离、转基因等。图2-47显示了获得敲除CFTR(cysticfibrosistransmembraneconductanceregulator,囊性纤维化跨膜传导调节蛋白)基因小鼠的两个关键技术:体外重组与转基因鼠。图2-47转基因敲除小鼠的获得2.5.4乳腺生物反应器技术乳腺生物反应器是根据细胞生物学中蛋白质合成与分选的机理,结合基因工程技术、动物转基因技术等,利用动物的乳腺分泌某些具有重要价值的基因产物(图2-48)\n图2-48用转基因绵羊生产重要的医用蛋白质何谓乳腺生物反应器,它的出现有什么意义?何谓乳腺生物反应器,它的出现有什么意义?(答案)答:乳腺生物反应器是根据细胞生物学中蛋白质合成与分选的机理,结合基因工程技术、动物转基因技术等,利用动物的乳腺分泌某些具有重要价值的基因产物。乳腺生物反应器是一项综合技术,发展乳腺生物反应器不仅需要基因工程技术,也需要动物胚胎技术,转基因技术,蛋白质提纯技术和常规畜牧技术。乳腺生物反应器有特殊优点。乳腺生物反应器生产药品,基本上是一个畜牧业过程。查看更多