- 2021-05-27 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
等容变化,查理定律典型例题
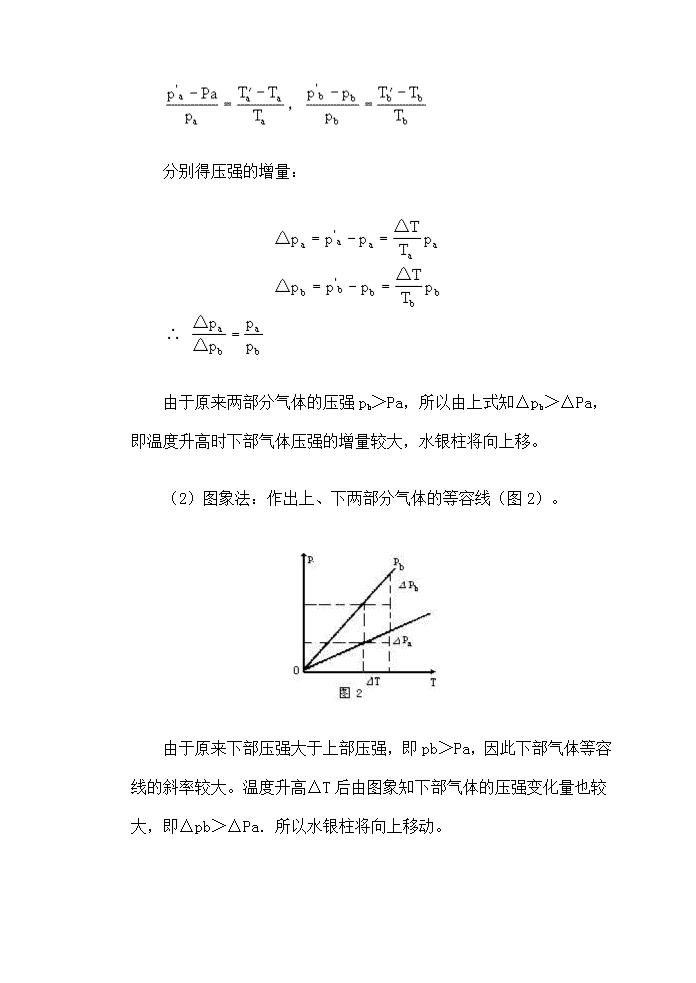
等容变化,查理定律典型例题 【例1】要求瓶内氢气在500℃时的压强不超过1atm,则在20℃时对瓶子充气时,瓶内压强最多为多少?瓶子的热膨胀不计。 【分析】不计瓶子热膨胀,充入瓶内的氢气经历的是一个等容变化。 【解】以充入瓶内氢气为研究对象,它在20℃和500℃时的状态参量为: 温度 T1=(273+20)k=293k,压强p1=? 温度 T2=(273+500)k=773k,压强p2=1atm。 也就是说,瓶内氢气在20℃时充气的最大压强为0.38atm。 【例2】一根两端封闭,粗细均匀的玻璃管,内有一小段水银柱把管内空气柱分成a、b 两部分,倾斜放置时,上、下两段空气柱长度之比柱将如何移动? 【分析】温度升高、Hg移动时,两部分空气的三个状态参量(T、p、V)都会发生变化,且双方互相牵制,将给判断带来很大困难。为此,可作一设想,即先假设温度升高时水银柱不动,两部分气体发生等容变化。然后比较它们压强的变化量,水银柱应朝着压强变化量较小的那一方移动。 【解】(1)公式法:两部分气体作等容变化前后的状态参量如下: 对两部分气分别运用查理定律: 或 分别得压强的增量: 由于原来两部分气体的压强pb>Pa,所以由上式知△pb>△Pa,即温度升高时下部气体压强的增量较大,水银柱将向上移。 (2)图象法:作出上、下两部分气体的等容线(图2)。 由于原来下部压强大于上部压强,即pb>Pa,因此下部气体等容线的斜率较大。温度升高△T后由图象知下部气体的压强变化量也较大,即△pb>△Pa.所以水银柱将向上移动。 【说明】还可作进一步研究。若使管中水银柱长l,倾角θ,则开始时由压强平衡条件知: pb=Pa+Lsinθ 上升; 高后,Hg并不移动。 【例3】一定质量气体在状态变化前后对应着图1中A、B两点,则与A、B两状态所对应的体积VA、VB的大小关系是 [ ] A.VA=VB B.VA>VB C.VA<VB D.无法比较 【分析】可通过A、B两点分别与原点O相连。得到两条等容线(图2),线上各点所对应的气体体积分别等于VA、VB.由于与VA对应的等容线的斜率大,表示它的体积小。 【答】C. 【说明】在p-T图上比较一定质量气体两条等容线的体积大小时,有不同的方法。 (1)比较同温度下的压强 如图3所示。在同一温度T时,p2>p1,据玻意耳定律得V2<V1。或根据压强的决定因素判定——温度相同时,分子的平均动能相同,压强大时对应的分子密度必较大,表示体积较小,所以V2<V1。 (2)比较同样压强下的温度 如图3所示,在同一压强p时,T1>T2,则与T1所对应的分子平均动能较大,要求V1体积内的气体产生与V2体积内的气体同样大小的压强,V1体积内的分子密度应较小,即V1体积较大,所以V1>V2。查看更多