广东省佛山市第一中学2020届高三上学期期中考试理科综合试题
广东省佛山市第一中学2020届高三上学期期中考试 理科综合试题
一、选择题:本题共13小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列关于细胞结构与成分的叙述,正确的是
A.细胞间的通讯都与细胞膜表面的糖蛋白有关
B.核糖体是细胞内蛋白质的“装配机器”,主要由蛋白质和tRNA组成
C.细胞核是遗传信息库,遗传信息的表达在细胞核中完成
D.细胞骨架是由蛋白质纤维组成的网架结构,能保持细胞形态
2.下列有关细胞生命历程的叙述,错误的是
A.细胞分裂能力随分化程度的提高而增强
B.癌变细胞的形态结构会发生显著变化
C.细胞凋亡有助于机体维持自身的相对稳定
D.衰老的细胞,细胞新陈代谢的速率减慢
3.图Z2-3表示可在植物细胞内发生的一些生理过程,下列分析错误的是
A.不同条件下发生a过程的场所可能不同
B. a、c、d均发生在生物膜上
C.在光照充足的条件下,a
Ms>ms。请回答下列问题:
(1)该种植物雄性不育品系在杂交育种过程中,在操作上最显著的优点是 。
(2)该种植物雄性可育的基因型有 种,其中基因型为 的植株自交后出现性状分离,使其雄性可育性状不能稳定遗传。
(3)现有某雄性可育性状能稳定遗传的植株甲,基因型为MsMs的植株乙。若要鉴定植株甲的基因型, 其实验步骤及结论如下:
实验步骤:
①让植株甲和植株乙进行杂交;
②将植株 (填“甲”或“乙”)所结的种子全部种下去;
③统计子代植株的表现型及比例,确定植株甲的基因型。
实验结论:子代植株的表现型及比例和对应的植株甲的基因型为 。
37.【生物——选修1:生物技术实践】(15分)
下表是某公司研发的一种培养大肠杆菌菌群的培养基配方,请根据表格和所学知识回答下列相关问题。
(1)从生态系统的成分上看,大肠杆菌属于 。
(2)若根据用途划分,该培养基属于 (填“选择”或“鉴别”)培养基。若要用上述培养基来筛选出土壤中的尿素分解菌,培养基的营养成分必需怎样更改? ,并用 作为指示剂。
(3)在微生物培养的过程中,为防止杂菌污染,需要对培养基和培养皿进行;操作者的双手需要进行清洗和 。
图1和图2是培养某细菌的结果图,其对应的接种方法分别是: _和 ,这两种方法接种后培养基上都可以得到由单个细胞繁殖所形成的 。图1所用的接种方法可用来对活菌进行计数。此外,测定微生物数目的另一种方法是 .
(5 )以下过程中所利用的主要微生物的细胞结构与大肠杆菌较相似的有 .
A.制作果酒 B.由果酒制作果醋
C.制作泡菜 D.制作腐乳
38.【生物——选修3现代生物科技专题】(15分)略
参考答案及评分标准 生物部分
1.D 2.A 3.B 4.B 5.D 6.C
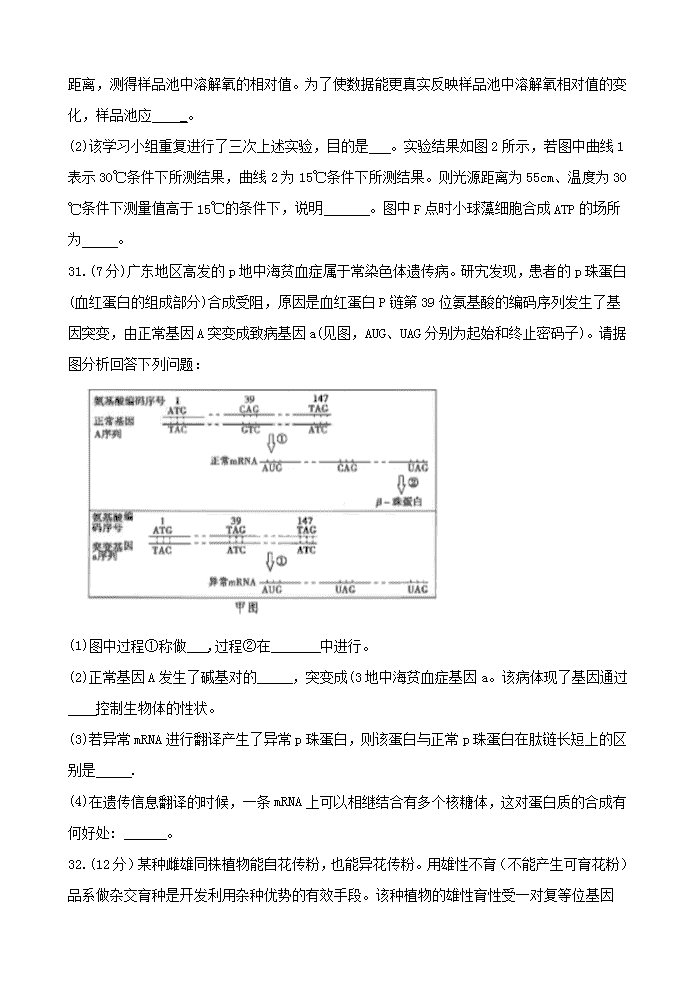
29.(10分)
(1)验证酶具有高效性 反应的活化能更显著
(2)酶的含量不同 小于2大于11 (3)低温(1分) 7(1分)
30.(10分)(除标明外,每空2分,共10分)
(1)相等(1分) 密闭(1分)
(2)取平均值减少实验误差(减少偶然误差对实验结果的影响)
距离为55cm时30℃条件下净光合作用大于15℃时的净光合作用
细胞质基质、线粒体、叶绿体 (少1个扣1分)
(3)30℃下光照距离低于55cm时样品池的氧气溶解达到饱和,溶解氧的相对值最大为A,多余的氧气不再溶解
31.(7分)
(1)转录(1分) 核糖体(1分)
(2)替换(1分) 控制蛋白质的结构直接(1分)
(3)组成异常β�珠蛋白的肽链更短(1分)
(4)少量的mRNA分子可以迅速合成出大量的蛋白质 (2分)
32.(12分)
(1)不用去雄(2分)【补充:不用对母本去雄】
(2)4(1分) MsfMs(2分)
(3)②乙(1分)
③实验结论:
若子代全部为雄性可育植株,则植株甲的基因型为MsfMsf(2分);
若子代植株中雄性可育︰雄性不育=1︰1,则植株甲的基因型为Msfms(2分);
若子代全为雄性不育植株,则植株甲的基因型为msms(2分)
37.【生物——选修1:生物技术实践】(除标注外每空2分,共15分)
(1)分解者 (2)鉴别 将蛋白胨改成尿素(2分) 酚红
(3)灭菌 消毒 (4)稀释涂布平板法(2分) 平板划线法(2分) 菌落 显微镜直接计数法(血球计数板计数法)
(5)BC(2分)
佛山一中2019-2020学年上学期髙三期中考试试题
理科综合---物理
二、选择题:本题共8个小题,每小题6分。在每小题给出的四个选项中,第14-18题只有一个选项符合
题目要求,第19-21题有两个或以上选项符合题目要求。全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.水平面上有质量相等的a、b两个物体,水平推力F1、F2分别作用
在a、b上,一段时间后撤去推力,物体继续运动一段距离后停下,两物体的图象如图所示,图中AB//CD.则整个过程中
A. F1的冲量等于F2的冲量
B. F1的冲量大于F2的冲量
C.摩擦力对a物体的冲量等于摩擦力对b物体的冲量
D.合外力对a物体的冲量等于合外力对b物体的冲量
15.在如图所示的图象和W图象中,给出的四条图线甲、乙、丙、丁分别代表四辆车由同一地点向同一方向运动的情况,则下列说法正确的是
A.甲车做曲线运动,乙车做直线运动
B. 0—t1时间内,甲车通过的路程大于乙车通过的路程
C.0-t2时间内,丙、丁两车的平均加速度相等
D.0-t2时间内,丙、丁两车平均速度相等
16.假设地球可视为质量均匀分布的球体,己知地球表面重力加速度在两极的大小为,赤道的大小为g; 地球自转的周期为r,引力常量为G,则地球的密度为
A. B. C. D.
17.如图所示,车厢里悬挂着两个质量不同的小球,上面的球比下面的球质量大,当小球和车厢一起向右 做匀加速运动(空气阻力不计)时,下列各图中正确的是
18.如图所示,k是一质量为M的盒子,B的质量为,用细绳相
连,跨过光滑的定滑轮,W置于倾角为=30°的斜面上,B悬于斜面 之外,处于静止状态.现在向A中缓慢地加入沙子,整个系统始终 保持静止,则在加入沙子的过程中下列说法错误的是
A.绳子拉力大小不变,恒等于
B.A对斜面的压力逐渐增大
C.A所受的摩擦力逐渐增大
D. A所受的摩擦力先减小后增大
19.如图,一固定容器的内壁是半径为的半球面;在半球面水平直径的一端有一质量为m的质点P。它在容器内壁由静止下滑到最低点的过程中,克服摩擦力做的功为W。重力加速度大小为g。设质点P在最低点时,向心加速度的大小为a,容器对它的支持力大小为N,则
A. B.
C. D.
20.如图所示,半径为R、质量为M的一光滑圆槽静置于光滑的水平地面上,一个质量为m的小木块从槽的顶端由静止滑下,直至滑离圆槽的过程中,下列说法中正确的是
A.M和m组成的系统动量守恒
B.m飞离圆槽时速度大小为
C. m飞离圆槽时速度大小为
D.m飞离圆槽时,圆槽运动的位移大小为
21.质量为m和M的两个物块A、B,中间夹着一根由轻绳束缚着的、被压缩的轻质弹簧,弹簧与A、B 不相连,它们一起在光滑的水平面上以共同速度向右运动,总动量为p,弹簧弹性势能为Ep。某时刻 轻绳断开,弹簧恢复到原长时,A刚好静止,B向右运动,与质量为M的静止物块C相碰并粘在一起。则
A.弹簧弹力对W的冲量大小为
B.弹簧弹力对B做功大小为Ep
C.全过程机械能减少量为Ep
D. B、C的最终速度为
二非选择题:
22. (6分)为了探宄加速度与力、质量的关系,甲、乙、丙三位同学分别设计了如图所示的实验装置, 小车总质量用M表示(乙图中M包括小车与传感器,丙图中M包括小车和与小车固连的滑轮),钩码总质量用m表示。
(1)为便于测量合外力的大小,并得到小车总质量一定时,小车的加速度与所受合外力成正比的结论, 下列说法正确的是
A.三组实验中只有甲需要平衡摩擦力
B.三组实验都需要平衡摩擦力
C.三组实验中只有甲需要满足所挂钩码的总质量m远小于小车的总质量M的条件
D.三组实验都需要满足所挂钩码的总质量m远小于小车的总质量M的条件
(2)若乙、丙两位同学发现某次测量中力传感器和测力计读数相同,通过计算得到小车加速度均为a,,g为当地重力加速度,则乙、丙两人实验时所用小车总质量之比为 ,乙、丙两人实验用的钩码总质量之比为 _ 。
23.(9分)某物理兴趣小组利用如图甲所示的装置进行验证动量守恒定律及平台上A点左侧与滑块a之间的动摩擦因数的实验。在足够大的水平平台上的A点放置一个光电门,水平平台上A点右侧摩擦很小,可忽略不计,左侧为粗糙水平面,当地重力加速度大小为g。采用的实验步骤如下:
A.在小滑块a上固定一个宽度为的窄挡光片;
B.用天平分别测出小滑块a (含挡光片)和小球b的质量ma、mb.
C.在a和b间用细线连接,中间夹一被压缩了的轻短弹簧,静止放置在平台上:
D.烧断细线后,a、6瞬间被弹开,向相反方向运动:
E.记录滑块a通过光电门时挡光片的遮光时间△t;
F.滑块最终停在C点(图中未画出),用刻度尺测出2C之间的距离&
G.小球b从平台边缘飞出后,落在水平地面的B点,用刻度尺测出平台距水平地面的高度A及平台边缘铅垂线与B点之间的水平距离外;
H.改变弹簧压缩量,进行多次测量。
(1)用螺旋测微器测量挡光片的宽度,如图乙所示,则挡光片的宽度为 mm;
(2)该实验要验证“动量守恒定律”,则只需验证两物体a、6弹开后的动量大小相等,即a的动量大小 等于b的动量大小 ;(用上述实验所涉及物理量的字母表示)
(3)改变弹簧压缩量,多次测量后,该实验小组得到小滑块a的&与7^关系图象如图丙所示,图象的斜率为k,则平台上W点左侧与滑块a之间的动摩擦因数大小为 。(用上述实验数据字母表示)
24.(12分)如图所示,一倾角=37°的斜面底端与一传送带左端相连于B点,传送带以的速度顺时针转动,有一小物块从斜面顶端点以的初速度沿斜面下滑,当物块滑到斜面的底端点时速度恰好为零,然后在传送带的带动下,从传送带右端的C点水平抛出,最后落到地面上的D点,已知斜面长 度L1=8m,传送带长度L2=18m,物块与传送带
之间的动摩擦因数
(1)求物块与斜而之间的动摩擦因数叫;
(2)求物块在传送带上运动时间;
(3)若物块在D点的速度方向与地面夹角为,求C点到地面的高度和C、D两点间的水平距离。
25.(20分)如图,质量为M=4kg的木板静止放在光滑水平面上,木板右端B点固定一根轻质弹簧,弹簧自由端在C点,C到木板左端的距离L=0.5m,质量为m= lkg的小木块(可视为质点)静止放在木板的左端,木块与木板间的动摩擦因数为=0.2,木板仙受到水平向左的恒力F=14N,作用一段时间后 撤去,恒力F撤去时木块恰好到达弹簧自由端C处,此后运动过程中弹簧最大压缩量=5cm,=10m/s2。求:
(1)水平恒力F作用的时间t;
(2)撤去F后,弹簧的最大弹性势能Ep;
(3)整个过程产生的热量Q。
33.【物理——选修3-3】(15分)
(1) (5分)下列说法正确的是 (填正确答案标号。选对1个得2分,选对2个得4分,选对3个得5分。每选错1个扣3分,最低得分为0分)
A.知道水的摩尔体积和水分子的体积,可计算出阿伏加德罗常数
B.在阳光照射下的室内可见尘埃在空中不停飞舞,这是尘埃的布朗运动
C.水黾可以停在水面而不沉入水中,是因为水的表面存在着表面张力
D.晶体具有各向异性,是因为其点阵结构中各个方向上微粒个数不均等
气体如果失去了容器的约束就会散开,这是因为气体分子间斥力大于引力的缘故
(2)(10分)如图所示,均匀薄壁C7型管竖直放置,左管竖直部分高度大于30cm且上端封闭,右管上端 开口且足够长,用两段水银封闭了 A、B两部分理想气体,下方水银左右液面等高,右管上方的水银柱高h=4cm,初状态温度为27℃,A气体长度 =15cw,大气压强.现使整个装置缓慢升温,当下方水银的左右液面高度相差=10cm时,保持温度不变,再向右 管中缓慢注入水银,使X中气柱长度回到15cm.求:
(1)升温后保持不变的温度是多少摄氏度?
右管中再注入的水银高度是多少?
34.【物理——选修3-4】(15分)略
参考答案及评分标准物理答案
14.D 15.C 16.A 17.B 18.C 19.AC 20BD. 21.AD
22.(1)BC; (2)1:2,1:2.
(1)AB、为便于测量合外力的大小,甲图通过钩码的总质量对应的重力即为合外力,
而乙图是力传感器的示数,丙图则是测力计的2倍,因此它们都必须平衡摩擦力,故A错误,B正确;
CD、由于甲图通过钩码的总质量对应的重力即为合外力,因此三组实验中只有甲需要满足所挂钩码的总质量m远小于小车的总质量M的条件,故C正确,D错误;
(2)乙、丙两位同学发现某次测量中力传感器和测力计读数相同,且通过计算得到小车加速度均为a,
根据牛顿第二定律,则有:F=M乙a,2F=M丙a;
因此乙、丙两人实验时所用小车总质量之比为1:2;
由牛顿第二定律,对砝码研究,则有m乙g-F=m乙a,
而m丙g-F=m丙2a
,
因a=g,解得,m乙:m丙=1:2;
即乙、丙两人实验用的钩码总质量之比为1:2;
故答案为:(1)BC; (2)1:2,1:2.
23.【答案】2.550 mbsb
【解析】解:(1)螺旋测微器的固定刻度读数为2.5mm,可动刻度读数为0.01×5.0mm=0.050mm,所以最终读数为:5.5mm+0.050mm=2.550mm。
(2)烧断细线后,a向左运动,经过光电门,根据速度公式可知,a经过光电门的速度为:va=;
故a的动量为:Pa=ma
b离开平台后做平抛运动,根据平抛运动规律可得:
h=gt2
sb=vbt
解得:vb=sb
动量大小:Pb=mbsb
若动量守恒,设向右为正,则有:0=mbvb-mava
即ma=mbsb即可验证动量守恒;
(3)对物体a由光电门向左运动过程分析,则有:
va2=2asa
经过光电门的速度:
va=
由牛顿第二定律可得:
a=μg
联立可得:
sa=
则由图象可知:
μ=
故答案为:(1)2.550;(2)ma;mbsb;(3)。
24.解:(1)从A到B由动能定理可知:
mgL1sin37°-μ1mgL1cos37°=0-mv
代入数据解得:μ1=0.875
(2)物块在传送带上由牛顿第二定律:μ2mg=ma
a=
达到传送带速度所需时间为t=s
加速前进位移为<18m
滑块在传送带上再匀速运动
匀速运动时间为
故经历总时间为t总=t+t′=4s
(3)设高度为h,则竖直方向获得速度为
联立解得h=3.2m
下落所需时间为
水平位移为xCD=vt″=6×0.8m=4.8m。
25.【解析】(1)对m:
(3)假设最终m没从AB滑下,由动量守恒可知最终共同速度仍为v=2.8m/s
设m相对AB向左运动的位移为s,则:
解得:s=0.15m
可知:,故上面假设正确。 全过程产热:
33.⑴【答案】ADE
【解答】
A、一定质量的理想气体的内能只与温度有关,温度越高,内能越大,故A正确。
B、第一类水动机研制失败的原因是违背了能量守恒定律,而第二类永动机研制失败的原因并不是违背了能量守恒定律,而是违背了热力学第二定律。故B错误。
C、当分子间距r>r0时,分子间的引力和斥力都随着分子间距的增大而减小,而且斥力减小更快,所以分子力表现为引力。故C错误。
D、相对湿度为某一被测蒸气压与相同温度下的饱和蒸气压的比值的百分数,大气中相对湿度越大,水气蒸发也就越慢,人就感受到越潮湿,故大雾天气学生感觉到教室潮湿,说明教室内的相对湿度较大。故D正确。
E、一定质量的单晶体在熔化过程中温度不变,分子的平均动能不变,所吸收的热量全部用来增大分子势能,故E正确。故选ADE。
⑵【答案】解:①缓慢升温过程中,对A中气体分析
初态:V1=l1S P1=P0+h=80cmHg T1=(27+273)K=300K
末状态:V2=(l1+△l)S,p2=p0+h+△l
,
由理想气体状态方程得:=,
代入数据解得:T2=450K;
得t2=1770C
②对A气体分析,初末态体积相同 T3=T2
p3=p0+h+△h,
由查理定律得:=,
代入数据解得:△h=40cm;可得再加入的水银高△h=(120-76-4)cm=40cm
佛山一中2019-2020学年上学期髙三期中考试试题
理科综合--化学
7.化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. “华为麒麟980”手机中芯片的主要成分是二氧化硅
B.流感疫苗要冷藏存放,以免蛋白质变性
C.“地沟油”经分馏可得汽油,用作汽车燃料
D.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型的有机高分子材料
8.设阿伏加德罗常数的值为NA,下列说法正确的是
A.标准状况下,2.24LCCU分子中共价键的数目为0.4NA
B. 2 L 0.5 mol/LH2S03溶液中含有的H+数目为2NA
C. 7.8gNa202固体中含有的离子总数为0.37NA
D.常温下,1 molFe与足量浓硝酸反应,电子转移数目为3NA
9. M是一种治疗济疮的新型药物,合成路线如下:
下列说法不正确的是
A.X的分子式为CiaH1602
B.Y分子中所有碳原子不可能在同一平面上
C.Y生成M的反应类型为取代反应
D.可用NaHCCb溶液或溴水鉴别X和M
10.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法正确的是
A.原子半径:Y>Z>X>W
B.简单氢化物的热稳定性:W>X>Z
C. Y、Z形成的化合物溶于水会促进水的电离
D.上述刺激性气体通入紫色石蕊溶液,溶液先变红后褪色
11.一种制备高效漂白剂NaC102的实验流程如图所示,反应I的化学方程式为: 3NaC103+4S02+3H20=2C102+Na2S04+3H2S04+NaCl,下列说法正确的是
A. NaClO2的漂白原理与SO2相同
B.反应I中氧化产物和还原产物物质的量比为4:3
C.反应II中H202做氧化剂
D.实验室进行蒸发操作通常在坩埚中进行
12.科学家设计了一种可以循环利用人体呼出的CO2并提供O2的装置,实现“太阳能-电能-化学能”的转化,总反应方程式为2C02=2C0+02。下列说法正确的是
A.由图分析N电极为正极
B.OH-通过离子交换膜迁向左室
C.阴极的电极反应为CO2+H2O+2e-=CO+2OH
D.反应完毕,该装置中电解质溶液的碱性增强
13.25℃时,用0.10mol·L-1的氨水滴定10.00mL0.05 mol·L-1H2A溶液,加入氨水的体积(V)与溶液中的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
A. A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为l.OxlO-6 mol·L-1
D.C 点溶液中 c(NH4+)> c(A2-)> c(OH-)> c(H+)
26.(14分)亚硝酰氯(NOC1,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水反应生成一种氯化 物和两种氮化物,可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
①仪器M的名称为 .
②制备NO发生装置可以选用 (填写字母代号),请写出发生反应的离子方程式: .
③欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a-> (按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOC1,装置如下图所示。操作为:检验装置气密性并装入药品,打开K2,然后再打开K3通入一段时间气体Cl2,然后进行其他操作,当Z有一定量液体生成时, 停止实验。
①实验室也可用X装置制备NO,相对甲组同学的气体发生装置,X装置的优点为 .
②若无装置Y,则Z中NOC1可能发生反应的化学方程式为 .
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用 cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是 ;亚硝酰氯(N0C1)的质量分数为 (用代数式表示)。
[已知:Ag2Cr04为砖红色固体;Ksp(AgCl)= 1.56x10-10, Ksp(Ag2CrO4)=lxl012]
27.(13分)碲(Te)具有两性特征,铜阳极泥是提取碲的主要原料,碲在铜阳极泥中主要以MezTeCMe表 示金属Cu、Pb、Au、Ag等)的形式存在。
(1)利用“氯化浸出-还原法”制备Te的工艺流程如下所示。
①浸出液的主要成分为CuSO4、HAuCu、H2Te03,则浸出渣的主要成分 为 (填化学式);“浸出”过程中有少量污染性气体生成,该气体是 (填物质名称)
②已知HAuCU是一种强酸,则“一级还原”过程中发生反应的离子方程式为 。
③欲得到64g碲,则“二级还原”过程中至少需通入 mol S02。
“氧化碱浸-电解法”指的是在氧化剂的作用下,Cu2Te与NaOH溶液反应生成Na2Te03和Cu(OH)2,经电解即可获得Te。
①以空气为氧化剂进行“氧化碱浸”的化学方程式为 。
②电解过程中,阴极的电极反应式为 。
③与“氯化浸出-还原法”相比“氧化碱浸-电解法”的优点是 (任写一点)
28.(16分)S02的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理S02。
(1)在复合组分催化剂作用下,CH4可使S02转化为S,同时生成C02和液态H20。
已知:CH4(g)+202(g) = C02(g)+2H2O(l) =-890.3 kJ/mol
S(s)+02(g) = S02(g) AH=-291.2 kJ/mol
则CH4和SO2反应的热化学方程式为 。
(2)在恒容密闭容器中,用H2还原S02生成S的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
①分析可知X为 (填化学式),0〜h时间段的温度为 .
②用H2还原S02生成S的总反应的化学方程式为 .
(3)焦炭催化还原S02生成S2,化学方程式为2C(s)+2S02(g)= S2(g)+2C02(g)。在恒容密闭容器中,1 mol/LS02与足量的焦炭反应,S02的转化率随温度的变化如图3所示。
①该反应的△H (填“ > ”或“<”)0。
②计算a点的平衡常数为 .
(4)工业上用Na2S03溶液处理硫酸厂的废气S02得NaHS03溶液。
①某温度下,用1.0mol/LNa2SO3溶液吸收纯净的S02,当溶液pH降至5时,吸收能力显著下降,应更换吸收剂。此时溶液中 。(已知该温度下H2S03的电离平衡常数:
Ka1=1.50x10-2,Ka2=1.25xl0-6)
②用惰性电极电解NaHS03废水可使吸收液再生,原理如下图所示,M和N为离子交换膜。阳极的电极反应式为: 。
35.【化学——物质结构与性质】(15分)
离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的 EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
碳原子价层电子的轨道表达式为 ;基态碳原子中,核外电子占据的最高能级的电子云轮廓图为 形。
(2)根据价层电子对互斥理论,NH3、N03-、N02-中,中心原子价层电子对数不同于其他两种粒子的是 。NH3比PH3的沸点高,原因是 .
(3)氮元素的第一电离能比同周期相邻元素都大的原因是 。
(4)己知分子中的大键可用符号表示,其中n代表参与形成大键的原子数,m代表参与形成大键的电子数(如苯分子中的大键可表示为)。EMIM+离子中的五元环跟苯分子相似为平面结构,则EMIM+ 离子中碳原子杂化方式有: ,其中的大键应表示为 .
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于晶体,其中硼原子的配位数为 。已知:立方氮化硼密度为dg/cm3, B原子半径为xpm,N原子半径为xpm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为 (列
出化简后的计算式)。
36.【化学——有机化学基础】(15分)略
参考答案及评分标准化学部分
7~13 B C D C B C B
26.(14分)(1)①锥形瓶(1分)
②B(1分) 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O(2分)
③f→g→c→ b→d→e→i→h(2分)
(2)①排除装置内空气的干扰,制得的NO更纯净(2分)
②2NOCl+H2O=2HCl+NO↑+NO2↑(2分)
(3)当滴入最后一滴AgNO3标准溶液,溶液中有砖红色沉淀产生,且30s不消失。(2分)(2分)
27.(13分)(1)①PbSO4和AgCl (2分) 氯气(2分)
②[AuCl4]- + 3Fe2+ = 3Fe3+ + Au + 4Cl-(2分) ③1 (1分)
(2)①Cu2Te + 2O2 + 2NaOH + H2O = Na2TeO3 + 2Cu(OH)2(2分)
②TeO32- + 4e- + 3H2O = Te + 6OH-(2分)
③不生成氯气等污染性气体(或工艺简单)(2分)
28.(16分)(1)CH4(g)+2SO2(g) = CO2(g)+2S(s)+2H2O(l) ΔH=-295.9kJ/mol (2分)
(2)①H2S(2分) 300℃(2分)②2H2+SO2S+2H2O(2分)
(3)①<(2分)②36.45(2分)
(4)①1/8(2分)②HSO3- - 2e- + H2O = SO42- + 3H+ (2分)
35.(15分)(1)(2分) 哑铃(1分)
(2)NH3(1分) NH3间存在氢键,分子间作用力大于PH3(2分)
(3)基态氮原子电子占据的最高能级为半充满,较稳定(2分)
(4) sp2、sp3(2分)(1分)
(5)原子(1分) 4(1分)×100%(2分)