- 2021-05-14 发布 |
- 37.5 KB |
- 11页
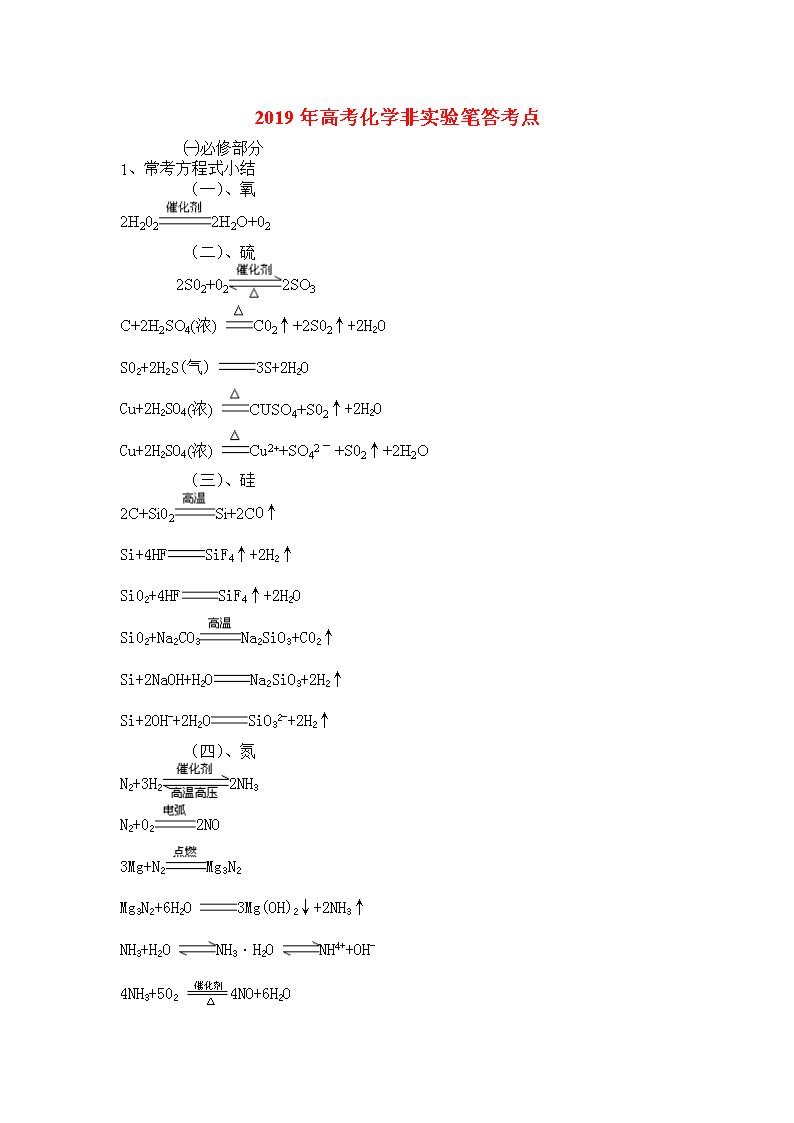


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学非实验笔答考点
2019年高考化学非实验笔答考点 ㈠必修部分 1、常考方程式小结 (一)、氧 2H2022H2O+02 (二)、硫 2S02+022SO3 C+2H2SO4(浓) C02↑+2S02↑+2H2O S02+2H2S(气) 3S+2H2O Cu+2H2SO4(浓) CUSO4+S02↑+2H2O Cu+2H2SO4(浓) Cu2++SO42ˉ+S02↑+2H2O (三)、硅 2C+Si02Si+2CO↑ Si+4HFSiF4↑+2H2↑ Si02+4HFSiF4↑+2H2O Si02+Na2CO3Na2SiO3+C02↑ Si+2NaOH+H2ONa2SiO3+2H2↑ Si+2OH-+2H2OSiO32-+2H2↑ (四)、氮 N2+3H22NH3 N2+022NO 3Mg+N2Mg3N2 Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑ NH3+H2O NH3·H2O NH4++OH- 4NH3+502 4NO+6H2O 4NH3+3O22N2+6H2O 2NH4Cl(S)+Ca(OH)2(S) CaCl2+2NH3↑+2H2O NH4HCO3 NH3↑+C02↑+H2O NH4++OH-(浓) NH3↑+H2O NH4++OH-(稀) NH3·H2O NH3·H2O(浓)+CaO=Ca(OH)2+H2O 3N02+H2O 2HNO3+NO Cu+4HNO3(浓) Cu(NO3)2+2N02↑+2H2O Cu+4H++2NOCu2++2N02↑+2H2O 3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O 3Cu+8H++2NO3-3Cu2++2NO↑+4H2O C+4HNO3(浓) C02↑+4N02↑+2H2O (五)、氯 2Fe+3Cl22FeCl3 Cu+Cl2CuCl2 H2+Cl22HCl Cl2+H2O HCl+HClO Cl2+H2O H++Cl-+HClO Cl2+2NaOH NaCl+NaClO+H2O Cl2+2OH-Cl-+ClO-+H2O 3Cl2+6NaOH 5NaCl+NaClO3+3H2O 3Cl2+6OH -5Cl-+ClO3-+3H2O 2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O Cl2+2OH-Cl-+ClO-+H2O Mn02+4HCl(浓) MnCl2+Cl2↑+2H2O Mn02+4H++2Cl- Mn2++Cl2↑+2H2O 2NaCl+2H2O 2NaOH+H2↑+Cl2↑ 2Cl-+2H2O 2OH-+H2↑+Cl2↑ (六)、氟 2F2+2H2O4HF+02 (七)、铝 2Al+2NaOH+2H2O2NaAl02+3H2↑ 实质:2Al+6H2O2Al(OH)3+3H2(氧化还原) 铝将电子转移给水,铝作还原剂,水作氧化剂 Al(OH)3+NaOH NaAl02+2H2O(非氧化还原) 8Al+3Fe3O4 4Al2O3+9Fe Al2O3+6HCl 2AlCl3+3H2O Al2O3+6H+ 2Al3++3H2O Al2O3+2NaOH 2 NaAl02+H2O Al2O3+2OH- 2 Al02-+H2O Al02-+H++H2O Al(OH)3 3 OH-+Al3+ NaAl02+C02+H2O Al(OH)3↓+NaHCO3 Al02-+C02+H2O Al(OH)3↓+HCO3- Al(OH)3+ NaOH NaAl02+2H2O Al(OH)3+ OH - Al02-+2H2O AlCl3+3 NH3·H2O Al(OH)3↓+ 3NH4Cl Al3++3 NH3·H2O Al(OH)3↓+ 3NH4+ AlCl3+ 3NaAl02+ 6H2O 4Al(OH)3↓+3 NaCl Al3++ 3Al02-+ 6H2O === 4Al(OH)3↓ (八)、镁 Mg+C02 2MgO+C (九)、铁 2Fe+3Cl2 2FeCl3 Fe+4HNO3(稀,过量) Fe(NO3)3+NO↑+2H2O Fe+4H++NO3-(稀,过量) Fe3++NO↑+2H2O 如果铁过量,继续反应 2Fe3++Fe 3Fe2+ 3Fe+4H2O(g) Fe3O4+H2 Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+ Fe2++2Fe3++4H2O 4Fe(OH)2+02+2H2O 4Fe(OH)3 先生成白色沉淀,迅速变为灰绿色,最终变为红褐色。 2FeCl3+Cu 2FeCl2+CuCl2 2Fe3++Cu 2Fe2++Cu2+ 2Fe3++2I-I2+2Fe2+ 4Fe+02+4H+4Fe3++2H2O (十)、铜 3CuO+2NH33Cu+N2+H2O 2Cu+SCu2S CuSO4+H2SCuS↓+H2SO4 Cu2O+H2SO4Cu+ CuSO4+H2O Cu2O+2H+Cu+ Cu2++H2O Cu2++H2S CuS↓+2H+ 2Cu+O2+CO2+H2O=Cu2(OH)2CO3(绿色) (十一)、钠 2Na+02 Na202(周期表中ⅠA、ⅡA、ⅢB、ⅣB族元素以及某些过渡元素(如铜、银、汞)能形成金属过氧化物。) 2Na+2H2O2NaOH+H2↑ 2Na+2H2O2Na++2OH-+H2↑ 2Na+ CuSO4+2H2OCu(OH)2↓+H2↑+Na2SO4 2Na+ Cu2++2H2OCu(OH)2↓+H2↑+2Na+ 2NaCl(熔融) 2Na+Cl2↑ 2Na202+2H2O4 NaOH+02↑ e- 本质:2Na202+4H2O4 NaOH+2H202(复分解) 2H2022H2O+02↑ 2Na202+2H2O4Na++4OH-+02 2Na202+2C022Na2CO3+02 Na2CO3+C02+H2O 2NaHCO3 2NaHCO3 Na2CO3+C02↑+H2O 2、颜色小结 氢气在氯气中燃烧 苍白色火焰 焰色反应 钠元素 黄色 钾元素 紫色(必须透过蓝色钴玻璃) 氢氧化铁 红褐色 黑色物质 碳,硫化亚铁,氧化铜,二氧化锰,硫化铜,四氧化三铁,氧化亚铁,硫化铅,硫化银 红色物质 铜,[ FeSCN]2+血红色 红棕色 三氧化二铁,二氧化氮,红磷,溴蒸汽(液体深红棕色) 紫色 高锰酸钾,三价铁离子遇苯酚 黄绿色 氯气 紫黑色 碘单质 绿色 硫酸亚铁,氯化亚铁, 浅黄绿色 氟气 蓝色 氢氧化铜,胆钒(蓝钒) 黄色 碘化银,硫,过氧化钠(淡黄),溴化银(浅黄色)氯化铜和氯化铁晶体 白色沉淀 氢氧化亚铁 ,氢氧化铝,氢氧化镁,硅酸 3、盐析和聚沉的区别 聚沉 盐析 本质 破坏胶体微粒间的排斥力 降低溶质的溶解度 对象 憎水胶体 可溶于水高分子溶液(属于胶体) 例子 氢氧化铁胶体 蛋白质胶体、肥皂水 可逆性 不可逆 可逆 4、电解质、非电解质判断 电解质:酸、碱、盐、金属氧化物、水 非电解质:非金属氧化物、氨气、不是酸碱盐的有机物或非电解质的化合物 5、强电解质:强酸、强碱、绝大数盐(醋酸铅除外),金属氧化物 弱电解质:弱酸、弱碱、水 6、电离方程式 强电解质用“=”号 弱电解质用“ ” 特殊:NaHCO3=Na++HCO3-HCO3-H++CO32- 水解方程式 单水解如:CO32-+H2OHCO3-+OH- 难溶电解质的溶解平衡方程式:CaCO3(S)Ca2+(aq)+CO32-(aq) 热化学方程式:H2(g) + Cl 2(g) = 2HCl(g) △H = -183 kJ/mol 注:1、标状态2、△H的正负号和单位3、不标反应条件4、中和热、燃烧热在文字叙述时只说数值不带负号 7、离子方程式书写 A、六不拆:沉淀、气体、单质、氧化物、水、弱酸弱碱 B、检查正误的三方法:原子守恒、电荷守恒、电子守恒 C、离子方程式的书写步骤 a、写四剂并配平 氧化剂+还原剂→氧化产物+还原产物 b 、由电荷守恒添氢离子(酸性溶液)或氢氧根离子(碱性溶液) c、由原子守恒添上水分子 8、氧化还原方程式考点 A、四剂判断:氧化剂、还原剂、氧化产物、还原产物 B、电子转移数的计算:用氧化剂或还原剂算均可 C、配平 9、导电本质 A、金属:自由电子定向移动导电,物理变化 B、熔融的离子化合物或离子化合物水溶液导电,通过阴阳离子定向移动,均为化学变化 10、 金属性强弱判断法:从水中置换出氢气的难易程度;最高价氧化物对应水化物碱性强弱 非金属性强弱判断法:气态氢化物的稳定性;最高价氧化物对应水化物酸性强弱 11、各类漂白剂的比较 类型 实例 对象 本质 原理 可逆性 氧化型 次氯酸、 有机物 化学变化 强氧化性 不可逆 双氧水、臭氧 加合型 二氧化硫 品红溶液 化学变化 普通化合反应 可逆 吸附型 活性炭 有色溶液 物理变化 吸附性 可逆 或有色气体 12、钝化 铁或铝在常温下遇到浓硫酸,表面金属被氧化为氧化膜,内部金属不再被腐蚀。本质为化学变化 13、常见气体实验室制法总结 1.氢气 (1)工业制法: ①水煤气法:(高温条件下还原水蒸气) 单质+化合物化合物+单质: C+H2O(g)CO+H2 ; 化合物+化合物化合物+单质:CO+ H2O(g) CO2+H2 ②氯碱工业的副产物:(电解饱和食盐水) 溶液A+B+C : 2NaCl+2H2O 2NaOH +H2↑+ Cl2↑, (2)实验室制法: ①金属与非氧化性强酸的置换反应: 单质+化合物化合物+单质:Zn+H2SO4=ZnSO4+H2↑ ②金属与强碱溶液的置换反应: 单质+化合物化合物+单质:2Al+2NaOH+2H2O=2NaAlO2+3H2↑, 2.乙烯 (1)工业制法: 石油裂解制乙烯:高碳烷烃低碳烷烃+低碳烯烃: C4H10C2H6+C2H4 ;C8H18C6H14+C2H4 (2)实验室制法: 140℃ 乙醇的消去反应:CH3CH2OH 浓硫酸 CH2=CH2 ↑+H2O 3.乙炔 (1)工业制法: 煤干馏得到焦炭,煅烧石灰石得到生石灰,在高温电弧炉中生石灰和焦炭反应生成电石和一氧化碳,电石和饱和食盐水反应生成熟石灰和乙炔。 3C+CaO==CaC2+CO↑ ;CaC2+2H2OCa(OH)2+C2H2 ↑ (2)实验室制法:电石水解法:CaC2+2H2OCa(OH)2+C2H2 ↑ 4.一氧化碳 (1)工业制法: ①水煤气法:(高温条件下还原水蒸气) 单质+化合物化合物+单质: C+H2O(g) CO+H2 ; ②焦炭还原二氧化硅(工业制备粗硅的副产物):2C+SiO2Si+2CO↑ ③工业制备电石的副产物:3C+CaO CaC2+CO↑ ; (2)实验室制法: ①草酸分解法:H2C2O4 CO↑ +CO2 ↑+H2O ;混合气体通过碱石灰得到一氧化碳。 ②甲酸分解法:HCOOH CO↑ +H2O 5.二氧化碳 (1)工业制法: ①高温分解,煅烧大理石:CaCO3CaO+CO2 ↑ ②玻璃工业副产物:SiO2+Na2CO3Na2SiO3+CO2 ↑;SiO2+CaCO3CaSiO3+CO2 ↑ ③联碱工业小苏打制纯碱的副产物:2NaHCO3Na2CO3+H2O+CO2 ↑ (2)实验室制法: 复分解反应:碳酸钙与盐酸的反应:CaCO3+2HCl=CaCl2+H2O+CO2↑ 6.氨气 (1)工业制法 化合反应:合成氨工业N2+3H2 2NH3 (2)实验室制法 ①氯化铵和消石灰混合受热分解制备氨气: 2NH4Cl+Ca(OH)22CaCl2+2NH3 ↑+2H2O ②浓氨水滴入到生石灰(烧碱或碱石灰)表面快速产生氨 NH3.H2O+CaO== Ca(OH)2+NH3↑ 7.一氧化氮 (1)工业制法 ①氨气催化氧化制备一氧化氮(硝酸工业的第一步反应):4NH3+5O24NO+6H2O ②二氧化氮溶于水制硝酸的副产物:3NO2+H2O=2HNO3+NO (2)实验室制法 铜和稀硝酸反应制备一氧化氮:3Cu+8 HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 8.二氧化氮 (1)工业制法 一氧化氮氧化制二氧化氮:(硝酸工业的第二步反应):2NO+O2=2NO2 (2)实验室制法 铜和浓硝酸反应制备二氧化氮:Cu+4 HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 9.氧气 (1)工业制法: ①分离液态空气 ②电解氧化铝得到副产物氧气:2Al2O34Al+3O2 ↑ ③冶炼金属汞、银时得到副产物氧气:2HgO2Hg+O2↑;2Ag2O4Ag+O2↑ (2)实验室制法 ①高锰酸钾受热分解:2KMnO4K2MnO4+MnO2+O2↑ ②双氧水催化分解:2H2O22H2O+O2↑ 10.二氧化硫 (1)工业制法 ①高温煅烧硫铁矿得到二氧化硫:4FeS2+11O22Fe2O3+8SO2 ②火法炼铜得到副产物二氧化硫:Cu2S+O22Cu+SO2 ③燃烧硫磺得到二氧化硫:S+O2SO2 (2)实验室制法 ①在加热条件下铜还原浓硫酸:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②亚硫酸钠和硫酸发生复分解反应:Na2SO3+ H2SO4=Na2SO4+H2O+SO2 ↑ 11.氯气 (1)工业制法 ①电解饱和食盐水得到烧碱、氢气和氯气:2NaCl+2H2O2NaOH +H2↑+ Cl2↑ ②冶炼钠时得到钠和氯气:2NaCl(熔融)2Na + Cl2↑ ③冶炼镁时得到镁和氯气:MgCl2Mg + Cl2↑ (2)实验室制法 ①常温氧化浓盐酸:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O ②加热氧化浓盐酸:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 12.氯化氢 (1)工业制法 氢气在氯气中燃烧产生氯化氢:H2+Cl22HCl (2)实验室制法 ①复分解反应制备氯化氢气体:2NaCl+H2SO4(浓) Na2SO4+2HCl ↑ ②浓硫酸滴入到浓盐酸中快速制备氯化氢气体。 14、化学反应的本质 旧化学键的断裂和新化学键的生成 15、离子化合物、共价化合物区别 离子化合物 共价化合物 含金属元素的化合物 非离子化合物 氯化铝和氯化铍除外 即共价化合物 和铵盐 熔化时有离子可导电 熔化时无离子不导电 16、化学键与物质关系 A、不含化学键的物质 稀有气体 B、离子化合物 一定含离子键,可能含共价键(极性或非极性) 共价化合物 不含离子键,只含共价键 非金属单质 只含共价键(稀有气体除外) 金属单质 只含金属键 C、含有离子键的物质,一定为离子化合物 含共价键的物质,可能为离子化合物,可能为共价化合物,可能为非金属单质 只含共价键的物质,可能为共价化合物,可能为非金属单质 含金属件的物质,只可能为金属单质 17、吸热与放热反应的判断 放热反应占绝大数,吸热反应很少;记住吸热反应:大多数分解反应,氢氧化钡晶体和氯化铵,碳和水的反应,碳和二氧化碳的反应。 18、盖斯定律应用 用若干个热化学方程式推导某未知热化学方程式 理解关键:加水还是减谁的问题;系数的调整 19、铝热反应 A、方程式 8Al+3Fe3O4 4Al2O3+9Fe B、范围 Fe、V、Cr、Mn C、应用 冶炼金属、焊接钢轨 21、无极含氧酸酸性规律 A、不同元素最高价含氧酸酸性强弱 中心元素非金属性越强,酸性越强 B、同一元素不同价态含氧酸 价态越高酸性越强 C、强酸制弱酸的规律(氢硫酸与硫酸铜溶液的反应特殊) 22、侯氏制碱法 A、两个反应 ①NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3(加热)=Na2CO3+H2O+CO2↑ B、顺序 先通氨气后通二氧化碳 23、酸性氧化物、碱性氧化物定义 酸性氧化物:与碱反应只生成盐和水 碱性氧化物:与酸反应只生成盐查看更多