- 2021-05-14 发布 |
- 37.5 KB |
- 16页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学高考题和高考模拟题分项版汇编专题10水溶液中的离子平衡
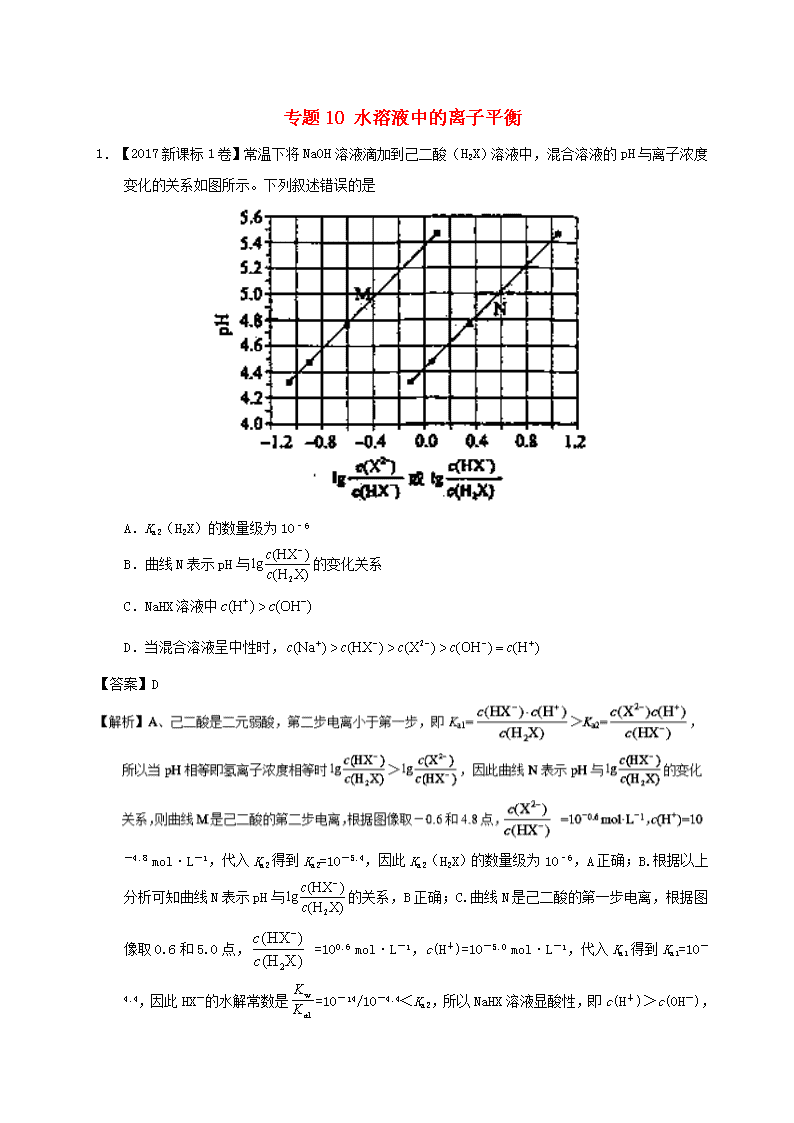
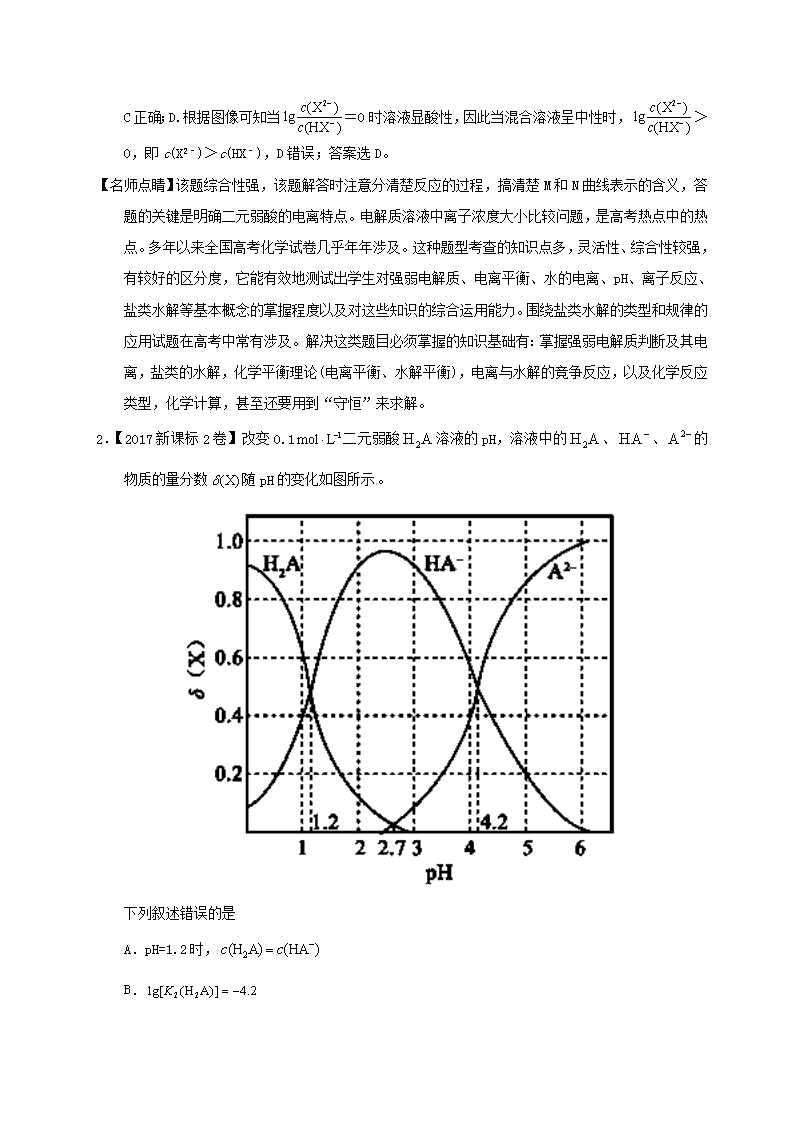
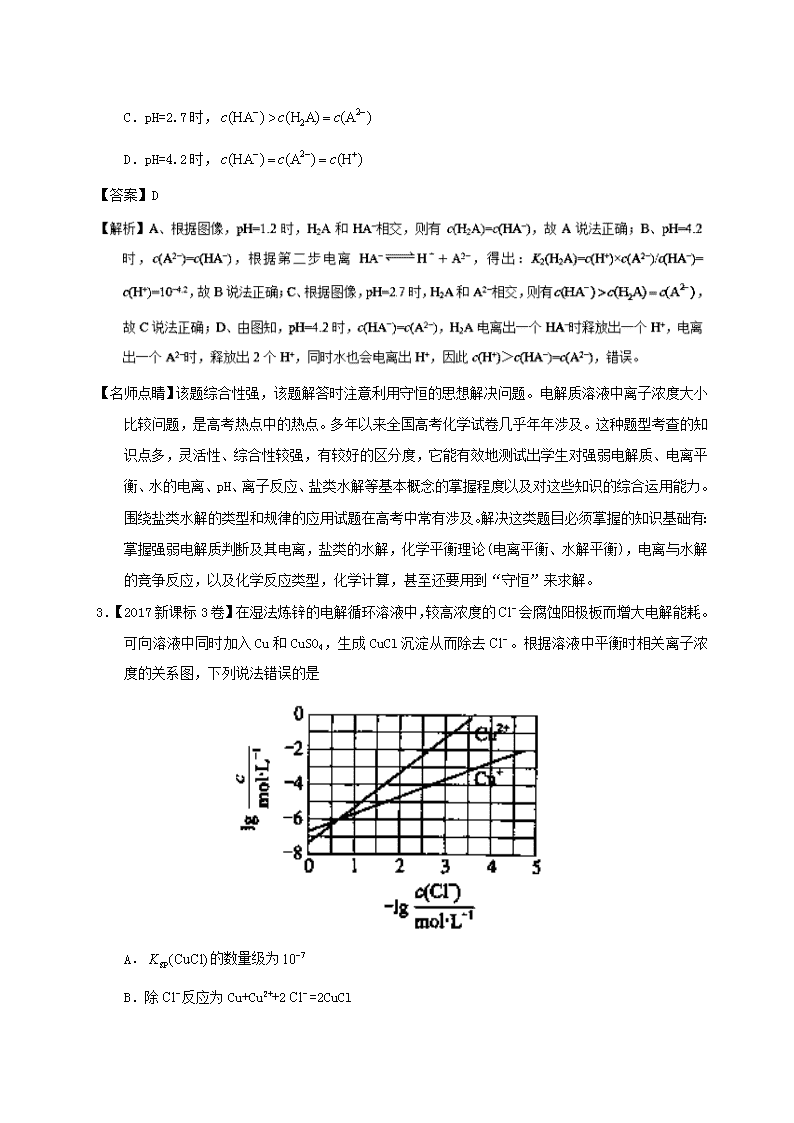
专题10 水溶液中的离子平衡 1.【2017新课标1卷】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 A.Ka2(H2X)的数量级为10–6 B.曲线N表示pH与的变化关系 C.NaHX溶液中 D.当混合溶液呈中性时, 【答案】D -4.8 mol·L-1,代入Ka2得到Ka2=10-5.4,因此Ka2(H2X)的数量级为10–6,A正确;B.根据以上分析可知曲线N表示pH与的关系,B正确;C. 曲线N是己二酸的第一步电离,根据图像取0.6和5.0点, =100.6 mol·L-1,c(H+)=10-5.0 mol·L-1,代入Ka1得到Ka1=10-4.4,因此HX-的水解常数是=10-14/10-4.4<Ka2,所以NaHX溶液显酸性,即c(H+)>c(OH- ),C正确;D.根据图像可知当=0时溶液显酸性,因此当混合溶液呈中性时,>0,即c(X2–)>c(HX–),D错误;答案选D。 【名师点睛】该题综合性强,该题解答时注意分清楚反应的过程,搞清楚M和N曲线表示的含义,答题的关键是明确二元弱酸的电离特点。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。 2.【2017新课标2卷】改变0.1二元弱酸溶液的pH,溶液中的、、的物质的量分数随pH的变化如图所示。 下列叙述错误的是 A.pH=1.2时, B. C.pH=2.7时, D.pH=4.2时, 【答案】D 【名师点睛】该题综合性强,该题解答时注意利用守恒的思想解决问题。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。 3.【2017新课标3卷】在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A.的数量级为 B.除反应为Cu+Cu2++2=2CuCl C.加入Cu越多,Cu+浓度越高,除效果越好 D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全 【答案】C 【解析】A.Ksp(CuCl)=c(Cu+)·c(Cl-),在横坐标为1时,纵坐标大于-6,小于-5,所以Ksp(CuCl)的数量级是10-7,A正确;B.除去Cl-反应应该是Cu+Cu2++2Cl-=2CuCl,B正确;C.溶液中存在平衡:Cu++Cl-CuCl、2Cu+Cu2++Cu,加入纯固态物质Cu对平衡无影响,故C错误;D.在没有Cl-存在的情况下,反应2Cu+Cu2++Cu的平衡常数约为,平衡常数很大,反应趋于完全,D正确。答案选C。 【名师点睛】本题考查溶度积常数的计算及平衡的移动,难点是对溶液中平衡时相关离子浓度的关系图的理解,通过图示可以提取出Ksp(CuCl),2Cu+Cu2++Cu的平衡常数,并且要注意在化学平衡中纯物质对反应无影响。 4.【2017江苏卷】常温下,Ka(HCOOH)=1.77×10−4,Ka(CH3COOH)=1.75×10−5,Kb(NH3·H2O) =1.76×10−5,下列说法正确的是 A.浓度均为0.1 mol·L−1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者大于后者 B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 C.0.2 mol·L−1 HCOOH与0.1 mol·L−1 NaOH 等体积混合后的溶液中:c(HCOO−) + c(OH−) = c(HCOOH) + c(H+) D.0.2 mol·L−1 CH3COONa 与 0.1 mol·L−1盐酸等体积混合后的溶液中(pH<7):c(CH3COO−) > c(Cl− ) > c(CH3COOH) > c(H+) 【答案】AD 量浓度较大的是乙酸,等体积的两溶液中,乙酸的物质的量较大,用同浓度的氢氧化钠溶液中和这两种溶液,乙酸消耗的氢氧化钠溶液较多,B错误;C.两溶液等体积混合后得到甲酸和甲酸钠的混合液,由电荷守恒得c(H+)+c(Na+)=c(OH−)+c(HCOO−),由物料守恒得2c(Na+)=c(HCOOH)+c(HCOO−),联立两式可得2c(H+)+c(HCOOH)=2c(OH−)+c(HCOO−),C错误;D.两溶液等体积混合后,得到物质的量浓度相同的乙酸、乙酸钠和氯化钠的混合液,由于溶液pH<7,所以溶液中乙酸的电离程度大于乙酸根的水解程度,氯离子不水解,乙酸的电离程度很小,所以c(CH3COO−)>c(Cl−)>c(CH3COOH)>c(H+),D正确。 【名师点睛】本题以3种弱电解质及其盐的电离、反应为载体,考查了酸碱中和滴定和溶液中离子浓度的大小比较。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。高考试题常围绕盐类水解的类型和规律的应用出题。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,弱电解质的电离平衡常数的意义及其重要应用,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,要用到三个“守恒”(物料守恒、电荷守恒、质子守恒)来求解。很多大小关系要巧妙运用守恒关系才能判断其是否成立。 5.【河南省2017届诊断卷(A)】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 A. 该温度下,Ksp(MnS)大于1.0×10-35 B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀 C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出 D. 该温度下,溶解度:CuS>MnS>FeS>ZnS 【答案】D 粉末后c(Fe2+)×c(S2-)大于10-20,所以有FeS沉淀析出,C正确;D、依据此图可知,CuS的Ksp最小,其次是MnS、FeS和ZnS,所以该温度下,溶解度:CuS<MnS<FeS<ZnS,D错误,答案选D。 6.【湖南省2017年冲刺预测卷】20mL 0.1000 mol•L-1氨水用0.1000 mol•L-1的盐酸滴定,滴定曲线入右下图,下列说法正确的是 A. 该中和滴定适宜用酚酞作指示剂 B. 两者恰好中和时,溶液的pH=7 C. 达到滴定终点时,溶液中:c(H+)= c(OH-)+ c(NH3·H2O) D. 当滴入盐酸达30mL时,溶液中c(NH4+)+c(H+)-)+c(Cl-) 【答案】C 7.【武昌区2017届5月调研】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是 A. I表示的是滴定醋酸的曲线 B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 【答案】C 【解析】A. 0.100mol·L-1的HCl溶液和醋酸溶液,醋酸难电离,所以起点pH较小 的I表示的是滴定盐酸的曲线,故A错误;B. 当醋酸与氢氧化钠恰好完全反应时,形成醋酸钠溶液,醋酸钠水解使溶液pH>7,所以pH =7时,滴定醋酸消耗的V(NaOH)<20.00mL,故B错误;C. V(NaOH)= 20.00mL时,酸碱恰好完全反应,因为CH3COO-水解而消耗,所以两份溶液中c(Cl-)>c(CH3COO-),故C正确;D. V(NaOH)=10.00mL时,生成的醋酸钠与剩余醋酸浓度相等,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误。故选C。 点睛:等物质的量浓度的醋酸与醋酸钠的混合溶液,醋酸的电离程度大于醋酸钠的水解程度。 8.【徐州市2017届考前模拟冲刺打靶卷】20℃时,向20 mL 0.1 mol·L-1的Na2CO3溶液中逐滴加入0.1 mol·L-1盐酸(忽略H2CO3的分解和CO2的挥发),溶液pH随盐酸加入的体积变化曲线如图。下列说法正确的是 A. 点①所示溶液中:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) B. 点②所示溶液中:c(CO32-)>c(Cl-)>c(HCO3-)>c(OH-) C. 点③所示溶液中:c(OH-)﹣c(H+)=c(H2CO3)﹣c(CO32-) D. 点④所示溶液中:c(Cl-)=2c(H2CO3) + c(HCO3-) 【答案】CD 9.【虎林市2017届摸底考试(最后冲刺)】下列说法正确的是 A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-) C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-l D. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小 【答案】D C错误;D.溶液中=×=,常温下向10 mL0.1 mol•L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,反应生成醋酸氨,溶液中氢离子浓度减小,氢氧根离子浓度增大,Kb不变,则比值减小,故D正确;故选D。 10.【淄博市2017届仿真模拟(打靶卷)】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。下列说法不正确的是 A. A、B、C三点所表示的溶液中水的电离程度依次增大 B. 加入1 mol NaOH后,溶液中c(Na+)=c(R-) C. 通入HCl, R-的水解程度增大,HR的电离常数减小 D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR) 【答案】C 【解析】A、A点H+浓度最大,对水的电离程度抑制作用最强,C点pH=7,对水的电离程度无抑制作用,所以A、B、C三点所表示的溶液中水的电离程度依次增大,选项A正确;B、根据图像,加入1 mol NaOH后,溶液的pH=7,则c(H+)=c(OH‾),根据电荷守恒可得c(H+)+c(Na+)=c(OH‾)+c(R-),所以c(Na+)=c(R-),选项B正确;C、B、温度不变,HR的电离常数不变,选项C不正确;D、未加HCl和NaOH时,溶质为HR和NaR,有图像可知pH<7,溶液显酸性,HR的电离程度大于NaR的水解程度,所以c(R-)>c(Na+)>c(HR),选项D正确。答案选C。 点睛:本题考查了据图分析数据进行电离平衡常数的计算、电离程度与水解程度大小判断以及电荷守恒的应用。 11.【东台市2017届5月模拟】下列装置图或曲线图与对应的叙述相符的是 A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+ C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+) D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右 【答案】C 钠,溶液呈中性,溶液中存在电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(H+)=c(OH-),则c(CH3COO-)=c(Na+),得到当pH=7时:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故C正确;D.分析图象可知铁离子完全沉淀的pH为3.7,加入氧化铜会调节溶液pH,到pH=5.5时铜离子会沉淀,应调节溶液pH小于5.5,故D错误;故选C。 点睛:溶液中离子浓度大小比较,应从溶液的酸碱性及溶液中各微粒之间守恒关系考虑,最常见的守恒为电荷守恒和物料守恒,如0.1molNaHCO3溶液,因(HCO3-的水解大于其电离,溶液显碱性,同时溶液中除溶剂水外,还存在着Na+、H+、HCO3-、CO32-、OH-及H2CO3,其中电荷守恒式为c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),物料守恒式为c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-),至于其它等式关系可以通过电荷守恒和物料守恒利用等量替换得到。 12.【沈阳市2017届第三次模拟】常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如下,则下列说法不正确的是 A. 溶液的pH比较:x>y>z B. 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 D. 该温度下,CH3COONa的Ka=10-4.75 【答案】B 13.【潍坊市2017届第三次模拟】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是 A. HZ是强酸,HX、HY是弱酸 B. 根据滴定曲线,可得Ka(HY)≈10-5 C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-) 【答案】C 14.【石家庄市2017届冲刺模考】25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol • L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是 A. a=0.10 B. N、P两点溶液中水的电离程度:N C. M、N两点溶液中NH4+的物质的量之比大于1:2 D. Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O) 【答案】B 【解析】A. 加入10mL氨水时溶液显酸性,溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O),这说明二者恰好反应生成氯化铵,铵根水解,溶液显酸性,因此a=0.10,A正确;B. N点铵根水解,P点氨水过量,所以溶液中水的电离程度:N>P,B错误;C. M点盐酸过量,抑制铵根水解,则M、N两点溶液中NH4+的物质的量之比大于1:2,C正确;D. Q 点溶液是等浓度的氯化铵和氨水的混合溶液,根据电荷守恒c(OH-)+c(Cl-)=c(NH4+)+c(H+)和物料守恒2c(Cl-)=c(NH4+)+c(NH3·H2O)可知溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O),D正确,答案选B。 点睛:在判断溶液中微粒浓度大小的比较时,要重点从三个守恒关系出发分析思考。①电荷守恒:电荷守恒是指溶液必须保持电中性,即溶液中所有阳离子的电荷总浓度等于所有阴离子的电荷总浓度。例如,NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)。②物料守恒:物料守恒也就是原子守恒,变化前后某种元素的原子个数守恒。例如,0.1 mol·L-1 NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1。③质子守恒:由水电离出的c(H+)等于由水电离出的c(OH-),在碱性盐溶液中OH-守恒,在酸性盐溶液中H+守恒。例如,纯碱溶液中c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。质子守恒的关系式也可以由电荷守恒式与物料守恒式推导得到。解答本题时,能依据N点物料守恒得出a值是解题的关键。 15.【汕头市2017届第三次模拟】常温下,向20ml0.1mol/L氨水溶液中滴加盐酸,溶液中水电离的氢离子浓度随加入盐酸体积变化如图所示。则下列说法正确的是 A. b、d两点为恰好完全反应点 B. c点溶液中c(NH4+) =c(Cl-) C. a、b之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) D. 常温下,0.1mol/L氨水的电离常数K约为1×10-5mol/L 【答案】D 荷守恒得c(Cl-)<c(NH4+),故C错误;常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)= mol/L=0.001mol/L,Ka=mol/L=1×10-5mol/L,故D正确。 16.【宁德市2017届第三次质量检查】向0. 10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f与混合液pH的关系如图所示。下列说法正确的是 A. f=0时,溶液中:c(Na+)=2c(CO32-) B. f=0.5时,溶液中:c(HCO3-)>c(CO32-) C. f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-) D. f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3) 【答案】B 17.【衡阳市2017年十校高考调研冲刺预测卷(五)】如图是Ca(OH)2在温度分别为T1、T2时的沉淀溶解平衡曲线[图中浓度单位为mol·L-1,温度为T1时Ca(OH)2的Ksp = 4×10-6, ≈1.6]。下列说法正确的是 A. 温度: Tl查看更多