- 2021-05-14 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学冲刺卷01新课标Ⅱ卷
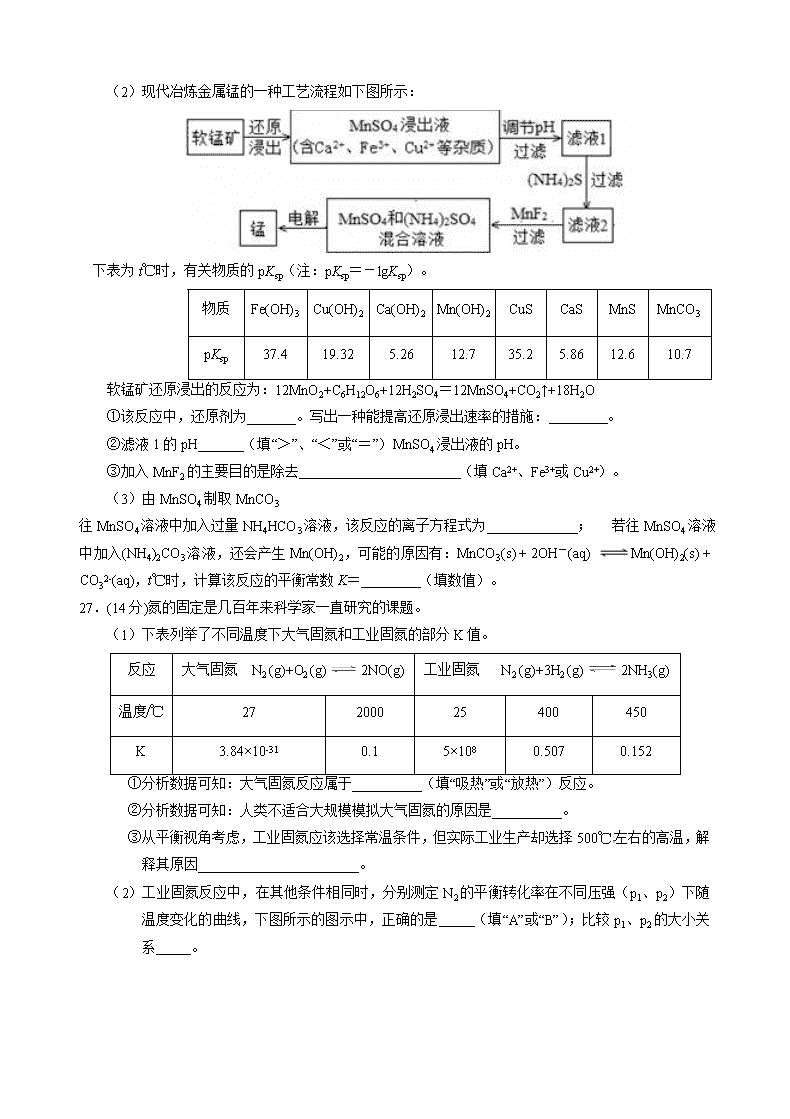
绝密★启用前 2016年高考冲刺卷(1)(新课标Ⅱ卷) 理科综合化学试题 考试范围:高考全部内容;考试时间:120分钟 注意事项: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分300分,考试时间150分钟。 2.答题前考生务必用0.5毫米黑色墨水签字笔填写好自己的姓名、班级、考号等信息 3.考试作答时,请将答案正确填写在答题卡上。第一卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;第Ⅱ卷请用直径0.5毫米的黑色墨水签字笔在答题卡上各题的答题区域内作答,超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。 4.以下数据可供解题时参考: 相对原子质量:H 1 Li 3 C 12 N 14 O 16 Al 27 P 31 S 32 Cl 35.5 Fe 56 Cu 64 Ba 137 第Ⅰ卷 (选择题 共42分) 一、选择题(共7小题。每小题仅一个选项符合题意。每小题6分,共42分) 7.下列说法正确的是( ) A.Mg、Al在空气中性质稳定,因而都具有很强的抗腐蚀性 B.质量数相等的不同核素,一定属于不同种元素 C.生石灰、铁粉、硅胶是食品包装中常用的干燥剂 D.自行车钢架生锈主要是化学腐蚀所致 8.分子式为C10H14的二取代芳烃,其可能的结构有( ) A.3种 B.6种 C.9种 D.10种 9.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( ) A.31d和33d属于同种核素 B.气态氢化物的稳定性:a>d>e C.工业上常用电解法制备单质b和c D.a和b形成的化合物不可能含共价键 10.设NA表示阿伏加德罗常数的值。下列叙述正确的是( ) A.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA B.常温常压下,28 g C2H4、CO的混合气体中含有碳原子的数目为1.5NA C.常温下,20L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA D.标准状况下,2.24 L Cl2与足量的NaOH溶液反应,转移的电子数目为0.2NA 11.根据下列有关实验得出的结论一定正确的是( ) 选项 方法 结论 A 实验室制氢气,向稀H2SO4中滴加少量 Cu(NO3)2溶液 可以加快制备氢气的 反应速率 B 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液, 则溶液变黄 氧化性:H2O2>Fe3+ C 相同温度下,等质量的大理石与 等体积、等浓度的盐酸反应 反应速率: 粉状大理石>块状大理石 D 吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行 则该反应的△S<0 12.纸电池是一种有广泛应用的“软电池”,右图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰。下列有关该纸电池说法不合理的是( ) A.Zn为负极,进行氧化反应 B.电池工作时,电子由MnO2流向Zn C.正极反应:MnO2+e-+H2O=MnO(OH)+OH- D.电池总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH) 13.室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如右图所示。下列有关说法不正确的是( ) A.该一元碱溶液浓度为0.100 0 mol·L-1 B.a、b、c点的水溶液导电性依次增强 C.室温下,MOH的电离常数Kb=1×10-5 D.b点:c(M+)+c(MOH)=c(Clˉ) 第II卷(非选择题 共58分) 二、非选择题(26、27、28题为必考试题,36、37、38题为选考试题,考生从3个试题中任选一个试题,若三个试题都做,以36题为标准进行评分.) (一)必考题 26.(14分)软锰矿(主要成分为MnO2)可用于制备锰及其化合物。 (1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。 (2)现代冶炼金属锰的一种工艺流程如下图所示: 下表为t℃时,有关物质的pKsp(注:pKsp=-lgKsp)。 物质 Fe(OH)3 Cu(OH)2 Ca(OH)2 Mn(OH)2 CuS CaS MnS MnCO3 pKsp 37.4 19.32 5.26 12.7 35.2 5.86 12.6 10.7 软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O ①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施: 。 ②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。 ③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)。 (3)由MnSO4制取MnCO3 往MnSO4溶液中加入过量NH4HCO3溶液,该反应的离子方程式为_____________; 若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。 27.(14分)氮的固定是几百年来科学家一直研究的课题。 (1)下表列举了不同温度下大气固氮和工业固氮的部分K值。 反应 大气固氮 N2 (g)+O2 (g)2NO(g) 工业固氮 N2 (g)+3H2 (g)2NH3(g) 温度/℃ 27 2000 25 400 450 K 3.84×10-31 0.1 5×108 0.507 0.152 ①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。 ②分析数据可知:人类不适合大规模模拟大气固氮的原因是__________。 ③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。 (2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是 (填“A”或“B”);比较р1、р2的大小关系_____。 (3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是 。 (4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)4NH3(g)+3O2(g),则其反应热ΔH=___________________。 已知:N2(g)+ 3H2(g)2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)2H2O(l) △H=-571.6kJ·mol-1 28.(15分)苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下: 草酸(H2C2O4)为易溶于水的固体。 某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下: 一、制备苯甲酸 在三颈瓶中加人2.7mL甲苯、100mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加入8.5g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。 二、分离提纯 在反应混合物中加入一定量草酸充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。 三、测定纯度 称取mg产品,配成100mL乙醇溶液,移取25.00mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。 请回答下列问题: (1)装置a的名称是____________,其作用为______________________。 (2)甲苯被高锰酸钾氧化的原理为: 请完成并配平该化学方程式。 (3)分离提纯过程中加人的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加入草酸的作用是_______,请用离子方程式表示反应原理________________________。 (4)产品减压过滤时用冷水洗涤的原因是________________________。 (5)选用下列__________操作,可以将粗产品进一步提纯。(选填字母) A、溶于水后过滤 B、溶于乙醇后蒸馏 C、用甲苯萃取后分液 D、升华 (6)测定纯度步骤中,滴定终点溶液的颜色变化是 。若m=1.200g,滴定时用去0.1200mol/L标准KOH溶液20.00mL,则所得产品中苯甲酸的质量分数为_______________。 (二)选考题 36.【化学——选修2化学与技术】(15分) 由Ca3(PO4)2 、SiO2 、焦炭等为原料生产硅胶(SiO2·nH2O)、磷、磷酸及CH3OH,下列工艺过程原料综合利用率高,废弃物少。 (1)上述反应中,属于置换反应的是 [选填:(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)、(Ⅴ)]。 (2)高温下进行的反应Ⅱ的化学方程式为: ;固体废弃物CaSiO3可用于 。 (3)反应Ⅲ需在隔绝氧气和无水条件下进行,其原因是 。 (4)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为 。 (5)指出(VI)这一环节在工业生产上的意义 。 (6)写出由P→H3PO4 有关反应式: ① 。 ② 。 37.【化学——选修3物质结构与性质】(15分) 铝及其化合物在工农业生产及日常生活中有重要用途,请完成下列问题。 (1)铝原子核外自旋方向相同的电子最多有 个,与铝同族的第四周期元素原子的价电子排布式为_________。 (2)LiAlH4是一种特殊的还原剂,可将羧基直接还原成醇:CH3COOHCH3CH2OH CH3COOH分子中σ键与π键个数之比 , 分子中键角1______键角2(填“>”、“=”或“<”)。 (3)工业上可用Al2O3、N2、C在高温下制备一种高温结构陶瓷,其晶胞如图(与金刚石相似)。 ①晶胞中N原子配位数为_______,该晶胞中含有______个Al原子。 ②该化合物的晶体类型为 ,若该晶胞密度为a g·cm-3,则该晶胞边长的表达式为____pm。 (4)AlCl3在183℃开始升华,溶于水、乙醚等,其二聚物的结构如图所示: 其中Al原子的杂化方式为________,在图中用“→”标出分子中的配位键。 38.【化学—选修5有机化学基础】(15分) 邻苯二甲酸二乙酯是一种重要的工业塑化剂,其合成路线很多,下图就是其中的一种合成方法: 已知以下信息: ①有机化合物A可用来催熟水果。 ②有机化合物C的核磁共振氢谱显示其有3种不同化学环境的氢原子。 (1)A的化学名称是 ,B的结构简式为 。 (2)反应Ⅱ的试剂是 ,该反应类型为 。 (3)C生成D的化学方程式为 。 (4)E生成F的化学方程式为 。 (5)在G的同分异构体中,既能与新制的Cu(OH)2悬浊液在加热条件下反应生成砖红色沉淀,又能与碳酸钠反应生成二氧化碳,还能使FeCl3溶液显色的有 种,所有这些同分异构体中,不同化学环境氢原子的种数 (填“相同”“不相同”)。查看更多