- 2021-05-13 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学实验题解题技巧
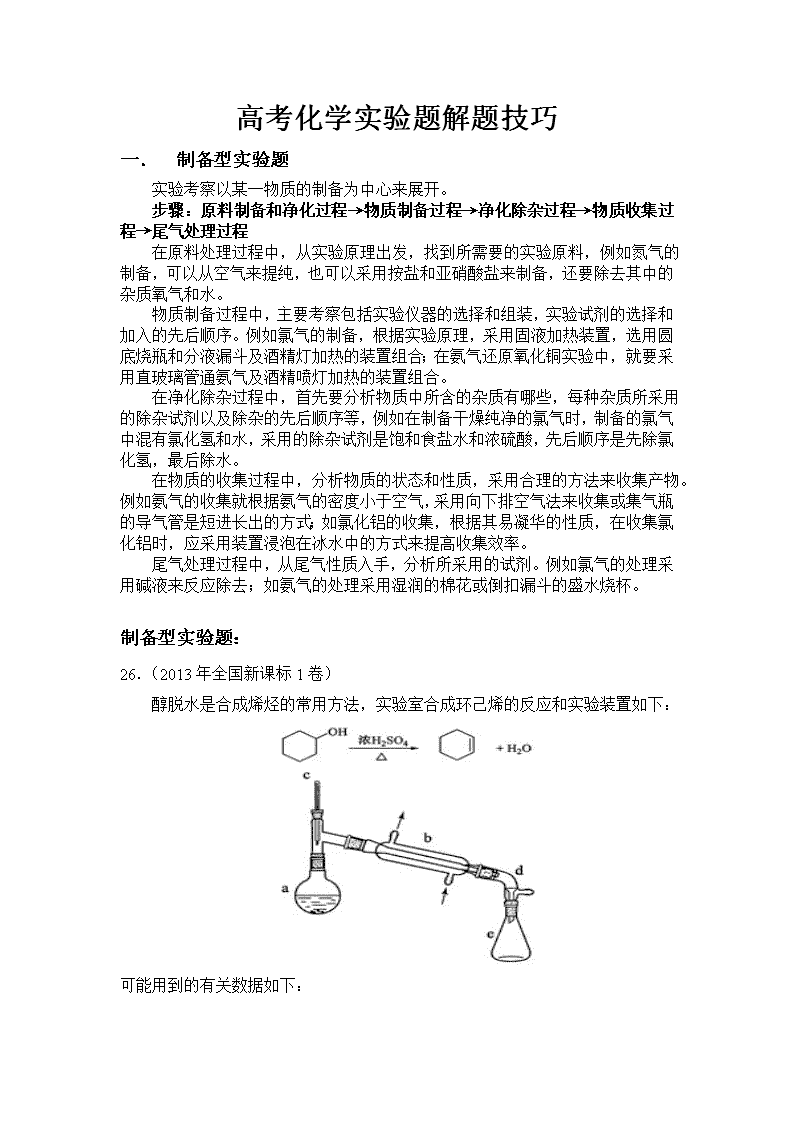
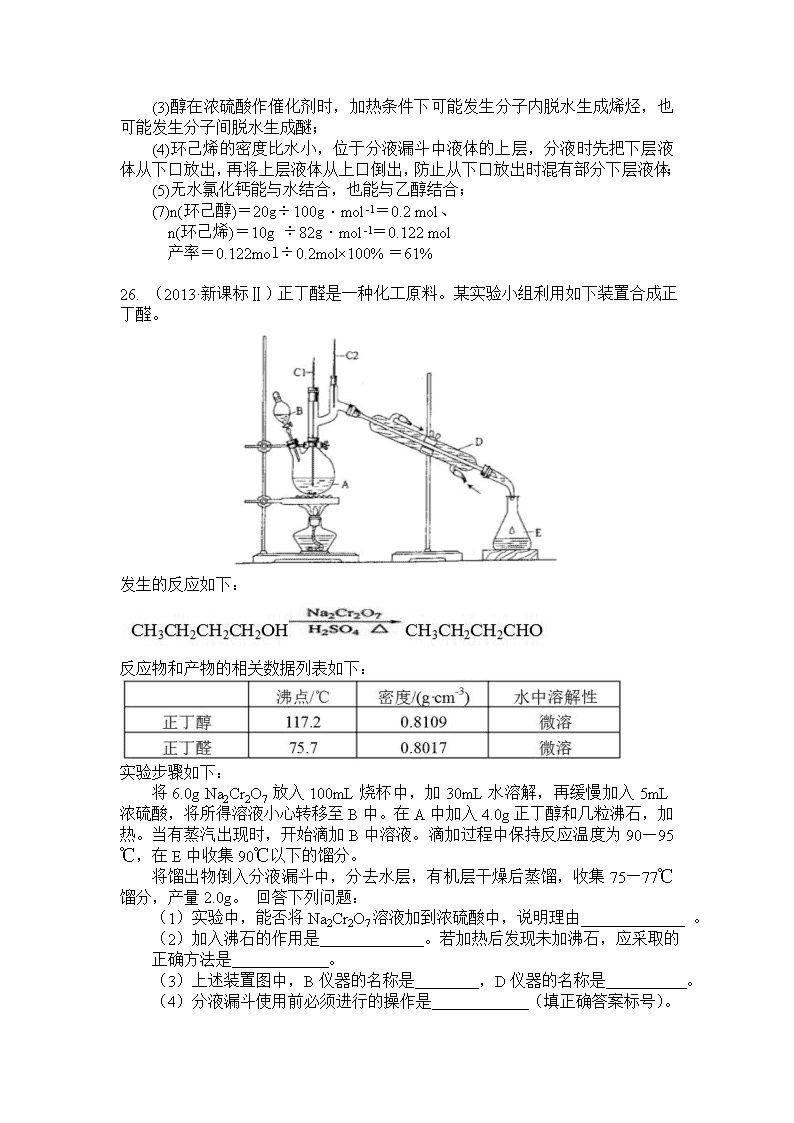
高考化学实验题解题技巧 一. 制备型实验题 实验考察以某一物质的制备为中心来展开。 步骤:原料制备和净化过程→物质制备过程→净化除杂过程→物质收集过程→尾气处理过程 在原料处理过程中,从实验原理出发,找到所需要的实验原料,例如氮气的制备,可以从空气来提纯,也可以采用按盐和亚硝酸盐来制备,还要除去其中的杂质氧气和水。 物质制备过程中,主要考察包括实验仪器的选择和组装,实验试剂的选择和加入的先后顺序。例如氯气的制备,根据实验原理,采用固液加热装置,选用圆底烧瓶和分液漏斗及酒精灯加热的装置组合;在氨气还原氧化铜实验中,就要采用直玻璃管通氨气及酒精喷灯加热的装置组合。 在净化除杂过程中,首先要分析物质中所含的杂质有哪些,每种杂质所采用的除杂试剂以及除杂的先后顺序等,例如在制备干燥纯净的氯气时,制备的氯气中混有氯化氢和水,采用的除杂试剂是饱和食盐水和浓硫酸,先后顺序是先除氯化氢,最后除水。 在物质的收集过程中,分析物质的状态和性质,采用合理的方法来收集产物。例如氨气的收集就根据氨气的密度小于空气,采用向下排空气法来收集或集气瓶的导气管是短进长出的方式;如氯化铝的收集,根据其易凝华的性质,在收集氯化铝时,应采用装置浸泡在冰水中的方式来提高收集效率。 尾气处理过程中,从尾气性质入手,分析所采用的试剂。例如氯气的处理采用碱液来反应除去;如氨气的处理采用湿润的棉花或倒扣漏斗的盛水烧杯。 制备型实验题: 26.(2013年全国新课标1卷) 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: 可能用到的有关数据如下: 合成反应: 在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。 分离提纯: 反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。 回答下列问题: (1)装置b的名称是 。 (2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。 A.立即补加 B.冷却后补加 C.不需补加 D.重新配料 (3)本实验中最容易产生的副产物的结构简式为 。 (4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。 (5)分离提纯过程中加入无水氯化钙的目的是 。 (6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器 (7)本实验所得到的环己烯产率是 (填正确答案标号)。 A.41% B.50% C.61% D.70% 答案: (1)直形冷凝管 (2)防止暴沸;B (3) (4)检漏;上口倒出 (5)干燥(或除水除醇) (6)CD (7)C 解析: (2)如果立即补加碎瓷片,可能使反应液暴沸,发生危险,A选项错误;C选项不能防止暴沸,错误;D选项浪费药品,错误; (3)醇在浓硫酸作催化剂时,加热条件下可能发生分子内脱水生成烯烃,也可能发生分子间脱水生成醚; (4)环己烯的密度比水小,位于分液漏斗中液体的上层,分液时先把下层液体从下口放出,再将上层液体从上口倒出,防止从下口放出时混有部分下层液体; (5)无水氯化钙能与水结合,也能与乙醇结合; (7)n(环己醇)=20g÷100g·mol-1=0.2 mol、 n(环己烯)=10g ÷82g·mol-1=0.122 mol 产率=0.122mol÷0.2mol×100%=61% 26. (2013·新课标Ⅱ)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。 发生的反应如下: 反应物和产物的相关数据列表如下: 实验步骤如下: 将6.0g Na2Cr2O7 放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。 将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。 回答下列问题: (1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 。 (2)加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。 (3)上述装置图中,B仪器的名称是 ,D仪器的名称是 。 (4)分液漏斗使用前必须进行的操作是 (填正确答案标号)。 a.润湿 b.干燥 c.检漏 d.标定 (5)将正丁醛粗产品置于分液漏斗中分水时,水在 层(填“上”或“下”) (6)反应温度应保持在90—95℃,其原因是 。 (7)本实验中,正丁醛的产率为 %。 【答案】(1)不能,易迸溅;(2)防止爆沸;冷却后补加;(3)滴液漏斗;直形冷凝管;(4)c;(5)下;(6)即可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;(7)51。 【解析】 (1)将重铬酸钠溶液和浓硫酸混合时,相当于对浓硫酸进行稀释。若将重铬酸钠溶液加到浓硫酸中,水的密度比浓硫酸小,会引起液滴飞溅,造成危险。 (2)实验装置中沸石的作用是防止溶液暴沸。若加热后发现未加沸石,应该停止加热,等溶液冷却后再加入沸石。 (3)装置中B仪器叫滴液漏斗,D仪器叫直形冷凝器。 (4)分液漏斗使用前必须进行的操作是检查是否漏液。 (5)由题意知正丁醛微溶于水,密度比水小,所以分液时水在下层,正丁醛在上层。 (6)反应时温度保持在90—95℃,既可以保证正丁醛变成蒸汽及时分离出去,同时还可以避免正丁醛被继续氧化。 (7)若4.0g的正丁醇完全反应产生的正丁醛应为4÷74×72=3.89g,则正丁醛的产率应为2÷3.89×100%=51%。 一. 验证性实验题 考查物质性质,一般还包括物质制备过程。根据实验要求来分析验证每一种性质的实验原理,根据实验原理寻找所需要的实验试剂,再根据互不干扰原则来确定性质验证的先后顺序。 步骤:物质制备过程→性质验证过程→尾气处理过程 物质制备过程与第一类相似。在性质验证过程中,关键在于分析不同性质验证的先后顺序的处理。例如验证碳和浓硫酸反应产物的验证实验中,首先产物有水、二氧化碳和二氧化硫,先分析每种物质验证所需的试剂,试剂的选择需要反应中有明显的实验现象,验证水用无水硫酸铜,二氧化碳用澄清石灰水,二氧化硫用品红溶液,再分析相互之间是否存在干扰,就会发现二氧化硫也会使澄清石灰水变浑浊,这就要求在验证二氧化碳前先验证二氧化硫且将二氧化硫除尽,防止干扰二氧化碳的验证。 验证性实验题: 9. (2013年四川理综)为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。 Ⅰ. AgNO3的氧化性 将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+ 除尽后,进行了如下实验。可选用的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。 (1)请完成下表: 操作 现象 结论 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 ① 存在Fe3+ 取少量除尽Ag+后的溶液于试管中,加入 ② ,振荡 ③ 存在Fe2+ 【实验结论】Fe的氧化产物为Fe2+和Fe2+。 Ⅱ.AgNO3的热稳定性 用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。 (2)装置B的作用是 。 (3)经小组讨论并验证该无色气体为O2,其验证方法是 。 (4)【查阅资料】Ag2O和粉末状的Ag均为黑色; Ag2O可溶于氨水。 【提出设想】试管中残留的黑色固体可能是: ①.Ag; ②.Ag2O; ③.Ag和Ag2O。 【实验验证】该小组为验证上述猜想,分别取少量黑色固体放入试管中,进行了如下实验。 实验编号 操作 现象 a 加入足量氨水,振荡 黑色固体不溶解 b 加入足量稀硝酸,振荡 黑色固体溶解,并有气体产生 【实验评价】根据上述实验,不能确定固体产物成分的实验是 ① (填实验编号)。 【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有 ② 。 【答案】 (1)①溶液呈红色 ②K3[Fe(CN)6]溶液 ③产生蓝色沉淀 (2)防倒吸 (3)用玻璃片盖住集气瓶口并取出,正放在桌面上,用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为O2 (4)① b ②Ag、NO2、O2 【解析】 (1)取少量除尽Ag+ 后的溶液于试管中,加入KSCN溶液,振荡,若含有铁离子,溶液会变血红色,验证亚铁离子实验是取少量除尽Ag+ 后的溶液于试管中,加入K3[Fe(CN)6]溶液会和亚铁离子反应生成蓝色沉淀; (2)装置导气管略露出胶塞,是安全瓶,可以防止C装置中 的液体到吸入发生装置A: (3)氧气具有助燃性,用带火星的木条伸入集气瓶中,木条复燃证明无色气为氧气; (4)①实验a加入氨水,银不能溶解于氨水溶液,Ag2O能溶于氨水中形成银氨溶液,加入足量氨水,振荡黑色固体不溶解,说明生成的固体为Ag;实验b加入的硝酸可以溶解Ag2O,也可以溶解Ag,不能检验固体成分,故答案为b; ②装置A加热AgNO3固体,产生红棕色气体为二氧化氮,在装置D中收集到无色气体为氧气,结合实验a的结论,AgNO3固体热分解的产物有Ag、NO2、O2 27. (2010年陕西理综)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。 请回答下列问题: (1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ; (2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ; (3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ; (4)尾气可采用 溶液吸收。 答案: (1)蒸馏烧瓶,Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O (2)溶液由紫红色变为无色、无色溶液中出现浅黄色浑浊,还原性、氧化性; 5 SO2+2 MnO4 -+2 H2O=2 Mn2++5 SO42+ + 4 H+; (3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色; (4)NaOH 解析: 1. 本题要求是探究SO2的性质,那么SO2有哪些性质呢?学生必须清楚。(SO2物理性质:无色、有刺激性、有毒、易溶于水、污染大气、形成酸雨。化学性质:由于SO2分子中硫元素的化合价是正四价,因而既有氧化性又有还原性,但以还原性为主;SO2有漂白性,漂白具有可逆性)。 2. 原理:①制SO2:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O ②SO2的还原性表现在其与强氧化性物质的反应上,如酸性KMnO4 ,Cl2 ,Br2 等;氧化性则表现在与强还原性物质的反应上,如H2S等。 ③由于SO2有毒,污染大气,故尾气必须处理,一般用碱液吸收。 3.仪器用途:结合原理已看出,A装置是 SO2的制取装置,B装置是探究SO2 的还原性装置,C装置是探究SO2的氧化性装置,D装置是探究SO2的漂白性和漂白的可逆性装置。 一. 定量测定实验题 这一类题型除了考查实验外,还结合计算,且计算比较复杂,难度较大。 步骤:确定待测物→性质分析,确定实验原理→组装实验装置→结合数据,计算。 由于是定量实验,不需要有明显的实验现象,但一定要有量的变化,且要是便于测定的量,如沉淀的质量,溶液质量变化、干燥管的质量变化等。在实验装置的选取和组装中,要分析空气对实验结果的干扰,实验装置中残留物对结果的影响、空气倒灌对测量结果的影响等。如有干扰,则要选加装置来排除干扰。 定量测定实验题: 27.(2012年重庆) 氯离子插层镁铝水滑石[Mg2Al(OH)6Cl·xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气。现用如图装置进行实验确定其化学式(固定装置略去)。 (1)Mg2Al(OH)6Cl·xH2O热分解的化学方程式为_______________________。 (2)若只通过测定装置C、D的增重来确定x,则装置的连接顺序为________(按气流方向,用接口字母表示),其中C的作用是________。装置连接后,首先要进行的操作的名称是________。 (3)加热前先通N2排尽装置中的空气,称取C、D的初始质量后,再持续通入N2的作用是________、________等。 (4)完全分解后测得C增重3.65 g、D增重9.90 g,则x=________。若取消冷却玻管B后进行实验,测定的x值将________(填“偏高”或“偏低”)。 (5)上述水滑石在空气中放置时易发生反应生成[Mg2Al(OH)6Cl1-2y(CO3)y·zH2O],该生成物能发生类似的热分解反应。现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z,除测定D的增重外,至少还需测定________。 答案: (1) 2 [Mg2Al(OH)6Cl·xH2O] 4 MgO+Al2O3+2 HCl↑+(5+2x) H2O↑ (2) a→e→d→b 吸收HCl气体 检查装置的气密性 (3) 将分解产生的气体全部带入装置C、D中完全吸收 防止产生倒吸 (4) 3 偏低 (5) 装置C的增重及样品质量 (或样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量) 解析: (1)根据题给信息:高温下完全分解为MgO、Al2O3、HCl和水蒸气,可写出其化学方程式: 2[Mg2Al(OH)6Cl·xH2O] 4MgO+Al2O3+2HCl↑+(5+2x)H2O↑。 (2)装置C的作用是吸收反应生成的HCl气体,装置D的作用是吸收水蒸气,应该首先通过D装置吸收水蒸气,后通过C装置吸收HCl;将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体,故其连接顺序是a→e→d→b;连接好装置后首先应该检查装置的气密性。 (3)因为加热后的装置中含有残留的HCl和水蒸气,为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸。 (4)2[Mg2Al(OH)6Cl·xH2O] 4MgO+Al2O3+2HCl↑+(5+2x)H2O↑ 73 18×(5+2x) 3.65 g 9.9 g 解得:x=3 若没有冷却玻璃管,由于气体温度高,装置D不能将水蒸气充分吸收从而造成结果偏低。 (5)由于化学式中出现了两个未知数,所以必须要测量3个数据,列二元一次方程组进行求解,所以除测定D的增重外,至少还需测定两个数据:装置C的增重及样品质量(或样品质量及样品分解后残余物质量或装置C的增重及样品分解后残余物质量)。 一. 探究性实验题 这类题型一般难度较大,学生失分比较多,主要体现在学生不能准确的把握出题人的意图,但是问题的难度又不是很难。 解题思路; 从实验目的出发,提出假设→根据假设设计实验方案→推测实验现象→得到实验结论。 在实验假设提出时一般情况是二到三种组合,例如浓硫酸与铜反应,试管底部的固体残留物可能是:①CuO ②Cu2O ③CuO和Cu2O,再根据物质的性质设计实验来验证,但要求有明显的不同实验现象,再根据实验现象组合来得到实验结论。 探究性实验题: 28.(2012安徽)工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为PbSO4)发生反应:PbSO4(s) + CO32-(aq)===PbCO3(s) + SO42-(aq)。某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。 (1)上述反应的平衡常数表达式:K= 。 (2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 。 (3)查阅文献:上述反应还可能生成碱式碳酸铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设。请你完成假设二和假设三。 假设一:全部为PbCO3; 假设二: ; 假设三: 。 (4)为验证假设一是否成立,课题组进行如下研究。 ①定性研究:请你完成下表中内容。 实验步骤(不要求写出具体操作过程) 预期的实验现象和结论 取一定量样品充分干燥,…… ②定量研究:取26.7 mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由: 。 答案: (1) K=[SO42-]/[CO32-] (2) Na2CO3 ;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大 (3)全部为2PbCO3·Pb(OH)2 PbCO3与2PbCO3·Pb(OH)2的混合物 (4)① 实验步骤 预期的实验现象和结论 取一定量样品充分干燥,然后将样品加热分解,将产生的气体通过盛有无水硫酸铜的干燥管 若无水硫酸铜不变蓝色,则假设一成立; 若无水硫酸铜变蓝色,则假设一不成立; ②同意 若全部为PbCO3,26.7mg完全分解后,其固体质量为22.3mg 解析: (1) 固体或纯液体不能列于平衡常数表达式中,故K=c(SO42-)/c(CO32-); (2) HCO3- 难电离,相同浓度时,Na2CO3溶液中的c(CO32-)大于NaHCO3溶液中的c(CO32-),有利于平衡正向移动,故Na2CO3溶液中的PbSO4的转化率大。 (3) 依据题干信息可知,PbSO4在转化时能生成碳酸铅,也能生成碱式碳酸铅,故所得产物有三种可能情况: 假设一:全部为PbCO3 假设二:全部为2PbCO3·Pb(OH)2 假设三:PbCO3与2PbCO3·Pb(OH)2的混合物 (4) 因为碳酸铅分解生成PbO,CO2,碱式碳酸铅分解生成PbO、CO2、H2O;故只要分析产物中是否有水生成就可以判断假设一是否成立。①若全部为PbCO3,其加热分解的产物中没有H2O,可重复干燥后加热,将生成的气体通过无水CuSO4,不变蓝说明假设一成立。 ②若全部为PbCO3,则: PbCO3~~PbO 267g 223g查看更多