高考化学二轮复习 原子结构与元素性质的周期性完整
第10讲 原子结构与元素性质的周期性
(建议2课时完成)
[考试目标]
(1)掌握元素周期律的实质,了解元素周期表(长式)的结构(周期、族)及其应用。
(2)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(3)以ⅠA和ⅦA族为例,掌握同一主族内元素性质的递变规律与原子结构的关系。
(4)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(5)了解元素电离能的含义,并能用以说明元素的某些性质。(选考内容)
[要点精析]
元素的性质随着原子序数的递增呈现周期性的变化规律,这个规律叫做元素周期律
一、电子排布的周期性:
同周期(从左到右)
同主族(从上到下)
最外层电子数
由1→8
相同
特征电子排布
从ns1→ns2 np6
相同(ns1~2或ns2np1~6)
周期、族与电子层构型
价电子数=主族序数
S区元素价电子特征排布为nS1~2
p区元素特征电子排布为ns2np1~6
d区元素价电子排布特征为(n-1)d1~10ns1~2;最高能级组中的电子总数=族数
ds区元素特征电子排布为(n-1)d10ns1~2; 最外层电子数=族数
二、元素性质的周期性
非金属性逐渐增强 周期
金 1
属 B 非金属区 非 2
性 Al Si 金 3
逐 Ge As 属 4
渐 Sb Te 性 5
增 金属区 Po At 增 6
强 强 7
金属性逐渐增强
主族ⅠAⅡAⅢA ⅣA ⅤA ⅥA ⅦA
元素性质
同周期元素(左→右)
同主族元素(上→下)
最外层电子数
逐渐增多(1e—→8e—)
相同
原子半径
逐渐减小
逐渐增大
主要化合价
最高正价逐渐增大(+1→+7)
最高正价、最低负价相同
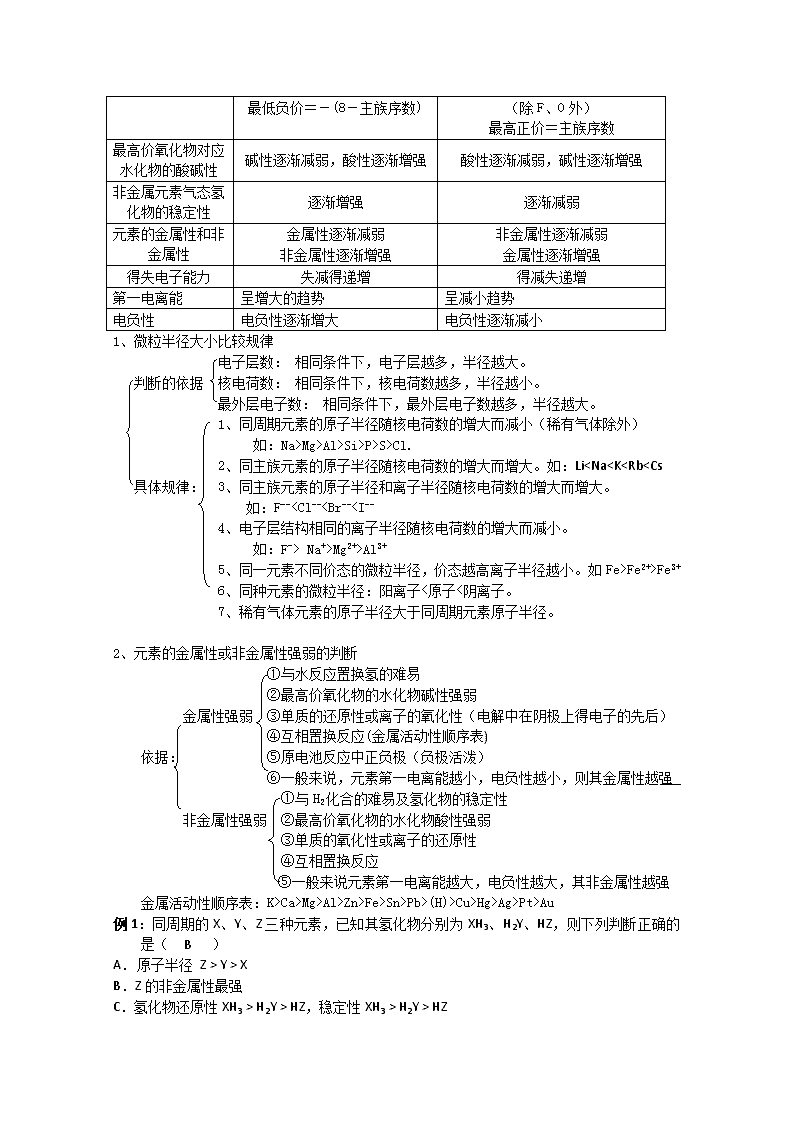
最低负价=-(8-主族序数)
(除F、O外)
最高正价=主族序数
最高价氧化物对应水化物的酸碱性
碱性逐渐减弱,酸性逐渐增强
酸性逐渐减弱,碱性逐渐增强
非金属元素气态氢化物的稳定性
逐渐增强
逐渐减弱
元素的金属性和非金属性
金属性逐渐减弱
非金属性逐渐增强
非金属性逐渐减弱
金属性逐渐增强
得失电子能力
失减得递增
得减失递增
第一电离能
呈增大的趋势
呈减小趋势
电负性
电负性逐渐增大
电负性逐渐减小
1、微粒半径大小比较规律
电子层数: 相同条件下,电子层越多,半径越大。
判断的依据 核电荷数: 相同条件下,核电荷数越多,半径越小。
最外层电子数: 相同条件下,最外层电子数越多,半径越大。
1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外)
如:Na>Mg>Al>Si>P>S>Cl.
2、同主族元素的原子半径随核电荷数的增大而增大。如:Li
Na+>Mg2+>Al3+
5、同一元素不同价态的微粒半径,价态越高离子半径越小。如Fe>Fe2+>Fe3+
6、同种元素的微粒半径:阳离子<原子<阴离子。
7、稀有气体元素的原子半径大于同周期元素原子半径。
2、元素的金属性或非金属性强弱的判断
①与水反应置换氢的难易
②最高价氧化物的水化物碱性强弱
金属性强弱 ③单质的还原性或离子的氧化性(电解中在阴极上得电子的先后)
④互相置换反应(金属活动性顺序表)
依据: ⑤原电池反应中正负极(负极活泼)
⑥一般来说,元素第一电离能越小,电负性越小,则其金属性越强
①与H2化合的难易及氢化物的稳定性
非金属性强弱 ②最高价氧化物的水化物酸性强弱
③单质的氧化性或离子的还原性
④互相置换反应
⑤一般来说元素第一电离能越大,电负性越大,其非金属性越强
金属活动性顺序表:K>Ca>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
例1:同周期的X、Y、Z三种元素,已知其氢化物分别为XH3、H2Y、HZ,则下列判断正确的是( B )
A. 原子半径 Z > Y > X
B.Z的非金属性最强
C.氢化物还原性XH3 > H2Y > HZ,稳定性XH3 > H2Y > HZ
D.最高氧化物对应水化物H3XO4酸性最强
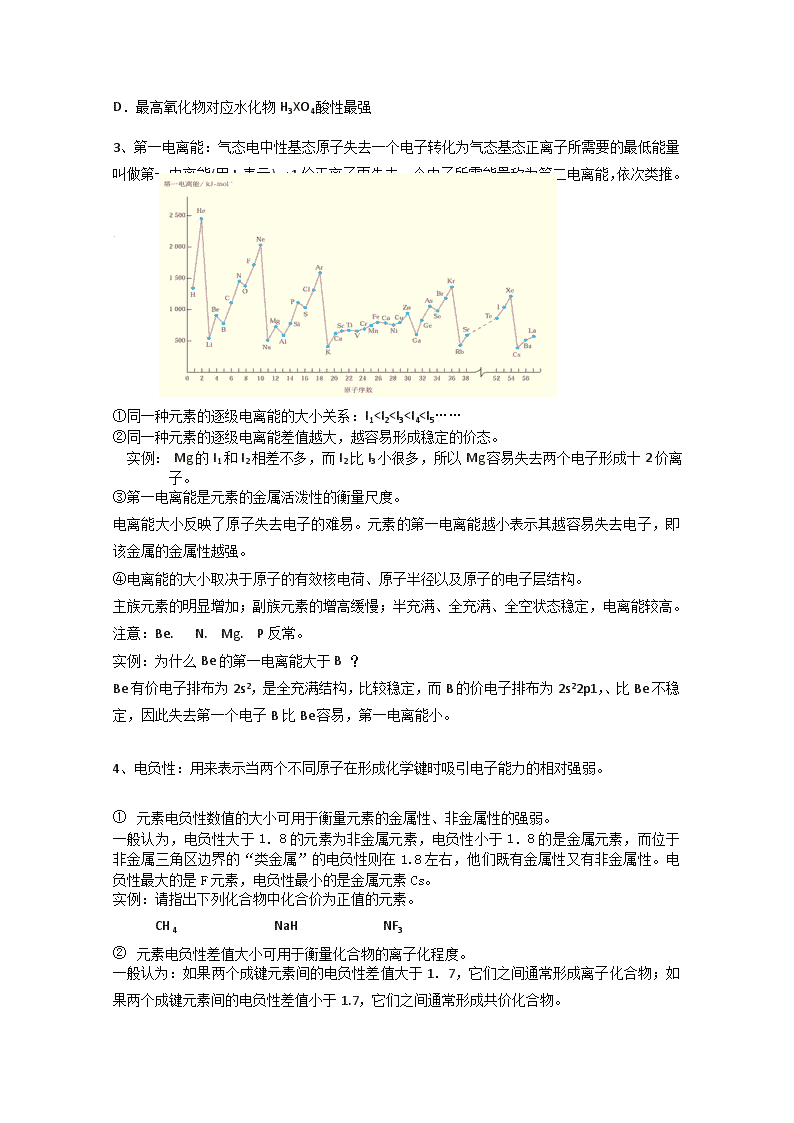
3、第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能(用I1表示)。+1价正离子再失去一个电子所需能量称为第二电离能,依次类推。
①同一种元素的逐级电离能的大小关系:I1Ba(OH)2;气态氢化物稳定性:CH4>SiH4
(2)比较同周期元素及其化合物的性质。如:酸性:HClO4>H2SO4;稳定性:HCl>H2S
(3)比较不同周期、不同主族元素性质时,要找出参照物。例如:比较氢氧化镁和氢氧化钾的碱性,可以把氢氧化钠作为参照物得出氢氧化钾的碱性强于氢氧化镁。
(4)推断一些未学过的元素的某些性质。如:根据ⅡA族的Ca(OH)2微溶,Mg(OH)2难溶,可以推知Be(OH)2更难溶。
2.启发人们在一定范围内寻找某些物质
(1)半导体元素在两性线附近,如:Si、Ge、Ga等。
(2)农药中常用元素在右上方,如:F、Cl、S、P、As等。
(3)催化剂和耐高温、耐腐蚀合金材料、主要在过渡元素中找。如:Fe、Ni、Rh、Pt、Pd等。
3.对角线规则的应用:在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”.
实例:①锂与镁的相似性超过了它和钠的相似性,如:LiOH为中强碱Li2CO3难溶于水等等。
②Be、Al的单质、氧化物、氢氧化物均表现出明显的“两性”;Be 和Al单质在常温下均能被浓H2S04钝化;A1C13和BeCl2均为共价化合物等。
③晶体硼与晶体硅一样,属于坚硬难熔的原子晶体。
请用这些元素的电负性解释对角线规则。
5.常见某些元素的特性
(1)与水反应的最激烈的非金属元素是氟;
(2)与水反应的最激烈的金属元素是铯;
(3)单质硬度最大的元素是碳;
(4)常温下有颜色的气体单质是氟气和氯气;
(5)稀有气体元素中原子半径最大的是氡;
(6)原子半径最小(大)的元素是氢(铯)(稀有气体除外);
(7)所形成的气态氢化物最稳定的元素是氟;
(8)正负化合价的代数和为零,且气态氢化物中含氢百分率最高的元素是碳;
(9)最高价氧化物对应的水化物酸性最强的是氯;
(10)所形成的化合物种类最多的是碳;
(11)原子序数、电子层数、未成对电子数三者均相等的是氢
(12)只有负价并无正价的是氟;
(13)最轻的金属是锂;
(14)最轻的气体是氢气;
(15)同位素之一的原子核中只有质子没有中子的元素是氢;
(16)最高价氧化物及其水化物具有两性的元素是铝;
(17)空气中含量最多的元素,或气态氢化物的水溶液呈碱性的元素是氮;
(18)地壳中含量最多的元素,或气态氢化物的沸点最高的元素,或氢化物在通常情况下呈液态的元素是氧;3.(地壳组成中含量最高的前5种元素 O,Si,Al,Fe,Ca,)
(19)地壳中含量最多的金属元素是铝;
(20)最活泼的非金属元素,或无正价的元素,或无含氧酸的非金属元素,或无氧酸(气态氢化物)可以腐蚀玻璃的元素,或气态氢化物最稳定的元素,或阴离子的还原性最弱的元素是氟;
(21)最易着火的非金属元素的单质,其元素是磷;
(22)常温下单质呈液态的非金属元素是溴,金属元素是汞;
(23)元素的气态氢化物和它的最高价氧化物对应的水化物起化合反应的元素是氮;
(24)元素的单质在常温下能与水反应放出气体的短周期元素是锂、钠、氟;
(25)常见的能形成同素异形体的元素有碳、磷、氧、硫。
(26)与He原子电子层结构相同的离子有(2电子结构):H-、Li+、Be2+
(27)与Ne原子电子层结构相同的离子有(10电子结构):F-、O2-、N3-、Na+、Mg2+、Al3+
(28)10电子的分子、离子有:CH4、NH3、H2O、HF、Ne、OH-、H3O+、 NH4+ F-、O2-、N3-、Na+、Mg2+、Al3+。