- 2021-05-13 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学节复习检测试题 非金属及其化合物
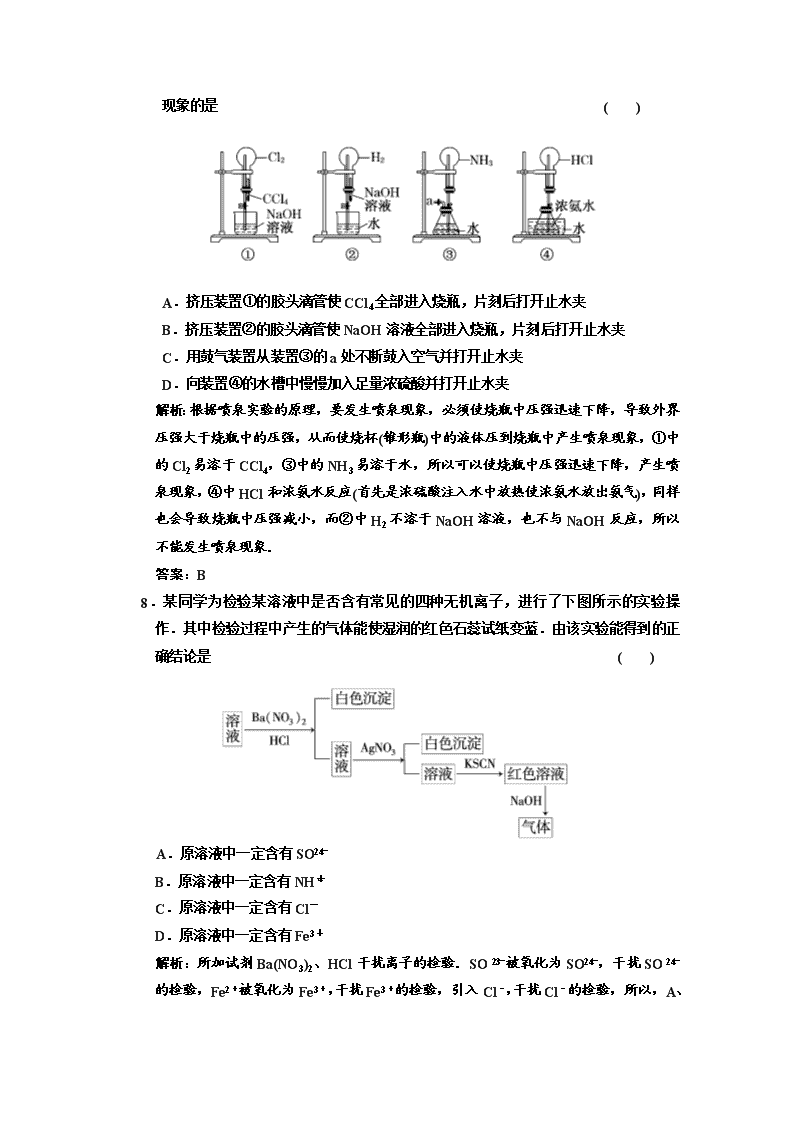
第四章 非金属及其化合物 (时间 90 分钟,满分 100 分) 一、选择题(本题包括 16 个小题,每小题 3 分,共 48 分) 1.以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( ) 氧化物 环境问题 主要来源 A CO2 酸雨 化石燃料的燃烧 B SO2 光化学烟雾 汽车尾气的排放 C NO2 温室效应 工厂废气的排放 D CO CO 中毒 燃料的不完全燃烧 解析:形成酸雨的氧化物主要是 SO2 和氮的氧化物,CO2 是造成温室效应的主要气体, 引起光化学烟雾的主要气体为 NO2,CO 会造成煤气中毒,由此判断,选项 D 正确. 答案:D 2.C、N、S 元素都是生命体的重要组成元素,它们在自然界的平衡已受到较大的破坏.C、 N、S 元素在地球大气圈、岩石圈、水系、生物圈等的循环过程中会产生的物质是①HNO3 ②CO2 ③糖类 ④CH4 ⑤SO2 ( ) A.② B.②③⑤ C.②③④ D.①②③④⑤ 解析:有机物中的碳可转化为 CO2,CO2 通过光合作用可转化为糖类,糖类等可通过 发酵形成甲烷等;大气中的 N2 可转化为 NO,NO 可转化为 NO2、硝酸等;含硫物质在 自然界中可转化为 SO2 等含硫化合物. 答案:D 3.(2010·惠州调研)无色的混合气体甲中可能含 NO、CO2、NO2、NH3、N2 中的几种.将 100 mL 气体甲经过下图实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲 的组成可能为 ( ) A.NH3、NO2、N2 B.NH3、NO、CO2 C.NH3、NO2、CO2 D.NO、CO2、N2 解析:因为为无色混合气体,则没有 NO2,从反应流程看,气体部分被浓硫酸吸收, 说明存在 NH3,通过足量的 Na2O2 后,气体显红棕色,说明生成了 NO2,则原来气体 中存在 NO 以及 CO2,最后气体被水吸收后几乎无气体剩余,则原气体中没有 N2,NO 和生成的氧气完全被水吸收生成 HNO3,故 B 项符合题意. 答案:B 4.有关气体制备所用试剂及检验气体所用试剂完全正确的组合是 ( ) A.CO2:大理石和稀硫酸 澄清石灰水 B.Cl2:二氧化锰和浓盐酸 品红溶液 C.O2:二氧化锰和双氧水 带火星的木条 D.NH3:NH4Cl 固体和 NaOH 固体 湿润的红色石蕊试纸 解析:A 项,大理石与稀 H2SO4 反应生成微溶性的 CaSO4,会使反应逐渐停止;B 项, 检验 Cl2 一般用湿润的淀粉KI 试纸,而不用品红溶液;D 项,制取 NH3 应用 NH4Cl 固体和 Ca(OH)2 固体,不能用 NaOH 固体,因为 NaOH 会与玻璃试管的主要成分 SiO2 发生反应. 答案:C 5.下列物质必须保存在棕色试剂瓶中的是 ( ) ①氯水 ②氨水 ③浓硝酸 ④氢氧化钠 ⑤溴水 A.全部 B.①③⑤ C.①③ D.①②④ 解析:见光或受热易分解的物质应放在棕色试剂瓶中.氯水(溴水)中的 HClO(HBrO) 见光分解为 HCl(HBr)和 O2.浓硝酸见光分解为 NO2、H2O、O2. 答案:B 6.下列关于用臭氧、活性炭对游泳池进行消毒和净化的说法中正确的是 ( ) A.臭氧和活性炭处理水的原理相同 B.由于氯气能和水中的有机物反应,生成有毒含氯化合物,因而不是理想的水处理剂 C.广谱高效杀菌剂二氧化氯的消毒原理是 ClO2 中氯元素显+1 价,具有强氧化性 D.漂白粉的保存不需要密封,可以露置在空气中 解析:A 项中处理水的原理,臭氧是利用其强氧化性,活性炭是利用其吸附性;B 正确; C 项中 ClO2 中 Cl 元素显+4 价,具有强氧化性,D 项中漂白粉要密封保存,露置在空 气中易失效. 答案:B 7.如图是课外活动小组的同学设计的 4 个喷泉实验方案.下列有关操作不.可能引发喷泉 现象的是 ( ) A.挤压装置①的胶头滴管使 CCl4 全部进入烧瓶,片刻后打开止水夹 B.挤压装置②的胶头滴管使 NaOH 溶液全部进入烧瓶,片刻后打开止水夹 C.用鼓气装置从装置③的 a 处不断鼓入空气并打开止水夹 D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 解析:根据喷泉实验的原理,要发生喷泉现象,必须使烧瓶中压强迅速下降,导致外 界压强大于烧瓶中的压强,从而使烧杯(锥形瓶)中的液体压到烧瓶中产生喷泉现象,① 中的 Cl2 易溶于 CCl4,③中的 NH3 易溶于水,所以可以使烧瓶中压强迅速下降,产生 喷泉现象,④中 HCl 和浓氨水反应(首先是浓硫酸注入水中放热使浓氨水放出氨气), 同样也会导致烧瓶中压强减小,而②中 H2 不溶于 NaOH 溶液,也不与 NaOH 反应, 所以不能发生喷泉现象. 答案:B 8.某同学为检验某溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作.其 中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论 是 ( ) A.原溶液中一定含有 SO2- 4 B.原溶液中一定含有 NH+ 4 C.原溶液中一定含有 Cl- D.原溶液中一定含有 Fe3+ 解析:所加试剂 Ba(NO3)2、HCl 干扰离子的检验.SO 2- 3 被氧化为 SO2- 4 ,干扰 SO 2- 4 的 检验,Fe2+被氧化为 Fe3+,干扰 Fe3+的检验,引入 Cl-,干扰 Cl-的检验,所以,A、 C、D 都不正确.最后产生的气体能使湿润的红色石蕊试纸变蓝,说明 NH + 4 存在,B 正确. 答案:B 9.下列关于实验中颜色变化的叙述正确的是 ( ) A.将二氧化硫通入品红溶液中,溶液显红色,加热后变为无色 B.向溶液中加入新制氯水,再滴加 KSCN 溶液,若溶液变红色,则证明溶液中一定 含有 Fe2+ C.将湿润的红纸条放进盛有氯气的集气瓶中,红纸条褪色 D.用标准高锰酸钾溶液滴定 Na2SO3 溶液,终点时溶液由紫色变为无色 解析:A 中,SO2 遇品红溶液使之褪色,而加热后红色复原;B 中,该操作不能排除 原溶液中是否含有 Fe3+,正确的操作应该是先滴加 KSCN 溶液,若溶液不变红色,再 加入新制氯水进行检验;D 中,当 Na2SO3 被消耗完毕时,再滴加高锰酸钾溶液则出 现紫色,故终点时的颜色变化是由无色变为紫色. 答案:C 10.青海昆仑玉被定为 2008 年北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和 “ 阳 起 石 ” 组 成 的 纤 维 状 微 晶 结 合 体 , 透 闪 石 (Tremolite) 的 化 学 成 分 为 Ca2Mg5Si8O22(OH)2.下列有关说法不.正确的是 ( ) A.透闪石的化学式写成氧化物的形式为: 2CaO·5MgO·8SiO2·H2O B.透闪石中 Mg 元素的质量分数是 Ca 元素质量分数的 1.5 倍 C.1 mol Ca2Mg5Si8O22(OH)2 与足量的盐酸作用,至少需要 14 mol HCl D.透闪石是一种新型无机非金属材料,难溶于水 解析:由透闪石组成知它属于传统的硅酸盐材料,但难溶于水,D 错误;依改写规则 可判断 A 正确;透闪石中镁的总式量为 120,是钙的 1.5 倍,B 正确;与盐酸作用时, SiO2 与盐酸不反应,其他金属元素则转化为金属氯化物,根据氯守恒易知 C 正确. 答案:D 11.用 4 种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( ) 选项 操作及现象 溶液 A 通入 CO2,溶液不变浑浊.先通入 CO2 再通入氨气,溶液变浑浊 CaCl2 溶液 B 通入 CO2,溶液变浑浊.继续通 CO2 至过量,浑浊消失. Na2SiO3 溶液 C 通入 CO2,溶液变浑浊.再加入品红溶液,红色褪去. Ca(ClO)2 溶液 D 通入 CO2,溶液变浑浊.继续通 CO2 至过量,浑浊消失.再加入足量 NaOH 溶液,又变浑浊. Ca(OH)2 溶液 解析:A 项,通入 NH3 后生成了 CO2- 3 ,产生 CaCO3 沉淀;B 项,发生反应 Na2SiO3 +2CO2(过量)+2H2O===2NaHCO3+H2SiO3↓,但 H2SiO3 不溶于过量 CO2 的水溶液; C 项,发生反应 CO2+H2O+Ca(ClO)2===CaCO3↓+2HClO,HClO 能使品红溶液褪 色;D 项,依次发生如下反应:Ca(OH)2+CO2===CaCO3↓+H2O,CaCO3+CO2+ H2O===Ca(HCO3)2,Ca(HCO3)2+2NaOH===CaCO3↓+Na2CO3+2H2O. 答案:B 12.(2010·合肥模拟)如图所示,向一定量的铁粉中加入一定体积 12 mol/L 的 HNO3,加热充分反应后,下列粒子在体系中一定 大量存在的是 ( ) ①NO- 3 ②Fe3+ ③H+ ④NO ⑤NO2 A.① B.①⑤ C.②④⑤ D.①②③⑤ 解析:若铁粉过量,体系中大量存在 NO- 3 、Fe2+、NO;若 HNO3 过量,体系中大量 存在 NO- 3 、Fe3+、H+、NO2. 答案:A 13.(2009·南京模拟)X、Y、Z、W 有如图所示的转化关系,则 X、W 可能是( ) ①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2 A.①②③ B.①② C.③④ D.①②③④ 解 析 : ①②③ 均 有 如 图 所 示 的 转 化 关 系 , 如 C―→CO―→CO2 ; AlCl3―→Al(OH)3―→NaAlO2;Fe―→Fe(NO3)2―→Fe(NO3)3. 答案:A 14.1.92 g Cu 投入到一定量的浓 HNO3 中,Cu 完全溶解,生成气体颜色越来越浅,共收 集到标准状况下 672 mL 气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一 定体积的 O2,恰好使气体完全溶于水,则通入 O2 的体积为 ( ) A.504 mL B.336 mL C.224 mL D.168 mL 解析:此题初审发现浓 HNO3 与 Cu 反应,产生 NO2,当 HNO3 变稀产生 NO,即 672 mL 气体不知道含 NO2、NO 各多少毫升,看似无从下手,但抓住反应本质 Cu―→Cu2 +,NOx+O2+H2O―→HNO3 即 Cu 失电子数等于 O2 得电子数,则有: V(O2)= 1.92 g 64 g/mol ×2÷4×22400 mL/mol=336 mL. 答案:B 15.(2010·临沂模拟)关于硫酸和硝酸的说法中,下列叙述不.正确的是 ( ) A.稀硫酸和稀硝酸都具有氧化性 B.硫酸和硝酸都是重要的化工原料 C.在铜分别与浓硫酸和浓硝酸的反应中,两种酸都表现了强氧化性和酸性 D.浓硫酸和浓硝酸都具有很强的腐蚀性、脱水性 解析:浓硝酸不具有脱水性. 答案:D 16.下列各组物质中,不.是按 (“―→”表示一步完成)关系相互转化的是( ) 选项 a b c A Fe FeCl3 FeCl2 B Cl2 NaClO NaCl C Si SiO2 H2SiO3 D HNO3 NO NO2 解析:SiO2 不能直接生成 H2SiO3,H2SiO3 也不能一步直接生成 Si. 答案:C 二、非选择题(本题包括 6 个小题,共 52 分) 17.(8 分)硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科 学中有着重要影响和广泛应用.试回答下列问题: (1)向大气中排放 NOx 可能导致的环境问题有____________________.(答两点)已知 足量 NaOH 溶液能完全吸收 NO2 生成氮的含氧酸盐.试写出该反应的离子方程式 ___________________. (2)光导纤维的作用,让人们的生活更加丰富精彩,____________是制备光导纤维的 基本原料. (3)氮化硅陶瓷是一种新型无机非金属材料,其化学式为__________,可由硅粉(用 Al2O3 和 Y2O3 作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起 了______________作用.由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉.在 烧结过程中,二氧化硅、碳、氮气以物质的量之比 3∶6∶2 反应生成两种化合物, 该反应的化学方程式为___________________________________. (4)硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源.与“氢能源” 比较“硅能源”具有________________________________等更加优越的特点,从而 得到全球的关注和期待. 解析:(1)氮氧化物会导致酸雨、光化学烟雾、臭氧层破坏等污染,NaOH 溶液和 NO2 反应生成 NaNO3 和 NaNO2; (2)二氧化硅是制备光导纤维的基本原料; (3)二氧化硅、碳、氮气以物质的量之比 3∶6∶2 反应,生成 Si3N4,从原子个数守恒 可以看出,另一种产物是一氧化碳. 答案:(1)酸雨、光化学烟雾、臭氧层破坏(任两点均可) 2NO2+2OH-===NO- 3 +NO- 2 +H2O (2)SiO2(或二氧化硅) (3)Si3N4 防止硅和氮化硅氧化(或作保护气) 3SiO2+2N2+6C===== 高温 Si3N4+6CO (4)便于储运,比较安全 18.(8 分)某化学兴趣小组的同学利用下图所示实验装置进行实验(图中 a、b、c 表示止水 夹). 请按要求填空: (1)利用 B 装置可制取的气体有____________(写出两种即可). (2)A、C、E 相连后的装置可用于制取 Cl2 并进行相关的性质实验. ①若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验, 实验操作、现象、结论如下: 实验 序号 实验操作 现象 结论 Ⅰ 将氯水滴入品红溶液 溶液褪色 氯气与水反应的产物有漂白性 Ⅱ 氯水中加入碳酸氢钠粉末 有无色气 泡产生 氯气与水反应的产物具有酸性 请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由________________ ________________________________________________________________________. ②请利用上述装置设计一个简单的实验验证 Cl-和 Br-的还原性强弱(分别指出甲、乙、 丙中盛放的试剂、实验现象及结论)__________________________________________ ________________________________________________________________________. (3)B、D、E 装置相连后,在 B 中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进 行 NO2 有关实验. ①B 中发生反应的化学方程式为______________________________________ ________________________________________________________________________. ②欲用 D 装置验证 NO2 与水的反应,其操作步骤为:先关闭止水夹________,再打开 止水夹________,使烧杯中的水进入试管丁的操作是________________. ③试管丁中的 NO2 与水充分反应后,若向试管内缓缓通入一定量的氧气,直到试管全 部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算). 解析:(1)装置 B 是简易启普发生器,可以用它制取块状固体与液体反应,不需要加热 且制取的气体是在水溶液中溶解度不大的气体. (2)实验室制取 Cl2 常用浓盐酸和二氧化锰加热进行,所以制得的气体中混有挥发出来 的 HCl 气体,而它可以与 NaHCO3 反应,故实验Ⅱ结论不合理.要设计实验验证 Cl- 和 Br-的还原性强弱,可以从 Cl2 和 Br2 的氧化性入手借助 Cl2+2Br-===2Cl-+Br2 反 应来判断. (3)第①问较为简单,主要考查 Cu 与浓 HNO3 反应的化学方程式.第②问,要验证 NO2 与水反应,必须使 NO2 和水接触,且有明显的实验现象.先关闭止水夹 a、b,打开止 水夹 c,目的是使气体与水接触,但必须外力引发,其原理和引发喷泉实验的原理相 同.第③问计算试管全部充满水后所得溶液的物质的量浓度需按照 4NO2+O2+ 2H2O===4HNO3 进行计算即可. 答案:(1)H2、CO2 (2)①实验Ⅰ结论合理,实验Ⅱ结论不合理;制取的氯气中含有 HCl 气体,HCl 溶于水 后能与碳酸氢钠粉末反应产生气泡 ②在甲、乙、丙中分别装入浓盐酸、二氧化锰、溴化钠溶液;烧瓶中有黄绿色气体生 成,试管中溶液由无色变为橙色,可证明氯气的氧化性强于溴,则 Br-的还原性强于 Cl- (3)①Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ②a、b c 双手紧握(或微热)试管丁,使试管中气体逸出,NO2 与水接触后即可引发 烧杯中的水倒流入试管丁中 ③0.045 mol/L 19.(8 分)(2010·潍坊质检)已知:A、B 为常见的非金属单质且均为气体;甲、乙为金属 单质,乙在 I 的浓溶液中发生钝化;C、H、J 的溶液均呈碱性.各物质间的转化关 系如下(部分生成物未给出,且未注明反应条件): (1)写出反应②的化学方程式_________________________________________ ________________________________________________________________________. (2)反应④中每消耗 1 mol G,转移电子的物质的量为______________. (3)反应⑥的离子方程式是___________________________________________. (4)实验室中保存 I 的方法是____________________________________________. 解析:A、B 为常见的非金属单质且均为气体,A、B 反应的产物能连续两次与 O2 反 应,C 必为 NH3,D 为 NO,G 为 NO2.以此为突破口,结合其余信息可推出,A、B、 E、H、J、I、甲、乙分别为:H2、N2、H2O、NaOH、NaAlO2、HNO3、Na、Al. 答案:(1)4NH3+5O2===== 催化剂 高温 4NO+6H2O(“高温”也可写成“△”) (2)2 3 mol (3)2Al+2H2O+2OH-===2AlO- 2 +3H2↑ (4)保存在棕色试剂瓶中,放在阴凉处 20.(8 分)如图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成 的 H2O 已略去). 已知: (a)A、B、C、D 是非金属单质,其中 B、C、D 在常温常压下是气体. (b)反应①、②是化工生产中的重要反应. (c)化合物 E 是形成酸雨的污染物之一,化合物 K 是常用的氮肥. (d)化合物 L 具有漂白性,可由 Cl2 与 NaOH 溶液反应而制得. (e)化合物 J 由两种元素组成,其相对分子质量为 32. 请按要求填空: (1)反应③的化学方程式_______________________________________________. (2)C 的结构式__________________________;H 的化学式____________________. (3)L 的溶液与化合物 E 反应的离子方程式:____________________________. (4)化合物 J 的化学式____________________. 解析:本题的突破口是 E.由于 B、C、D 是非金属单质,且其中 A 不是气体,结合“化 合物 E 是形成酸雨的污染物之一”可推出 E 为 SO2,A 为 S,B 为 O2;再根据“反应 ②是化工生产中的重要反应”及“F――→H2SO4 K”,且“K 是常用的氮肥”可推出 F 为 NH3,则 C、D 为 N2、H2;再结合“J――→氧气 C”和“J 由两种元素组成,其相对分子质 量为 32”,可推出 C 只能为 N2,J 为 N2H4;又根据“L 具有漂白性,可由 Cl2 与 NaOH 溶液反应而制得”可推出 L 为 NaClO. 答案:(1)2NH3+H2SO4===(NH4)2SO4 (2)N≡N (NH4)2SO3 或 NH4HSO3 (3)ClO-+SO2+2OH-===Cl-+SO2- 4 +H2O (4)N2H4 21.(10 分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: ①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥 HCl 气体反应制得 SiHCl3: Si+3HCl=====300℃ SiHCl3+H2 ③SiHCl3 与过量 H2 在 1000~1100℃反应制得纯硅 已知 SiHCl3 能与 H2O 剧烈反应,在空气中易自燃. 请回答下列问题: (1)第①步制备粗硅的化学反应方程式为_____________________________. (2)粗硅与 HCl 反应完全后,经冷凝得到的 SiHCl3(沸点 33.0℃)中含有少量 SiCl4(沸点 57.6℃) 和 HCl( 沸 点 - 84.7℃) , 提 纯 SiHCl3 采 用 的 方 法 为 ________________________________. (3)用 SiHCl3 与过量 H2 反应制备纯硅的装置如下图所示(热源及夹持装置略去): ① 装 置 B 中 的 试 剂 是 ________. 装置 C 中的烧瓶需要加热,其目的是___________________________________. ②反应一段时间后,装置 D 中观察到的现象是__________________________;装置 D 不 能采用普通玻璃管的原因是____________________________,装置 D 中发生反应的 化 学方程式为________________________. ③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温 度以及__________________________________________________. ④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入 的试剂是________.(填写字母代号) a.碘水 b.氯水 c.NaOH 溶液 d.KSCN 溶液 e.Na2SO3 溶液 解析:分离沸点不同的液体的方法是分馏;根据题干“SiHCl3 能与 H2O 强烈反应,在 空气中易自燃”可知道 H2 的作用之一就是排尽装置内的空气,防止 SiHCl3 自燃,而此 H2 必须是干燥的,可知 B 的作用就是干燥 H2,所以选用浓 H2SO4.由于通入 D 中应是 稳定的 SiHCl3 与过量 H2 的气流,所以 C 装置要加热,并且是水浴加热.因 D 装置应 加热到 1000℃~1100℃,用普通玻璃管会软化,必须用石英管.鉴定是否含铁单质, 试样用稀盐酸溶解后生成 Fe2+,如果选用 NaOH 溶液,生成的 Si 也会溶解,所以考虑 转化为 Fe3+后再检验,故选 b、d. 答案:(1)SiO2+2C===== 高温 Si+2CO↑ (2)分馏(或蒸馏) (3)①浓硫酸 使滴入烧瓶中的 SiHCl3 汽化 ②有固体物质生成 在此反应温度下,普通玻璃会软化 SiHCl3+H2===== 高温 Si+3HCl ③排尽装置中的空气 ④b、d 22.(10 分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了下图所示装置进 行有关实验: (1)先关闭活塞 a,将 6.4 g 铜片和 12 mL 18 mol/L 的浓硫酸放在圆底烧瓶中共热至反应 完成,发现烧瓶中还有铜片剩余.再打开活塞 a,将气球中的氧气缓缓挤入圆底烧瓶, 最后铜片完全消失. ①写出上述过程中烧瓶内发生反应的化学方程式: 打开活塞 a 之前_____________________________________________________; 打开活塞 a 之后_______________________________________________________. ②B 是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请直接在图上 把导管补充完整. (2)实际上,在打开活塞 a 之前硫酸仍有剩余.为定量测定余酸的物质的量,甲、乙两 学生进行了如下设计: ①甲学生设计方案是:先测定铜与浓硫酸反应产生 SO2 的量,再通过计算确定余酸的 物质的量.他测定 SO2 的方法是将装置 A 产生的气体缓缓通过装置 D,从而测出装置 A 产生气体的体积(已折算成标准状况).你认为甲学生设计的实验方案中 D 装置中试 剂为__________________(填化学式). ②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操 作配制 100 mL 溶液,再取 20 mL 于锥形瓶中,用________作指示剂,用标准氢氧 化 钠溶液进行滴定[已知:Cu(OH)2 开始沉淀的 pH 约为 5],选择该指示剂的理由为 ___________________________________________________________________ ________________________________________________________________________; 再求出余酸的物质的量,若耗去 a mol/L 氢氧化钠溶液 b mL,则原余酸的物质的量为 ________ mol.(用含 a、b 的表达式来表示) 解析:(1)①浓硫酸具有强氧化性,加热条件下与 Cu 反应,Cu+2H2SO4(浓)===== △ CuSO4 +SO2↑+2H2O; 有 O2 存在时,Cu 与稀硫酸发生反应,2Cu+2H2SO4+O2===2CuSO4+2H2O. ②SO2 密度大于空气密度,用向上排空气法收集,所以 B 装置中导管长进短出. (2)①用排液体法测气体体积,为了减小误差,气体的溶解度应尽可能的小,选择饱和 NaHSO3 溶液. ②由于 Cu(OH)2 开始沉淀的 pH 约为 5,应选择变色范围接近的指示剂,以减小滴定误 差,故选择甲基橙作指示剂.设余酸的物质的量为 n,消耗 NaOH 的物质的量为: a mol/L×b×10-3 L=ab×10-3 mol H2SO4+2NaOH===Na2SO4+2H2O 1 2 n× 20 100 ab×10-3 mol 故 n=5ab×10-3 2 mol 即原余酸的物质的量为5ab×10-3 2 mol. 答案:(1)①Cu+2H2SO4(浓)===== △ CuSO4+SO2↑+2H2O 2Cu+2H2SO4+O2===2CuSO4+2H2O ②B 装置中导管长进短出 (2)①饱和 NaHSO3 ②甲基橙 因为 Cu(OH)2 开始沉淀的 pH 约为 5,若用酚酞作指示剂时溶液中的 Cu2+会 和 NaOH 反应,Cu(OH)2 的蓝色会干扰滴定终点的正确判断 5ab×10-3 2查看更多