- 2021-05-13 发布 |
- 37.5 KB |
- 12页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学考试大纲解读专题五阅卷角看备考
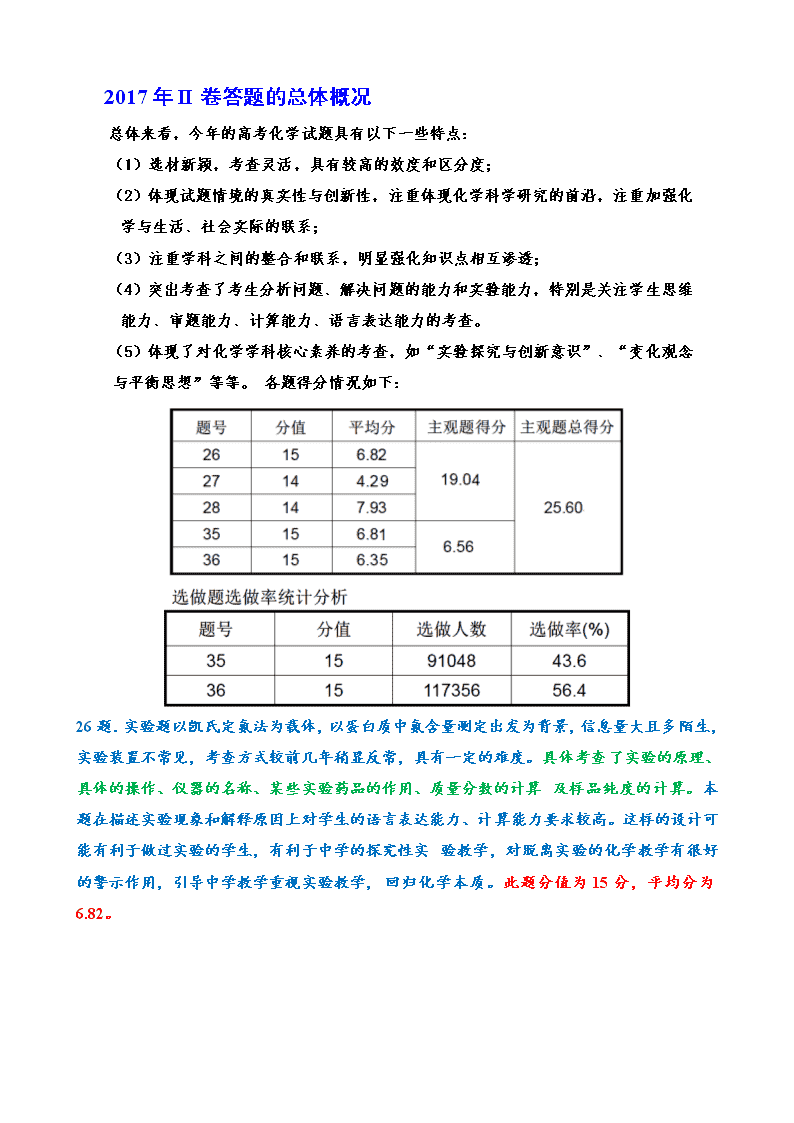
从高考评卷视角看高中化学的教与学 2017高考理综化学全国(I) 7.下列生活用品中主要由合成纤维制造的是( ) A.尼龙绳 B.宣纸 C.羊绒衫 D.棉衬衣 8.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( ) A.蒸馏 B.升华 C.干馏 D.萃取 9.已知(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是( ) A.b的同分异构体只有d和p两种 B.b、d、p的二氯代物均只有三种 C.b、d、p均可与酸性高锰酸钾溶液反应 D.b、d、p中只有b的所有原子处于同一平面 10.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( ) A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 11.支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( ) A.通入保护电流使钢管桩表面腐蚀电流接近于零 B.通电后外电路电子被强制从高硅铸铁流向钢管桩 C.高硅铸铁的作用是作为损耗阳极材料和传递电流 D.通入的保护电流应该根据环境条件变化进行调整 12.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( ) A.X的简单氢化物的热稳定性比W强 B.Y的简单离子与X的具有相同的电子层结构 C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红 D.Z与X属于同一主族,与Y属于同一周期 13.常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( ) A.Ka2(H2X)的数量级为10-6 B.曲线N表示pH与的变化关系 C.NaHX溶液中c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-) > c(OH-)=c(H+) 2017年II卷答题的总体概况 总体来看,今年的高考化学试题具有以下一些特点: (1)选材新颖,考查灵活,具有较高的效度和区分度; (2)体现试题情境的真实性与创新性,注重体现化学科学研究的前沿,注重加强化 学与生活、社会实际的联系; (3)注重学科之间的整合和联系,明显强化知识点相互渗透; (4)突出考查了考生分析问题、解决问题的能力和实验能力,特别是关注学生思维 能力、审题能力、计算能力、语言表达能力的考查。 (5)体现了对化学学科核心素养的考查,如“实验探究与创新意识”、“变化观念 与平衡思想”等等。 各题得分情况如下: 26题.实验题以凯氏定氮法为载体,以蛋白质中氮含量测定出发为背景,信息量大且多 陌生,实验装置不常见,考查方式较前几年稍显反常,具有一定的难度。具体考查 了实验的原理、具体的操作、仪器的名称、某些实验药品的作用、质量分数的计算 及样品纯度的计算。本题在描述实验现象和解释原因上对学生的语言表达能力、计 算能力要求较高。这样的设计可能有利于做过实验的学生,有利于中学的探究性实 验教学,对脱离实验的化学教学有很好的警示作用,引导中学教学重视实验教学, 回归化学本质。此题分值为15分,平均分为6.82。 26.凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机 氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。 已知:NH3 + H3BO3===NH3·H3BO3; NH3·H3BO3 + HCl=== NH4Cl + H3BO3。 回答下列问题: ⑴ a的作用是 。 〖标准答案〗 避免b中压强过大。(平衡气压、泄压、安全管) (2分) 〖主要错误〗加药品;测量温度;回流冷凝;通入空气或氧气;排气;搅拌; 防倒吸;判断压强变化等等。一些考生因没有明白装置意图,因此答案五花八门。 ⑵ b中放入少量碎瓷片的目的是 。f的名称是 。 〖标准答案〗防止暴沸;(1分)直形冷凝管。(1分) 〖主要错误〗① 错别字,如将“暴沸”写成“爆沸”、“冷凝管”写成“冷疑管”; ②不知道f是直形冷凝管,写成“球形冷凝管”、“直式冷凝管”、“冷凝管”。 ⑶ 清洗仪器:g中加蒸馏水,打开k1,关闭k2、k3,加热b,蒸气充满管路,停止加热,关闭k1, g中蒸馏水倒吸进入c,原因是 ;打开k2放掉水,重复操作2~3次。 〖标准答案〗“c中温度下降,管路中形成负压”。 (2分) 该问考查具体操作过程中所产生的实验现象的原因,考生要运用物理学知识对原因 进行语言文字表述。 〖主要错误〗部分考生分析、表述不当甚至错误导致失分,有的从热胀冷缩的角度 去说;有的虽然能够说出产生压强差,但说产生压强差的原因是氨气极易溶于水。 ⑷ 仪器清洗后,g中加入硼酸(H3BO3)和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液, 用蒸馏水冲洗d,关闭k3,d中保留少量水。打开k1,加热b,使水蒸气进入e。 ① d中保留少量水的目的是 。 ② e中主要反应的离子方程式为 , e采用中空双层玻璃瓶的作用是 。 〖标准答案〗 ①为“液封,防止氨气逸出”。 (1分) ②NH4+ + OH-NH3↑ + H2O;(2分) 保温使氨完全蒸出 (2分) 考查d中保留少量水的目的,有一定难度。 〖主要错误〗“检验气压是否良好”、“防止水蒸气不足”、“防止外界气体进入 装置”、“吸收氨气”等等。 ②有两空,第一空考查离子反应式,是基础知识;第二空考查中空双层玻璃瓶的作 用。 〖典型错误〗第一空主要是产物写错,如写成NH3·H2O或NH4OH;写化学方程式。 第二空答案五花八门,如“防止冷凝”、“防止炸裂”、“防止过热”、“防止外界环境 的 影响”,说明考生面对陌生试题情境,分析问题的能力不够强,不能联系生活实 际,表 达能力较差。 ⑸ 取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为c mol·L-1的盐酸 V mL,则样品中氮的质量分数为 %,样品的纯度≤ %。 〖标准答案〗、(2分)。 (2分) 此问考查质量分数的计算及样品纯度的计算,难度并不算大,但正确率不高。 〖主要错误〗①计算错误;②忘记乘以100;③在计算结果后加“%”;④ 两空位置写 错或写反。反映出考生计算能力薄弱,且审题不认真。 27题.本题以锂离子电池的电极材料制备流程为载体,延续化学原理综合应用的拼题, 考 查学生应用盖斯定律、热化学方程式、转化率、平衡常数、化学反应速率等理论 联 系实际。具体有化学键的判断、化学反应速率及转化率的影响因素、有关溶度积 常 数的计算、陌生化学方程式或离子方程式的书写等相关知识,对学生通过图表获 取 信息的能力及分析问题解决问题的能力要求较高,难度较大。 此题分值为14分, 平均分为4.29。 27. Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含 有少量MgO、SiO2等杂质)来制备,工艺流程如下: 回答下列问题: ⑴“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的 实验条件为 。 〖标准答案〗100℃/2h; 90℃/5h。 (4分) 此问考查学生通过读图获取信息的能力。 〖典型问题〗回答不全面,只能答出两种条件中的一种;只答温度90℃或100℃; 答 温度区间,如“温度在90℃~100℃”、“温度大于或等于90℃”等等。说明考 生面对陌生情境获取信息不全面、观察不细致,考生答题情况也从一个侧面说明他 们应对高考有点机械,明显带有平时题海战术训练的痕迹。 ⑵“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 。 〖标准答案〗FeTiO3 + 4H+ + 4Cl-===Fe2+ + TiOCl42-+ 2H2O。(3分) 此问查陌生离子方程式的书写,正答率不高。说明考生书写陌生离子方程式的能力 有 待于进一步提高。 〖典型问题〗元素符号、化学式书写不规范;配平错误;将FeTiO3拆成离子的形式。 ⑶ TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示: 分析40 ℃时TiO2·xH2O转化率最高的原因 。 〖标准答案〗低于40℃,TiO2·xH2O转化率随温度升高而增加;(1分)超过40℃, 双氧水分解与氨气逸出导致转化反应速率下降。(2分) 此问要求考生通过读表,根据已知信息分析40℃时TiO2·xH2O转化率最高的原 因,需要考生进行语言表述,有一定难度。 〖典型问题〗 ①只从平衡角度作答:反应吸热(或ΔH>0),升温,平衡正向移动。 ②答题角度缺失:40度时,反应速率快,分解少。 ③答题角度不对:催化剂活性;或TiO2·xH2O的溶解度。 ④只答一部分:温度高了氨水或者双氧水分解 ⑤没有弄清题意:双氧水受热易分解,太高不好,太低又慢,40度可以。 ⑷ Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 。 〖标准答案〗4(2分) 此问要求考生根据Ti的化合价判断过氧键的数目,有一定难度,正确率较低,说明 考 生运用已有知识分析、解决问题的能力不强。 ⑸若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。 FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22 、1.0×10-24 〖标准答案〗Fe3+恰好沉淀时,c(PO43-)= =1.3×10-17mol/L, c3(Mg2+)·c2(PO43-)值为0.013×(1.3×10-17)=1.7×10-40<Ksp[Mg3(PO4)2],因此不会生成 Mg3(PO4)2沉淀(3分) 此问考查沉淀溶解平衡,要求学生运用Ksp进行计算、分析后作答。 〖典型问题〗 审题不清,没有注意到题干中“设溶液体积增加一倍”这一条件信 息,计算时,镁离子的浓度忘记减半,导致错误。 ⑹ 写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。 〖标准答案〗 2FePO4 + Li2CO3 + H2C2O4 2LiFePO4 + 3CO2↑+ H2O↑ 此问考查陌生化学方程式的书写。 〖典型问题〗元素符号、化学式书写不规范;配平错误;不写气体符号等等。说明 考生书写陌生化学方程式的能力有待于进一步提高。 28题.本题以H2S为载体,从图中获取信息,考查了电解质溶液、盖斯定律的应用及热 化学方程式的书写、化学平衡转化率、化学平衡常数的计算,灵活考查了化学平衡 移 动原理,试题情境及呈现方式新颖,但考查内容较为常规,难度系数不大。 此题总分为14分,平均分为7.93。 28.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号 传递、舒张血管减轻高血压的功能。回答下列问题: ⑴ 下列事实中,不能比较H2S与H2SO3的酸性强弱的是 (填标号)。 A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸 〖标准答案〗D(2分) 该问考查基础知识,要求学生运用电解质溶液的相关知识进行选择。此题难度不大, 但约60%选错,说明考生基础知识掌握不够扎实。 ⑵ 下图是通过热化学循环在较低温度下由水或H2S分解制备氢气的反应系统原理。 通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为: 、 , 制得等量H2所需能量较少的是 。 〖标准答案〗 (I) H2O(l) ===H2(g) + 1/2O2(g) ΔH=286 kJ/mol;(2分) (II)H2S(g) ===H2(g) + S(s) ΔH=20 kJ/mol;(2分) 系统(II)。(1分) 主要考查盖斯定律的应用与热化学方程式的书写,一共三空,题目呈现方式乍看 比较难,但作答并不难。 〖典型问题〗ΔH计算错误;状态写错或不写;单位写错;忘写ΔH;配平不对。反映 出考生基础知识的掌握不牢固。 ⑶ H2S与CO2在高温下发生反应:H2S(g) + CO2(g)COS(g) + H2O(g)。在610 K时, 将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。 ① H2S的平衡转化率= %,反应平衡常数K= 。 ② 在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率 , 该反应的ΔH 0。(填“>”“<”或“=”) ③ 向反应器中再分别充入下列气体,能使H2S转化率增大的是 (填序号) A.H2S B. CO2 C.COS D.N2 〖标准答案〗 ①2.5;(2分) 2.8×10-3;(2分) ②“>,(1分) >”;(1分) ③ B(2分) 该步考查的是化学平衡相关知识,涉及转化率、平衡常数的计算、化学平衡的移动 等 化学主干知识,一共有3小问。 〖典型问题〗 ①第一空是平衡转化率的计算主要问题是审题不清,没有看清楚题干中已经有 “%”,在计算结果加“%”而失分;计算错误等等;另一空是平衡常数的计算, 此题正答率不高,反映出考生计算能力薄弱。 ② 第一空是比较转化率大小,另一空是判断反应是吸热还是放热,正确答案为“>, >”; ③ 考查平衡移动问题,要求考生在四个选项中进行选择,正确答案为B,此小题的 正答率较高。 35.本题是物质结构与性质选做题,以钾和碘的相关化合物为载体,除了第1问考得比较偏 外(紫光的辐射波长),依然重点考查了电子排布式、杂化与空间构型、晶胞的结构及 简单计算,考生选做率为43.7%。第(1)问体现了与物理学科的交叉,(3)①要求考生具有 一定的知识迁移能力,(5)对学生的空间想象能力要求较高。此题分值为15分,平均分为 6.81。考生作答情况分析: 35.[化学——选修3:物质结构与性质](15分) 钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: ⑴ 元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为 nm(填标号)。 A.404.4 B.553.5 C.589.2 D.670.8 E.766.5 一般人的眼睛可以感知的可见光的波长在400~760nm之间。该问体现了学科综合,属于 识记型水平,考察的是物理知识。此题正答率约为35%,好多考生错选E,说明考生对日 常知识的欠缺;也有部分考生审题不认真,写成a,或具体数值404.4。 ⑵ 基态K原子中,核外电子占据最高能层的符号是 ,占据该能层电子的电子云轮廓图形 状为 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸 点等都比金属Cr低,原因是 。 (2)为原子结构基础知识的考查,一共有三空。 第一空正确答案为N。考查的是能层,很多考生错答4s,说明能级与能层知识混淆不清, 基础知识不牢。 第二空正确答案为球形。好多考生错答哑铃形、纺锤形等。原因可能为平时练习导致的负 迁移。 第三空正确答案为:K原子半径较大且价电子数较少,金属键较弱。 考查金属晶体的结构(考纲新增),属于文字表述题,答错率很高。 【典型错误】:①3d能级为半充满状态;②二者均为离子晶体,钾离子半径大于铬离子半 径小,半径越小,晶格能越大,所以,钾的熔沸点比铬低。③铬的相对分子质量大,K 的相对分子质量小,故铬的熔沸点高(从分子晶体的角度作答)。④只写金属键较弱。这些 错误说明考生对于基础知识的掌握还远不扎实,对于知识存在机械记忆,没有从本质上 去理解。 ⑶ X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为 , 中心原子的杂化类型为 。 正确答案为:V 形,sp3。 (3)考查分子离子的空间构型及杂化。第一空比较难,出现的错误答案有:三角锥形、四面 体形、平面三角形等。第二空部分考生不该出现的错误是将3写到下角标的位置,即sp3 导致失分。 ⑷ KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长为a=0.446 nm, 晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为 nm, 与K紧邻的O个数为 。 正确答案:第一空0.315 或;第二空12 ⑸ 在KIO3晶胞结构的另一种表示中,I处于各顶角位置, 则K处于 位置,O处于 位置。 正确答案:第一空为体心;第二空为棱上 (4)和(5)考查的是晶胞结构知识,属于近几年结构题的必考点。此题有一定难度,正答率 不高,说明考生空间想象能力、分析解决问题的能力还有待加强。 36题.是有机化学选做题,考查了有机物的命名,有机反应的类型,有限定条件的同分异构 体的书写(不同于以往的判断同分异构体数目),合成线路的设计。 本题为有机选做题,选做率为56.4%。该题考查较为全面,整体难度不是很大,充分利 用题目所给信息加以分析,主要是正向分析突破。具体考查了有机化合物的名称、基础 反应类型、结构简式、化学方程式、同分异构体的书写及合成路线的设计等知识。对学 生获取信息的能力、分析问题解决问题的能力及设计与创新能力有较高要求。此题分值 为15 分,平均分为6.35。考生作答情况分析: 36.[化学——选修5:有机化学基础](15分) 化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下: 回答下列问题:⑴ A的化学名称为 。 正确答案:苯甲醛。 典型错误:写结构简式;“醛”字写错;写成醛基苯;推断错误,写成苯乙醛、甲苯等。 ⑵ 由C生成D和E生成F的反应类型分别为 、 。 正确答案:加成反应、取代反应(酯化反应)。 考查的是具体的反应类型,正答率较高。但第二空有不少考生写消去反应, 说明基础知 识不够扎实。 ⑶ E的结构简式为 。 正确答案: 。 考查的是E的结构简式,写成以下形式及其他合理形式的给分,如: 很多考生没有推理分析出E中含有炔键。 ⑷ G为甲苯的同分异构体,由F生成H的化学方程式为 。 正确答案为: 考查化学方程式的书写, 典型错误为反应物或产物写错(丢双键) ⑸ 芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出2种符合要求的X的结构简式 ____________ 。 正确答案为: 考查X的结构简式。如果不是键线式,但只要结构简式正确就给分。 ⑹ 写出用环戊烷和2-丁炔为原料制备化合物的合成路线(其他试剂任选)。 正确答案为: 考查有机合成路线,测试考生的综合运用知识的能力与创新能力。 查看更多