- 2021-05-13 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
新课程高考化学一轮复习课后训练化学计算题强化专练三
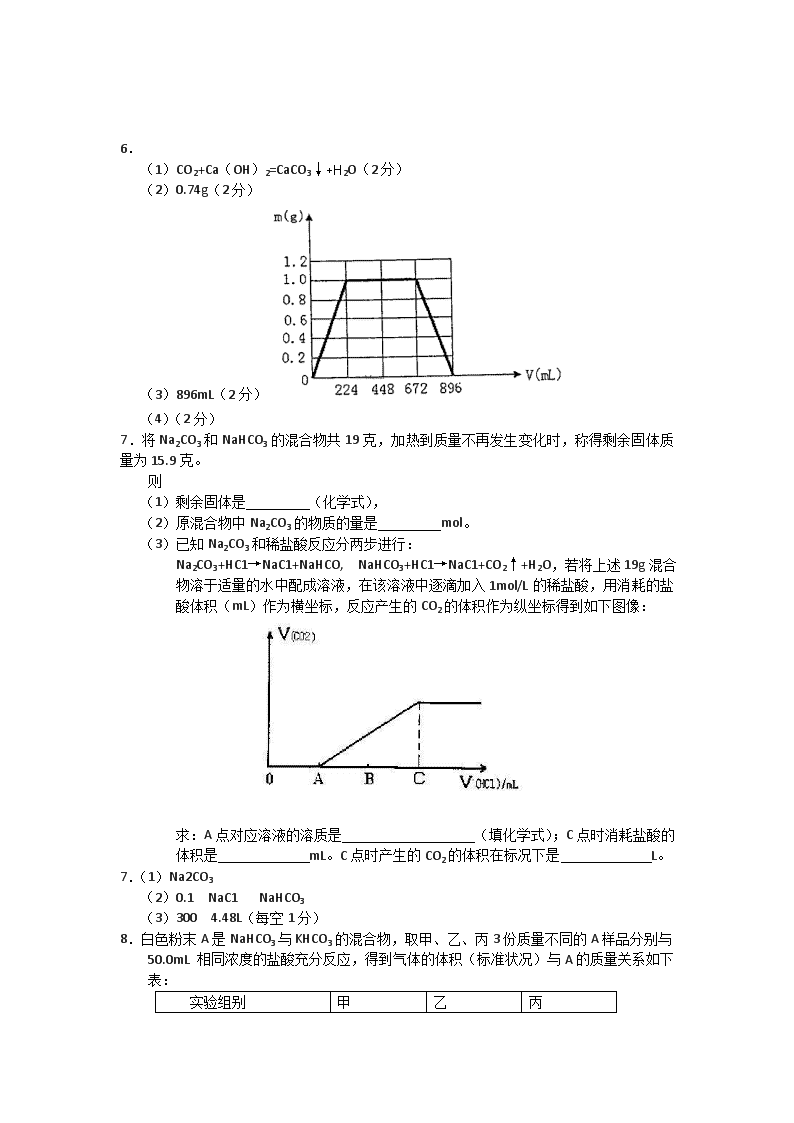
高三化学一轮复习:化学计算题强化专练三 1.(5分)将6g的铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL、0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算: (1)反应后生成铜的质量; (2)原溶液中Fe2(SO4)3的物质的量浓度。 1.(5分)溶液中含有Fe2+:0.5mol/L×0.2L=0.1mol 设Fe2(SO4)3反应消耗铁的物质的量为x,与CuSO4反应消耗铁的物质的量为y Fe+Fe2(SO4)3=3FeSO4 Fe+CuSO4=FeSO4+Cu 1mol 1mol 3mol 1mol 1mol 1mol 1mol xmol xmol 3xmol ymol ymol ymol ymol 可得:3x+y=0.1mol 6g-56x+8y=5.2g 解得x=0.02mol y=0.04mol 故得:生成铜质量为0.04mol×64g/mol=2.56g 原溶液中Fe2(SO4)3的物质的量浓度为 答:(1)反应后生成铜的质量为2.56g。(2)原溶液中Fe2(SO4)3的物质的量浓度为0.1mol/L。 2.(8分)白色粉末A由Na2SO3、Na2SO4 和NaCl等物质中的二种或三种混合而成,取一定量A样品,投入100 mL 2.2 mol·L-1 盐酸中,充分反应后过滤,最终得到100 mL含H+ 的物质的量浓度为1 mol·L-1 的滤液。若将此滤液蒸干,只得到8.19g纯净物B。 (1)B的化学式 ; (2)则所取的A样品中含有的各物质的物质的量分别为 ;该样品与投入的盐酸反应后生成气体的体积为(标准状况) 。 2.(共8分)(1) NaCl(2分) (2)Na2SO3:0.06 mol(2分), NaCl:0.02 mol(2分);1.344 L(2分) 3.(9分)为测定(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同物质的量浓度的NaOH溶液各40.00mL,加热到120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4固体分解的温度均高于200℃],测得有关实验数据如下(标准状况): 实验序号 样品的质量(g) NaOH溶液的体积(mL) 氨气的体积(L) Ⅰ 7.4 40.00 1.68 Ⅱ 14.8 40.00 3.36 Ⅲ 22.2 40.00 1.12 Ⅳ 37.0 40.00 0.00 (1)实验过程中发生的有关反应的离子方程式为 ; (2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为 L; (3)该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 ; (4)欲计算该NaOH溶液的物质的量浓度,应选择第 组数据,由此求得NaOH溶液的物质的量浓度为 。 3.(9分)(1)H++OH—=H2O(1分) NH4++OH—NH3↑+H2O(1分) (2)0.84(2分) (3)1:4 (2分) (4)Ⅲ(1分) 5 mol·L-1 (2分) 4.(10分)在800℃密闭容器中进行反应: CO(g)+H2O(g) CO2(g)+H2(g),若CO的起始浓度为1.0×10-2mol·L-1,水蒸气的起始浓度为3.0×10-2mol·L-1,达到平衡后,实验测得CO2浓度为 7.5×10-3mol·L-1。 (1)计算800℃,1.0×105Pa条件下,上述反应的平衡常数K= 。 (2)800℃,1.0×105Pa条件下,起始时在上述容器中加入1molCI、1molH2O、2molH2、2molCO2,则此反应的初始状态 (填“是”、“否”)为平衡状态;若是平衡状态不必做答,若不是平衡状态,反应将向 (填“正”、“逆”)反应方向进行以达到化学平衡状态。 (3)在800℃,1.0×105Pa条件下,将4molCO和4molH2O投入密闭容器中进行上述反应,达到平衡后,H2的物质的量为a mol,CO的转化率为α,则a= ,α= 。 4.(每空2分,共10分) (1)1 (2)否;逆 (3)2,50% 5.锈铁片(铁锈为氧化铁)置于稀硝酸中,反应结束后收集到1.12LNO(标准状况),溶 液中还剩下4g单质铁。取出铁后,向溶液中通入10.65gCl2,恰好使溶液中Fe2+全部氧化(假设Cl2只与Fe2+反应)。计算: (1)锈铁片中铁单质的质量。 (2)锈铁片中铁锈的质量分数。 5.(1)12.4g (2)49.18g 6.将KOH和Ca(OH)2混合物1.86 g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体。当生成沉淀的质量刚好最大时,消耗CO2的体积为224mL(标准状况,忽略CO2溶于水情况,以下情况相同。) (1)生成沉淀的质量刚好最大时,反应的离子方程式为: 。 (2)原混合物中Ca(OH)2的质量为 g。 (3)沉淀恰好溶解时,消耗CO2的体积为 mL。 (4)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2的体积V(mL)的关系曲线。 6. (1)CO2+Ca(OH)2=CaCO3↓+H2O(2分) (2)0.74g(2分) (3)896mL(2分) (4)(2分) 7.将Na2CO3和NaHCO3的混合物共19克,加热到质量不再发生变化时,称得剩余固体质量为15.9克。 则 (1)剩余固体是 (化学式), (2)原混合物中Na2CO3的物质的量是 mol。 (3)已知Na2CO3和稀盐酸反应分两步进行: Na2CO3+HC1→NaC1+NaHCO, NaHCO3+HC1→NaC1+CO2↑+H2O,若将上述19g混合物溶于适量的水中配成溶液,在该溶液中逐滴加入1mol/L的稀盐酸,用消耗的盐酸体积(mL)作为横坐标,反应产生的CO2的体积作为纵坐标得到如下图像: 求:A点对应溶液的溶质是 (填化学式);C点时消耗盐酸的体积是 mL。C点时产生的CO2的体积在标况下是 L。 7.(1)Na2CO3 (2)0.1 NaC1 NaHCO3 (3)300 4.48L(每空1分) 8.白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙3份质量不同的A样品分别与50.0mL 相同浓度的盐酸充分反应,得到气体的体积(标准状况)与A的质量关系如下表: 实验组别 甲 乙 丙 稀盐酸的体积(mL) 50.0 50.0 50.0 A样品的质量(g) 2.84 5.25 7.00 气体的体积(L) 0.672 0.896 0.896 试计算:(1) 该盐酸的物质的量浓度。 (2) 混合物中NaHCO3的质量分数。 8.(1)0.8mol/L (2)29.6% 9、将10g铁粉置于40mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792L标准状况下的混合气体(NO2、NO),溶液里还残留4.4g固体。 (1)求该反应中被还原的硝酸与未被还原的硝酸的质量比。 (2)求理论上原硝酸的物质的量浓度。 (3)求混合气体中NO2、NO的体积比。 (4)写出上述反应的总的化学方程式。 9、 (1)5:2(3分) (2)7mol/l(2分) (3)1:3(3分) (4) 5Fe +14HN O3=Fe(NO3)2+NO2 +3NO+7 H2O (2分) 10.(6分)将一块金属钠投入到100mLMgCl3和AlCl3的混合溶液中,发现沉淀先多后少。 反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。 则原溶液中Mg的物质的量浓度为 ;Al的物质的量浓度为 。 10.(每空3分,共6分)1mol·L;3mol·L 本资料由《七彩教育网》www.7caiedu.cn 提供!查看更多