- 2021-05-13 发布 |
- 37.5 KB |
- 43页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学模拟调研试题共套
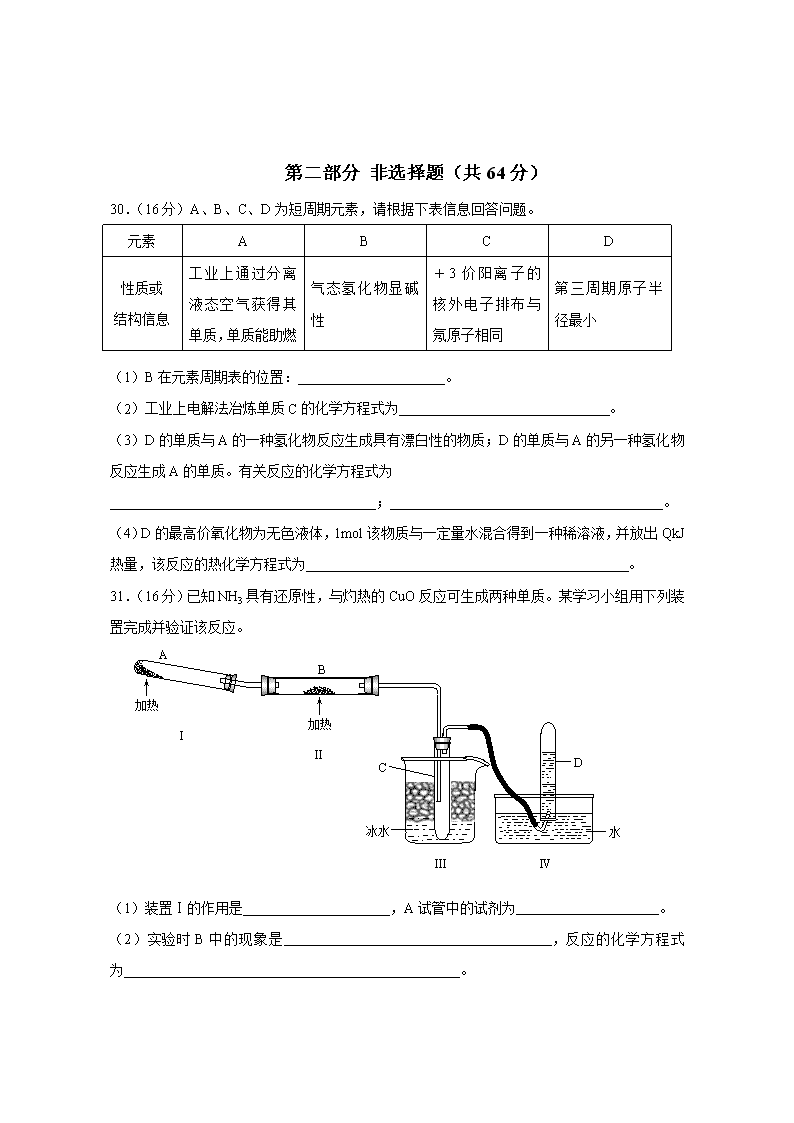
高三调研测试 化 学 第一部分 选择题(共36分) 一、选择题(6小题,共24分,每小题只有一个正确答案,每题4分) 7.华裔科学家高琨因“在光纤传输信息领域中的突破性成就”获得2009年诺贝尔物理学奖,下列有关硅材料的说法正确的是 A.光纤的主要成分是高纯度的单质硅 B.金刚砂的主要成分是二氧化硅 C.28g硅含有6.02×1023个电子 D.28Si、29Si、30Si是不同的核素 8.钢铁在潮湿的空气中会形成原电池而被腐蚀,下列说法正确的是 A.原电池的正极反应为:O2 + 2H2O + 4e-=4OH- B.原电池的负极反应为:Fe-3e-=Fe3+ C.钢铁设备上连接铜块可以防止腐蚀 D.钢铁与外加直流电源的正极相连可以防止腐蚀 9.下列离子方程式正确的是 A.用醋酸除水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑ B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O C.向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2 +2Cl- D.向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O 10.下述实验设计能够达到目的的是 编号 实验目的 实验设计 A 除去CO2中少量的SO2 将混合气体通过饱和Na2CO3溶液 B 除去Cu粉中混有的CuO 向混合物中滴加适量稀硝酸 C 检验溶液中是否含有Fe2+ 向溶液中滴入氯水后,再滴加KSCN溶液 D 证明H2CO3酸性比H2SiO3强 将CO2通入Na2SiO3溶液中 11.下列有关海水资源综合利用的说法正确的是 ①蒸馏法是海水淡化的方法之一 ②海水蒸发制海盐的过程中只发生化学变化 ③从海带提取碘单质的过程涉及氧化还原反应 ④只需经过物理变化就可以从海水中得到钾单质 ⑤海水提溴涉及的反应类型包括复分解反应 A.①②③ B.④⑤ C.①③ D.①②⑤ 12.下列叙述正确的是 A.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-) B.pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7 C.0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比为1︰2 D.中和pH与体积都相同的氨水和Ba(OH) 2溶液,消耗的HCl物质的量之比是1∶2 二、选择题(2小题,共12分,每小题有两个正确答案,每题6分,漏选3分,错选0分) 22.一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2OCH3COOH +OH- 下列说法正确的是 A.加入少量NaOH固体,c(CH3COO-)增大 B.加入少量FeCl3固体,c(CH3COO-)减小 C.稀释溶液,溶液的pH增大 D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 23.把l mol CO2和3mol H2通入l L的密闭容器中,在某温度下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H=–49.0 kJ·mol-1,测得CO2和CH3OH的浓度随时间变化如图所示,下列说法正确的是 CO2 CH3OH t / min 10 3 0 0.25 0.50 0.75 1.00 c / mol·L-1 20090531 A.3 min时, v正=v逆 B.0~10 min内,氢气的平均反应速率为0.225 mol·L-1·min-1 C.该温度下,反应的平衡常数K=5.3 mol-2·L2 D.若升高温度,CO2的平衡转化率大于75% 第二部分 非选择题(共64分) 30.(16分)A、B、C、D为短周期元素,请根据下表信息回答问题。 元素 A B C D 性质或 结构信息 工业上通过分离液态空气获得其单质,单质能助燃 气态氢化物显碱性 +3价阳离子的核外电子排布与氖原子相同 第三周期原子半径最小 (1)B在元素周期表的位置: 。 (2)工业上电解法冶炼单质C的化学方程式为 。 (3)D的单质与A的一种氢化物反应生成具有漂白性的物质;D的单质与A的另一种氢化物反应生成A的单质。有关反应的化学方程式为 ; 。 (4)D的最高价氧化物为无色液体,1mol该物质与一定量水混合得到一种稀溶液,并放出QkJ热量,该反应的热化学方程式为 。 A B C 冰水 D 水 加热 加热 Ⅰ Ⅱ Ⅲ Ⅳ 31.(16分)已知NH3具有还原性,与灼热的CuO反应可生成两种单质。某学习小组用下列装置完成并验证该反应。 (1)装置Ⅰ的作用是_____________________,A试管中的试剂为 。 (2)实验时B中的现象是 ,反应的化学方程式为 。 (3)设计装置Ⅲ的目的是: 。 (4)指出装置中不完善的地方(指出一处): 。 32.(16分)某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。 实验编号 反应物 催化剂 ① 10mL2% H2O2溶液 无 ② 10mL5% H2O2溶液 无 ③ 10mL5% H2O2溶液 1mL0.1mol·L-1FeCl3溶液 ④ 10mL5% H2O2溶液+少量HCl溶液 1mL0.1mol·L-1FeCl3溶液 ⑤ 10mL5% H2O2溶液+少量NaOH溶液 1mL0.1mol·L-1FeCl3溶液 (1)催化剂能加快化学反应速率的原因是_ 。 (2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 。 (3)实验①和②的目的是__________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是 。 (4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 t 0 O2的体积 ③ ④ ⑤ 分析上图能够得出的实验结论是 。 33.(16分)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产 CuCl2·2H2O的工艺流程如下: 废渣 粉碎 NaCl 焙烧 空气 酸浸 调节pH至3~4 滤渣 过滤 CuCl2·2H2O …… 废气 盐酸 试剂A 滤液B 回答下列问题: (1)焙烧过程中发生的主要反应为: CuS+ NaCl+ O2 CuCl2+ Na2SO4。配平上述化学方程式。 (2)试剂A应选用 。(填编号) ①NaClO ②Cl2 ③H2O2溶液 ④浓硫酸 理由是 。 (3)滤液B中大量含有的离子有 。 温度 /℃ CuCl2 Na2SO4 (4)为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是_________________,“冷却结晶”过程中,析出CuCl2·2H2O晶体的合适温度为 。 溶解度/g 答案: 7、D 8、A 9、B 10、D 11、C 12、B 22、AB 23、BC 30.(16分) 电解 冰晶石 (1)第二周期VA族 (3分) (2)2Al2O3(熔融)===== 4Al+3O2↑ (3分) (3)Cl2+H2O=HCl+HClO (3分) Cl2+H2O2=2HCl+O2 (3分) (4)Cl2O7(l)+H2O(l)=2HClO4(aq) ΔH=-Q kJ·mol-1 (4分) 31.(16分) (1)制备氨气 (2分) NH4Cl和Ca(OH)2 (2分) (2)黑色粉末变成红色 (2分) 2NH3+3CuO3Cu+N2+3H2O (3分) (3)冷凝产物水 (4分) (4)装置Ⅰ和Ⅱ之间缺少干燥装置;装置Ⅲ和Ⅳ之间缺少安全瓶(指出一处即可) (3分) 32.(16分) (1)降低了活化能(3分) (2)H2O2H++HO2-(3分) (3)探究浓度对反应速率的影响 (3分) 向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)(3分) (4)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (4分) 33.(16分) (1)1 2 2 1 1(2分) (2)① (2分) NaClO能将Fe2+氧化为Fe3+,且溶液显碱性,能增大溶液pH使Fe3+ 沉淀(3分) (3)Cu2+、Na+、Cl-、SO42- (3分) (4)硫酸钠 (3分) 32℃(30~35℃不扣分) (3分) 30. (1)______________________________________。 (2)___________________________________________________。 (3)____________________________________;____________________________________。 (4)_________________________________________________________________。 31. (1)__________________________________,_______________________________________。 (2)__________________________________________________________, __________________________________________________________。 (3)__________________________________________________________。 (4)___________________________________________________________________________。 32. (1)__________________________________________________________。 (2)__________________________________________________________。 (3)__________________________________________________________。 ___________________________________________________________________________。 (4)___________________________________________________________________________ ___________________________________________________________________________。 33. (1) CuS+ NaCl+ O2 CuCl2+ Na2SO4 (2)_________________。________________________________________________________ __________________________________________________________________________。 (3)_______________________________________________。 (4)________________________,_____________________。 高中毕业班综合测试(二) 化 学 一、单项选择题 7.下列实验操作正确的是 A.过滤时,用玻璃棒搅拌漏斗中的液体以加快过滤速度 B.中和滴定过程中,应注视锥形瓶内溶液颜色的变化,以准确把握滴定终点 C.配制0.1mol·L-1H2SO4溶液时,将量取的浓H2SO4注入容量瓶中加水稀释 D.测定溶液的pH时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上,再与标准比色卡对照 8.下列说法错误的是 A.硅胶疏松多孔,可用作催化剂的载体 B.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 C.纯净的二氧化硅是制造光导纤维的基本原料 D.氮的固定只有在高温、高压、催化剂的条件下才能实现 莽草酸 9.莽草酸可用于合成甲型流感药物——达菲。下列关于莽草酸的叙述正确的是 A.能与氯化铁溶液发生显色反应 B.能发生消去反应生成苯甲酸 C.能使溴的四氯化碳溶液褪色 D.能发生银镜反应 10.下列关于主族元素的叙述正确的是 A.146C和147N的质量数相同,中子数不同 B.2814Si和2914Si的质子数相同,是同一种核素 C.Na和K属于ⅠA族元素,Na的金属性比K强 D.Cl和Br属于ⅦA族元素,其核外电子数之差为8 11. I2在KI溶液中存在下列平衡:I2(aq) +I-(aq) I3-(aq)。测得不同温度下该反应的平衡常数K如下表: t/℃ 5 15 25 35 50 K 1100 841 680 533 409 下列说法正确的是 A.反应I2(aq) +I-(aq)I3-(aq)的△H>0 B.其他条件不变,升高温度,溶液中c(I3-)减小 C.该反应的平衡常数表达式是K= D. 25℃时,向溶液中加入少量KI固体,平衡常数K小于680 12.某种氢氧燃料电池的电解液是热的KOH溶液,在正极上氧气被还原,在负极上氢气被氧化,下列有关该电池的叙述正确的是 A.负极反应式为:H2+2OH-- 2e-=2H2O B.正极反应式为:O2+4H++4e-=2H2O C.工作一段时间,KOH溶液的浓度不变 D.电池工作时,电子由正极通过外电路流向负极 二、双项选择题 22.下列说法正确的是 A.pH=3的醋酸溶液中c(H+)=1×10-3mol·L-1 B.称取25gCuSO4·5H2O固体溶于75g水中,所得溶液中溶质的质量分数为25% C.1molCl2与足量Fe反应,转移的电子为2mol D.0.2molSO2和0.1molO2在一定条件下反应,达到平衡时生成0.2molSO3 23.下列关于0.1 mol·L-1氯化铵溶液的说法正确的是 A.溶液中离子浓度关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.向溶液中加入适量氨水使混合液的pH=7,混合液中c(NH4+)>c(Cl-) C.向溶液中加滴加几滴浓盐酸,c(NH4+)减少 D.向溶液中加入少量CH3COONa固体,c(NH4+)减少 非选择题 30.某Al2O3样品中可能含有Fe2O3和FeO中的一种或两种。利用实验室常用试剂、仪器和用品完成该样品中所含杂质成分的探究。 (1)请在答题卡上按下表的格式写出实验步骤、预期现象与结论。 实验步骤 预期现象与结论 步骤1:取少量样品于试管A中,加入过量NaOH溶液,充分反应后,静置,弃去上层清液,剩余固体备用。 样品部分溶解。 步骤2:往试管A的剩余固体中加入适量稀H2SO4,充分反应后得A溶液。 固体溶解,溶液颜色有变化。 (2)步骤1中反应的离子方程式是 (3)步骤2中所用的硫酸必须煮沸除去溶于其中的氧气,目的是 。 31.工业炼镁排放大量废渣,其主要成分是MgCl2、KCl和少量MgO、BaCl2、FeCl3、CuCl2。利用该废渣生产硫酸镁和光卤石(KCl·MgCl2·6H2O)的工艺流程如下: 废渣 破碎 酸浸 过滤 ①MgO 调pH至7 ②氨水 过滤 蒸发浓缩 冷却结晶 硫酸镁 过滤 光卤石 … 滤渣1 滤渣2 过量H2SO4 沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2 pH 3.2 6.7 12.4 部分阳离子以氢氧化物的形式完全沉淀时溶液的pH见上表,请回答下列问题: (1)调pH至7的目的是 。 (2)调节pH的过程中,MgO发生反应的离子方程式为 。 (3)实验室进行“蒸发浓缩”时要用到的硅酸盐质仪器有____________________________。 m /g 0 200 800 T/℃ Mg(OH)2;Mg(OH)Cl;KCl 固体A 555 483 400 600 1000 光卤石(KCl·MgCl2·6H2O) MgCl2·xH2O;KCl (4)光卤石在一定压力下受热分解,剩余 固体成分及质量(m)随温度(T) 变化情况如图。 ①图中固体A的成分是 ; ②图中x=_______。 (相对原子质量:H 1 O 16 Mg 24 Cl 35.5 K 39 ;相对分子质量:KCl.MgCl2.6H2O 277.5) 32.(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。 (2)已知NaHSO3的水溶液显酸性,比较其中SO2-3 、HSO-3、H2SO3三种粒子的浓度,最大的是 ,最小的是 。 (3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。 (4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是 A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变 B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3 C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零 33.香草醛是食品添加剂的增香原料,可由丁香酚经以下反应合成香草醛。 CH2CH=CH2 OH OCH3 CH=CHCH3 OH OCH3 CH=CHCH3 OOCCH3 OCH3 CHO OOCCH3 OCH3 CHO OH OCH3 ①NaOH 一定条件 ②(CH3CO)2O K2Cr2O7/H+ H2O / H+ 丁香酚 香草醛 Ⅰ Ⅱ Ⅲ (1)写出香草醛分子中含氧官能团的名称 (任意写两种)。 (2)下列有关丁香酚和香草醛的说法正确的是 。 A.丁香酚既能发生加成反应又能发生取代反应 B.香草醛中的—OH能被酸性K2Cr2O7氧化 C.丁香酚和化合物Ⅰ互为同分异构体 D.1 mol香草醛最多能与3 mol氢气发生加成反应 (3)写出化合物Ⅲ—→香草醛的化学方程式 。 CHO OH OC2H5 图a COOH OCH3 图b (4)乙基香草醛(其结构见图a)也是食品添加剂的增香原料,它的一种同分异构体A属于酯类。A在酸性条件下水解,其中一种产物的结构见图b。A的结构简式是 。 化学参考答案 选择题部分答案: 题号 7 8 9 10 11 12 22 23 答案 B D C A B A AC AD 30.(16分) (1)(10分) 实验步骤 预期现象及结论 若溶液变为血红色,说明原样品中有Fe2O3 步骤3:取少量A溶液于试管B中,滴加几滴KSCN溶液,振荡。 ;若溶液颜色没有明显变化,说明原样品中不含 Fe2O3。 步骤4:取少量A溶液于试管C中,滴加几滴酸性KMnO4溶液,振荡。 若溶液的紫红色褪去,说明原样品中含有FeO;若溶液的紫红色不褪色,说明原样品中没有FeO。 说明:检验出Fe2O3得5分,检验出FeO得5分(其它合理答案也可得分,如用黄色K3[Fe(CN)6](铁氰化钾)检验Fe2+) (2)Al2O3 +2OH-=2AlO2-+H2O(3分) (3)防止Fe2+被氧化(3分) 31. (16分) (1)除去Fe3+和Cu2+(4分) (2)MgO +2H+=Mg2++H2O(3分) (3)蒸发皿、玻璃棒、酒精灯(3分,各1分) (4)MgO(2分)、KCl(2分),4(2分) 32. (16分) (1)H2SO4、H2SO3(2分); SO2+Na2SO3+H2O=2NaHSO3(3分) (2)HSO3-(2分),H2SO3(2分) (3)0.05mol (3分) (4)B C (各2分,共4分) 33.(16分) (1)醛基、酚羟基、醚键 (写出其中两个得分,各2分,共4分) (2)A、B、C (4分) H+ + H2O + CH3COOH CHO OOCCH3 OCH3 CHO OH OCH3 (3) (4分) OCH3 COOCH3 (4) (4分) 试卷类型:A 普通高中毕业班综合测试(一) 化 学 一、单项选择题(每小题给出的四个选项中,只有一个选项符合题目要求,6题,每题4分,共24分) 7.下列制备和收集气体的实验装置合理的是 A.用氯化铵和氢氧化钙制NH3 B.用铜片和稀硝酸制NO C.用锌粒和稀硫酸制H2 D.用双氧水和二氧化锰制O2 8.下列关于有机物的叙述正确的是 A.石油液化气、汽油和石蜡的主要成分都是碳氢化合物 B.1,2-二氯乙烷在NaOH水溶液中发生消去反应得到乙炔 C.由CH2=CH-COOCH3合成的聚合物为CH2-CH-COOCH3n D.能与NaOH溶液反应且分子式为C2H4O2的有机物一定是羧酸 9.下列说法正确的是 ①CH3COONa、BaSO4都是强电解质;②硬铝、碳素钢都是合金材料;③合成纤维、光导纤维都是有机高分子化合物;④ 0.1mol·L-1NaOH溶液与0.1mol·L-1Ba(OH)2溶液的pH相同;⑤适量CO2分别通入饱和碳酸钠溶液和澄清石灰水中,都会出现浑浊。 A.①②④ B.①②⑤ C.②③⑤ D.③④⑤ 10.下列叙述正确的是 A.氯水中通入SO2后溶液的酸性减弱 B.向明矾溶液中加入过量NaOH溶液会产生大量白色沉淀 C.Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 D.浓硫酸、浓硝酸在加热条件下都能将木炭氧化为二氧化碳 11.下列说法正确的是 A.铅蓄电池放电时铅电极发生还原反应 B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠 C.给铁钉镀铜可采用CuSO4作电镀液 D.生铁浸泡在食盐水中发生析氢腐蚀 2 0 V (盐酸) / mL 20 10 30 6 4 8 10 12 pH V (盐酸) / mL 2 0 20 10 30 6 4 8 10 12 pH 2 0 V (盐酸) / mL 20 10 30 6 4 8 10 12 pH 2 0 V (盐酸) / mL 20 10 30 6 4 8 10 12 pH 12.向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是 A B C D 二、双项选择题(每小题给出的四个选项中,有两个选项符合题目要求,2题,每题6分,共12分,全选对得6分,只选1个且正确得3分,错选、不选得0分) 22.下列化学反应的离子方程式正确的是 A.向FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ B.向酸性碘化钾溶液中滴入双氧水:2I-+2H+ +H2O2=I2+2H2O C.NaOH溶液中通入少量二氧化硫:SO2 + 2OH- = SO32- + H2O D.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O 23.元素X、Y、Z原子序数之和为36,Y、Z在同一周期,X、Z在同一主族,X原子最外层电子数是Y原子最外层电子数的3倍。下列说法正确的是 A.同主族元素中X的气态氢化物最稳定 B.Z的最高价氧化物对应的水化物化学式为H3ZO4 C.X与Y可形成共价化合物 D.X与Z所形成的化合物属于酸性氧化物 非 选 择 题 30.(16分)某研究小组测定菠菜中草酸及草酸盐含量(以C2O42-计),实验步骤如下: ①将菠菜样品预处理后,热水浸泡,过滤得到含有草酸及草酸盐的溶液。 ②调节溶液的酸碱性,滴加足量CaCl2溶液,产生白色沉淀;加入足量醋酸,使CaCO3溶解;过滤得到CaC2O4固体。 ③用稀HCl溶解CaC2O4,并加水配制成100mL溶液。每次准确移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,平均消耗标准溶液VmL。 回答下列问题: (1)步骤①中“样品预处理”的方法是 。(A.灼烧成灰 B.研磨成汁) (2)步骤②中“调节溶液的酸碱性”至 。(A.弱碱性 B.弱酸性 C.中性) 验证CaCl2溶液已“足量”的操作和现象是: 。 (3)步骤③中用到的玻璃仪器除烧杯、锥形瓶、胶头滴管、玻璃棒外,还有 。 (4)经计算,该菠菜样品中C2O42-的总物质的量为____________;若样品的质量为m g,则菠菜中草酸及草酸盐(以C2O42-计)的质量分数为_________________。(已知: 2MnO4-+5C2O42-+16H+===2Mn2++10CO2↑+8H2O,C2O42-的摩尔质量为88g·mol-1) 31.(17分)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应: ① CO(g) + 2H2(g) CH3OH(g) △H1=-91 kJ·mol-1 ② 2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2=-24 kJ·mol-1 ③ CO(g)+ H2O(g) CO2(g) + H2(g) △H3=-41kJ·mol-1 回答下列问题: (1)新工艺的总反应为3CO(g)+3H2(g)CH3OCH3(g)+CO2(g) △H 该反应△H=_____________,平衡常数表达式K=__________________。 (2)增大压强,CH3OCH3的产率 (填“增大”、“减小”或“不变”)。 CO的 转 化 率 /% 200 220 240 260 280 300 T /℃ 100 90 80 70 60 图12 (3)原工艺中反应①和反应②分别在不同的反应器中进行,无反应③发生。新工艺中反应③的发生提高了CH3OCH3的产率,原因是 。 (4)为了寻找合适的反应温度,研究者进行了一 系列试验,每次试验保持原料气组成、压强、 反应时间等因素不变,试验结果如图12。 CO转化率随温度变化的规律是___________ __________,其原因是 。 32.(16分)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。工业上制备K2FeO4的常用方法有两种。 方法Ⅰ:次氯酸盐氧化法,工艺流程如图13。 40%NaOH K2FeO4固体 NaOH NaClO NaCl固体 FeCl3溶液 滤液 饱和KOH溶液 转化 氧化 除杂 过滤 过滤 冷冻 结晶 图13 (1)完成“氧化”过程中反应的化学方程式: ____FeCl3+____NaOH+____NaClO → ____ Na2FeO4+____d +____d 其中氧化剂是 (填化学式)。 (2)“转化”过程中发生反应的化学方程式为 。 (3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用__________溶解,然后____________________________________________。 方法Ⅱ:电解法。以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH。 (4)电解时阳极发生反应生成FeO42-,该电极反应方程式为__________________。 33.(15分)化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过图14所示方法合成: Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ 一定条件 ① 一定条件 ② ③ 一定条件 ③ 回答下列问题: (1)化合物Ⅰ的核磁共振氢谱显示其分子中含有 种处于不同化学环境的氢原子。 (2)化合物Ⅱ的合成方法为: 肉桂酸 A +(CH3CO)2O → -CH=CHCOOH+CH3COOH Cl-S-Cl ‖ O -CH=CHCOOH 化合物Ⅱ 合成肉桂酸的反应式中,反应物的物质的量之比为1︰1。反应物A的结构简式是 ,名称是 。 (3)反应①属于 (填反应类型)。化合物Ⅰ和Ⅱ反应还可以得到一种酯,该酯的结构简式是__________________。 (4)下列关于化合物Ⅴ的说法正确的是 (填序号)。 a.分子中有三个苯环 b.难溶于水 c.使酸性KMnO4溶液褪色 d.与FeCl3发生显色反应 高中毕业班综合测试(一) 理科综合化学参考答案 选择题: 题号 7 8 9 10 11 12 22 23 答案 D A B D C B BC AD 非选择题: 30.(16分) (1)B (2分) (2)A (2分) 静置,待上次溶液澄清后继续滴加CaCl2溶液,不出现浑浊(4分) 8.8×10-3 V m (3)酸式滴定管、容量瓶(4分) (4)10-4V mol (2分) ×100% (2分) c(CH3OCH3) ·c (CO2) 31.(17分) c 3(CO) ·c 3(H2) (1)-247 kJ.mol-1 (3分) (3分) (2)增大 (3分) (3)反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。(4分) (4)低于240℃时,温度越高,CO的转化率越大;高于240℃时,温度越高,CO的转化率越小 (2分) 温度较低时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,温度越高反应速率越大,CO的转化率也越大;温度较高时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,温度升高平衡逆向移动,故温度越高CO的转化率越小;(2分) 32.(16分) (1)2FeCl3+10NaOH+3NaClO =2Na2FeO4+9NaCl+5H2O(4分) NaClO(2分) (2)Na2FeO4+KOH=K2FeO4+NaOH (2分) (3)稀KOH溶液(2分) 再加入饱和KOH溶液,冷冻结晶(3分) (4)Fe+8OH--6e-= FeO42-+4H2O (3分) 33(15分) (1)4(3分) (2) -CHO(2分),苯甲醛(2分) (3)取代反应(2分), (3分) (4)b、c、d(3分) 高三二模试题 一、单项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意) 7.下列有关127 53I和131 53I说法,正确的是 A.127 53I和131 53I的核外电子数不同 B.127 53I和131 53I的中子数分别为127和131 C.127 53I和131 53I互为同位素 D.127 53I和131 53I是同一种核素 8.下列各组离子一定能大量共存的是 A.在强碱性溶液中: NH4+、Ag+、NO3-、I- B.在pH=12的溶液中:Na+、K+、AlO2-、CO32- C.在c(H+)=0.1 mol·L-1的溶液中:Ca2+、Fe2+、ClO-、Cl- D.在强酸性溶液中:Mg2+、Al3+、HCO3-、SO42- 9.设nA为阿伏加德罗常数的数值,下列说法正确的是 A.常温常压下,16g CH4含有CH4分子数为nA B.常温常压下,22.4L CO2含有CO2分子数为nA C.1mol Na燃烧生成Na2O2失去的电子数为2nA D.0.5mol·L-1 的CuCl2溶液中含Cl-数为 nA 10.甲、乙、丙、丁四种元素位于同一短周期,原子序数依次增加。下列判断正确的是 A.原子半径:甲<乙<丙 B.最外层电子数:丙>丁 C.若甲、乙、丙均是金属,则氢氧化物碱性:甲<乙<丙 D.若乙的最高价含氧酸为强酸,则丙是活泼非金属元素 11.下列说法正确的是 A.乙烯和苯都能使酸性KMnO4溶液褪色 B.乙醇和乙醛均能发生氧化反应生成乙酸 C.淀粉和聚乙烯都是天然高分子化合物 D.油脂水解的产物是氨基酸和甘油 12.关于常温下pH=3的醋酸溶液,下列叙述正确的是 A.加水稀释10倍后,pH=4 B.加水稀释后,溶液中c(H+)和c(OH-)均减少 C.加入醋酸钠晶体后,溶液的pH增大 D.加入等体积、pH=11的NaOH溶液后,c(Na+)= c(CH3COO-) 二、双项选择题(本题包括2小题,每小题6分,共12分。每小题有两个选项符合题意。若只选一个且正确得3分,但只要选错就得0分) 22.下列有关实验操作的叙述正确的是 A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度 B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 C.用CC l4萃取碘水中的I2时,有机层从分液漏斗的下端放出 D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液 碳棒 铁片 直流电源 23.如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是 A.碳棒接直流电源的负极 B.碳棒上发生氧化反应 C.铁片上的电极反应式为2Cl――2e- = Cl2↑ D.铁片附近出现的浑浊物是Mg(OH)2 ② ③ H2O ④ ⅠⅡⅢⅣⅤⅥⅦ Ⅴ CH2=CH-COOCH3 ① Ⅱ Ⅲ Ⅳ O2 30.(16分)化合物Ⅴ的合成路线如下(反应条件、部分生成物省略): (1)化合物Ⅰ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2 。 (2)反应①的化学方程式为________________________(不要求注明反应条件)。 (3)下列说法正确的是____________(双选,填字母)。 A.化合物Ⅰ~Ⅴ均属于芳香烃衍生物 B.反应③属于加成反应 C.化合物Ⅲ和化合物Ⅴ均能使溴的四氯化碳溶液褪色 D.化合物Ⅴ能与NaOH溶液反应 (4)反应②还会生成化合物Ⅲ的同分异构体,该同分异构体的结构简式为__________。 (5)该合成工艺中可以循环利用的有机物是_____________________。 31.(16分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。 (1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母) A.所需的活化能很高 B.吸收的能量很多 (2)在不同温度下,反应N2(g)+O2(g)2NO(g)的平衡常数K如下表: 温度/℃ 1538 1760 2404 平衡常数K 0.86×10-4 2.6×10-4 64×10-4 N2的转化率/% 时间/min 1538℃ ①该反应的△H 0。 (填“>”、“=”或“<”) ②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。 (3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应 N2(g)+O2(g)2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) 32.(16分)活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下: 氧化锌粗品 H2SO4 溶解 滤渣 产品 滤液 Na2CO3 煅烧 除杂 滤液 沉淀 滤渣 一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表: 沉淀物 Fe(OH)3 Cu(OH)2 Zn(OH)2 Fe(OH)2 pH 3.2 6.7 8.0 9.7 (1)“溶解”前将氧化锌粗品粉碎成细颗粒,目的是_____________________________。 (2)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入___________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009mol·L-1,则每升溶液中至少应加入__________mol KMnO4。 (3)杂质Cu2+可利用置换反应除去,应选择的试剂是___________。 (4)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500℃下进行,“煅烧”反应的化学方程式为_____________________________________。 33.(16分)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ FeSO4 (1)装置Ⅱ的试管中不装任何试剂,其作用是_______________________,试管浸泡在50℃的水浴中,目的是________________________________。 (2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。 限选试剂:3 mol·L-1 H2SO4、6 mol·L-1 NaOH、0.5 mol·L-1 BaCl2、0.5 mol·L-1 Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。 检验试剂 预期现象和结论 装置Ⅲ的试管中加入________________。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中加入________________。 ______________________________ ______________________________ ______________________________ ______________________________ (3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是 。 高中毕业班综合测试(二)参考答案 理科综合-化学 7.C 8.B 9.A 10.D 11.B 12.C 22.AC 23.BD 30.(16分) (1)C7H14O (2分) 10 (2分) + O2 2 2 + 2H2O (2) (3分) (3)BD (4分) (4) (3分) (5) (2分) 31.(16分) N2的转化率/% 时间/min 1538℃ 1760℃ 2404℃ (1)A(2分) (2)① > (3分) ② (4分) (3) 设NO的平衡浓度为x N2(g) + O2(g) 2NO(g) 起始时各物质浓度/ mol·L-1: 2.6 2.6 0 c2(NO) c(N2)·c(O2) K= = =64×10-4 (2分) x=0.20 mol·L-1 (3分) x2 (2.6-x/2)2 平衡时各物质浓度/ mol·L-1 2.6-x/2 2.6-x/2 x (2分) 32.(16分) (1)增大固液接触面积,加快溶解时的反应速率(4分) (2)Na2CO3(2分) 0.003 (3分) (3)锌粉 (3分) ZnCO3·2Zn(OH)2·H2O 3ZnO + CO2↑+ 3H2O↑ 450~500℃ (4) (4分) 33.(16分) (1)防止溶液倒吸入装置Ⅰ(2分) 防止SO3液化或凝固(2分) (2)(10分) 检验试剂 预期现象和结论 装置Ⅲ的试管中装有BaCl2溶液。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中装有酸性KMnO4溶液。 若溶液紫色褪去,证明气体产物中含有SO2; 若溶液紫色无明显变化,证明气体产物中不含SO2; 或: 检验试剂 预期现象和结论 装置Ⅲ的试管中装有BaCl2溶液。 产生大量白色沉淀,证明气体产物中含有SO3。 装置Ⅳ的试管中装有溴水。 若溴水橙色褪去,证明气体产物中含有SO2; 若溴水橙色无明显变化,证明气体产物中不含SO2; (3)NaOH溶液 (2分) 高考化学模拟试题 一、单项选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)7.Se是人体必需微量元素,下列有关Se和Se的说法正确的是 A.Se 和Se的核外电子数不同 B.Se 和Se的中子数分别为78和80 C.Se 和Se的质量数不同,是同种元素 D.Se 和Se的质子数相同,是同一种核素 8.已知下列数据: Fe(s)+O2(g) = FeO(s) △H=-272 kJ·mol-1 2Al(s)+O2(g) = Al2O3(s) △H=-1675 kJ·mol-1 则2Al(s) +3FeO(s) = Al2O3(s) + 3Fe(s)的△H是 A.+859 kJ·mol-1 B.-859 kJ·mol-1 C.-1403 kJ·mol-1 D.-2491 kJ·mol-1 9.下列有关金属及其化合物的说法正确的是 A.Mg和Al都可以用电解法冶炼得到 B.Na2O和Na2O2与CO2反应产物相同 C.MgO和Al2O3均只能与酸反应,不能与碱反应 D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱 10.下列化学反应的离子方程式正确的是 A.向氨水中滴加氯化铝溶液:Al3++4OH-=AlO2-+2H2O B.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ C.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OH-=CO32-+H2O D.氢氧化钡溶液与稀硫酸反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O 11.下列关于离子检验的说法中,正确的是 A.向某溶液中加入澄清石灰水,溶液变浑浊,该溶液一定含有CO32- B.向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- C.向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,该溶液中一定含有SO42- D.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ 12.设nA为阿伏加德罗常数的数值,下列说法正确的是(相对原子质量:O 16 Mg 24) A.常温常压下,16g O3气体含有氧原子数为nA B.标准状况下,44.8 L四氯化碳含有的分子数为2nA C.0.1mol·L-1 氯化铝溶液中含有Al3+数为 0.1 nA D.2.4g金属镁变为镁离子时失去的电子数为0.1nA 二、双项选择题(本题包括2小题,每小题6分,共12分。每小题有两个选项符合题意。若只选一个且正确得3分,但只要选错就得0分) 22.根据下表信息,判断以下叙述正确的是 部分短周期元素的原子半径及主要化合价 元素代号 G L M Q R T 原子半径/nm 0.186 0.160 0.143 0.104 0.075 0.066 主要化合价 +1 +2 +3 +6、-2 +5、-3 -2 A.氢氧化物碱性:G查看更多