- 2021-05-13 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2008高考化学复习 碳族元素 无机非金属材料
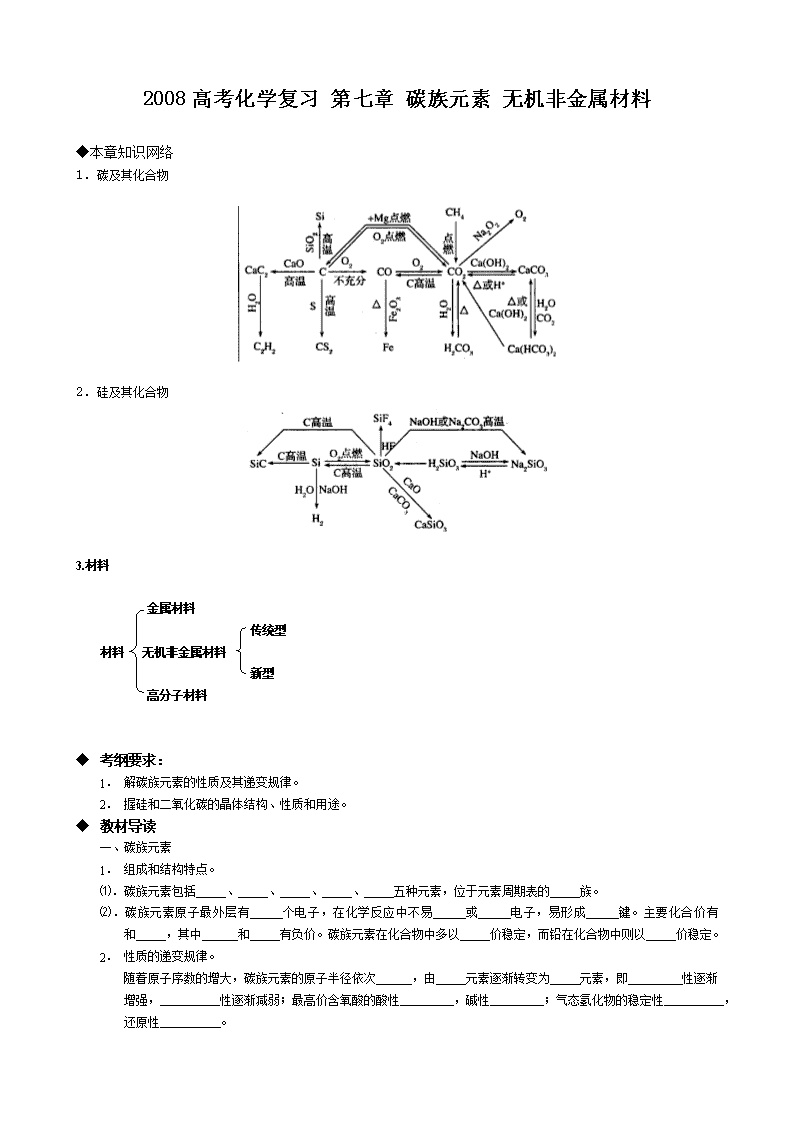
2008高考化学复习 第七章 碳族元素 无机非金属材料 ◆本章知识网络 1.碳及其化合物 2.硅及其化合物 3.材料 金属材料 传统型 材料 无机非金属材料 新型 高分子材料 ◆ 考纲要求: 1. 解碳族元素的性质及其递变规律。 2. 握硅和二氧化碳的晶体结构、性质和用途。 ◆ 教材导读 一、碳族元素 1. 组成和结构特点。 ⑴.碳族元素包括 、 、 、 、 五种元素,位于元素周期表的 族。 ⑵.碳族元素原子最外层有 个电子,在化学反应中不易 或 电子,易形成 键。主要化合价有 和 ,其中 和 有负价。碳族元素在化合物中多以 价稳定,而铅在化合物中则以 价稳定。 2. 性质的递变规律。 随着原子序数的增大,碳族元素的原子半径依次 ,由 元素逐渐转变为 元素,即 性逐渐增强, 性逐渐减弱;最高价含氧酸的酸性 ,碱性 ;气态氢化物的稳定性 ,还原性 。 二、硅和二氧化碳 1. 硅 ⑴.硅的存在和结构及主要物理性质 ①在自然界中的硅全部以 态存在,是构成 和 的主要成分。在地壳中硅的含量在所有元素中居 位,仅次于 。 ②单质硅有 和 两种,其中 的结构类似于金刚石,属于 晶体,空间结构为 。 ③晶体硅是 色,有 光泽,硬度 ,熔沸点 ,是良好的 材料。 ⑵.硅的化学性质 常温下化学性质 ,只能与 、 和 反应。 写出以上反应的化学方程式 、 、 。 ⑶.高纯硅的制法 ① SiO2 + C (粗制硅) ② Si + 2Cl2SiCl4 ③ SiCl4 + 2H2Si + 4HCl 2.二氧化硅 ⑴.晶体结构 ,硬度 ,熔沸点 , 导电, 溶于水。 ⑵.化学性质 ①与碱性氧化物、强碱等反应 CaO: Na2CO3: NaOH: ②与HF的反应: C: ③氧化性:与 Mg: ⑶用途:制造 、 、 的原料和建筑材料。 ◆ 要点解读 一、硅的特殊性 1.硅的还原性比碳强,而碳在高温下却能从二氧化硅中还原出硅。 SiO2 + 2CSi + 2CO↑ 2.非金属单质一般不与弱氧化性酸反应,而硅不但能与氢氟酸反应,而且还有H2生成。 Si + 4HF==== SiF4↑ + 2H2↑ 3.非金属单质与强碱溶液反应一般不生成氢气,而硅却不然。 Si + 2NaOH + H2O==== Na2SiO3 + 2H2↑ 4.虽然SiO2是硅酸的酸酐,但却不能用SiO2与水反应制备硅酸,而只能用可溶性硅酸盐跟酸作用来制备。 5.酸性氧化物一般不与酸反应(除氧化还原反应外),而二氧化硅却能与氢氟酸反应。 6.非金属氧化物一般是分子晶体,而二氧化硅却是原子晶体。 7.无机酸一般易溶于水,而硅酸和原硅酸却难溶于水。 二、二氧化硅与干冰对比 物质 二氧化硅 干冰 化学式 SiO2 CO2 晶体类型 原子晶体 分子晶体 主要物理性质 硬度大、熔沸点高、常温下为固体,不溶于水 熔沸点低,常温下为气体,微溶于水 化学性质 ①与水反应 不反应 CO2 + H2O H2CO3 ②与酸反应 SiO2 + 4HF==SiF4↑ + 2H2O 不反应 ③与碱反应 SiO2 + 2NaOH==Na2SiO3 + H2O盛碱液的试剂瓶用橡皮塞 CO2 + 2NaOH==Na2CO3 + H2O或CO2 + NaOH==NaHCO3 ④与盐反应 SiO2 + Na2CO3Na2SiO3 + CO2↑ SiO2的难挥发性 Ca(ClO)2 + CO2 + H2O==CaCO3↓ + 2HClO CO2 + Na2CO3 + H2O==2NaHCO3 ⑤与碱性氧化物反应 SiO2 + CaOCaSiO3 CO2 + Na2ONa2CO3 三、除去CO、CO2气体中混有的杂质(括号内为杂质) 1.CO(CO2) :通过盛有澄清石灰水的洗气瓶。 2.CO2(CO):通过盛放灼热CuO的硬质玻璃官。 3.CO2(O2):通过盛放灼热铜网的硬质玻璃管。 4.CO2(SO2):通过饱和NaHCO3溶液或酸性KMnO4溶液。 5.CO2(HCl):通过饱和NaHCO3溶液。 6.CO2(H2S):通过CuSO4溶液。 四、碳酸盐性质的一般规律 1.溶解性规律:碱金属的正盐溶解度大于酸式盐;碱土金属(第ⅡA族)的正盐溶解度小于酸式盐。 2.稳定性:难溶性的碳酸盐,(NH4)2CO3及酸式盐受热易分解;可溶性的碳酸盐较稳定,受热难分解。 3.酸式盐与碱反应时的产物要根据相对用量判断。如:在Ca(HCO3)2溶液中滴加NaOH溶液:Ca(HCO3)2 + NaOH==CaCO3↓ + NaHCO3 + H2O(NaOH少量) Ca(HCO3)2 + 2NaOH==CaCO3↓+ Na2CO3 + 2H2O(NaOH过量) 4.CO32- 和HCO3-检验:利用正盐和酸式盐的溶解性可区别CO32- 和HCO3-,如BaCl2溶液。利用CO32- 或HCO3-与H+反应产生CO2的方法,检验CO32- 或HCO3-。 ◆名题导思 例1 下列关于碳族元素及其化合物性质的描述中,不正确的是( ) A、除Pb外、+4价化合物是稳定的 B、RO与RO2(除CO2外)均不跟水反应 C、RH4的稳定性随相对分子质量的增大而增大 D、RH4的沸点从碳到铅逐渐升高 解析:Pb为+2价稳定,其余碳族元素均以+4价稳定,A正确;氧化物除CO2外,其余(如CO、SiO2、PbO等)均难溶于水,也不与水反应,B正确;RH4的稳定性与非金属性有关,与式量无关,C错;Sn、Pb为典型金属元素,无氢化物存在,D错。 答案:CD 例2 (1)图瓦卢是由多个珊瑚礁形成的岛国,由于大气中CO2含量的剧增,大量珊瑚礁(主要成分是碳酸钙)被海水侵蚀,其原因是(用化学方程式表示): 。 (2)温室效应导致海平面上升,引起温室效应的人为原因主要是: 。 (3)为了控制温室效应,各国科学家提出了不少方法和设想。友人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底。以减小大气中CO2的浓度。为使CO2液化,可采用的措施是( ) A、减压、升温 B、增压、升温 C、减压、降温 D、增压、降温 (4)科学家研究发现,用“汽水”(一种能释放CO2的弱酸性溶液)浇灌植物能促进植物的生长。原因是它能( ) ①加强呼吸作用 ②加强光合作用 ③改良碱性土壤、调节pH ④加强植物蒸腾作用 A、①② B、②③ C、③④ D、②③④ (5)快速、有效地减缓大气中CO2大量增加的生态学措施是( ) A、使用天然气等燃料 B、控制全球人口增长 C、植树造林、保护森林 D、立即减少煤和石油的燃烧 解析: 本题以二氧化碳的性质为载体,综合考查学生的环保意识,引导学生关注社会,关注未来。题目选材新颖,涉及面广,起点高,落点低,具有很强的时代性。 二氧化碳微溶于水,溶于水后回与碳酸钙反应,导致碳酸钙溶解。增大压强,降低温度会使气体的溶解度增大。 植物的呼吸作用放出CO2,植物蒸腾作用与外界温度及水分有关,与CO2的浓度无关;植物的光合作用需要吸收CO2,且CO2溶于土壤的水生成碳酸,碳酸电离的H+可以改良碱性土壤、调节pH,促进植物对Ca2+的吸收。所以“汽水”浇灌植物能促进植物的生长。 随着社会的进步,对能源的消耗也将进一步增多,所以不可能立即减少煤和石油的燃烧,使用天然气等燃料也会产生CO2,只有绿色植物的光合作用会吸收大量的CO2,且见效快。 答案:(1)CaCO3+CO2+H2O==Ca(HCO3)2 (2)大量燃烧煤、石油等矿物燃料 (3)D (4)B (5)C 例3 某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为( ) A、1:1 B、1:2 C、1:3 D、1:4 解析:设二价金属为M,正盐的物质的量为x,酸式盐的物质的量为y,则有: MCO3 + 2HCl==MCl2 + CO2↑+ H2O M(HCO3)2 + 2HCl==MCl2 + 2CO2↑+ 2H2O x 2x x y 2y 2y 由题意得: =,解得= 答案:A 例4 下图是石英晶体平面示意图, Si O Si O Si O O O Si O Si O Si O O O Si O Si O Si Si O O O O 4 - 它实际上是立体的网状结构,其中硅氧原子个数之比为 。 原硅酸根离子SiO4-的结构可表示为 ,二聚硅酸根离子Si2O6- 中,只有硅氧键, 它的结构可表示为 。 O O 6- 答案:1:2 O Si O Si O O O 例5.某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用右图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。 (一)实验目的:__________________________________。 (二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等 药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等 (三)实验内容: (四)计算:样品中铜的质量分数=_______________(用含W、m1、m2的代数式表示) (五)问题和讨论: 实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是___________,在B与G之间加入的装置可以是____________,其中盛放的药品是______________。 解析:(1)此实验的目的是测定铜粉样品中铜的质量分数。 MnO2 (3)A中装有H2O2,B中装有MnO2,所以打开A的活塞,B、E中有气泡产生,化学方程式为: 2H2O2 2H2O+O2↑ 对C进行加热,则Cu、C均与O2反应,C中红褐色粉末将变成黑色,化学方程式为:2Cu+O22CuO C+O2CO2 (4)w(Cu)=×100%=×100% (5)用如图的装置进行实验,因为有水蒸气被D装置吸收,导致m(C)增大,m(Cu)减小,使所测结果偏低。所以需要在B、C之间加一个干燥装置:洗气瓶、浓H2SO4(或干燥管、碱石灰) ◆ 随堂演练 1. 科学家预测114号元素为类铅,下列有关预测不正确的是( ) A、它的化合价有+2、+3、+4价 B、其晶体具有良好的导电性 C、电解类铅的硝酸盐和硝酸铜混合液时,阴极将析出类铅 D、最外层具有四个电子 2.下列氧化物按其形成的含氧酸酸性递增顺序排列的是( ) A、SiO2 < CO2 < SO3 < P2O5 B、SiO2 < CO2 < P2O5 < SO3 C、CO2 < SiO2 < P2O5 < SO3 D、CO2 < P2O5 < SO3 < SiO2 3.CO2通入下列各溶液中,不可能产生沉淀的是( ) A.氯化钙溶液 B.石灰水 C.饱和碳酸氢钠溶液 D.硅酸钠溶液 4.固体熔化时必须破坏非极性共价键的是( ) A.冰 B.晶体硅 C.溴 D.二氧化硅 5.最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60。下列说法正确的是:( ) A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体 C.C60中含离子键 D.C60的分子量是720 6.石墨炸弹爆炸时能在方圆几百米范围内撒下大量石墨纤维,造成输电线、电厂设备损坏。这是由于石墨( ) A.有放射性 B.易燃、易爆 C.能导电 D.有剧毒 7.以下说法正确的是 A.纳米材料是指一种称为“纳米”的新物质制成的材料 B.绿色食物是指不含任何化学物质的食品 C.生物固氮是指植物通过叶面直接吸收空气中的氮气 D.光导纤维是以二氧化硅为主要原料制成的 8.将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是( ) A B C D 9.下列实验过程中产生的现象与对应的图形相符合的是( ) A B C D A、NaHSO3粉末加入HNO3溶液中 B、H2S气体通入氯水中 C、NaOH溶液滴入Ba(HCO3)2溶液中 D、CO2气体通入澄清石灰水中 10.下面反应的离子方程式不正确的是( ) A.石英和烧碱溶液反应:SiO2+2OH-=SiO32-+H2O B.向小苏打溶液中加入石灰水至过量HCO3-+Ca2++OH-=CaCO3↓+H2O C.向烧碱溶液中通入过量的CO2 OH-+CO2=CO32-+H2O D.向水玻璃中加入盐酸 SiO32-+2H+=H2SiO3↓ 11.已知A、B、C都是短周期元素,其原子序数A查看更多
相关文章
- 当前文档收益归属上传用户