- 2021-05-13 发布 |
- 37.5 KB |
- 12页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学推断题
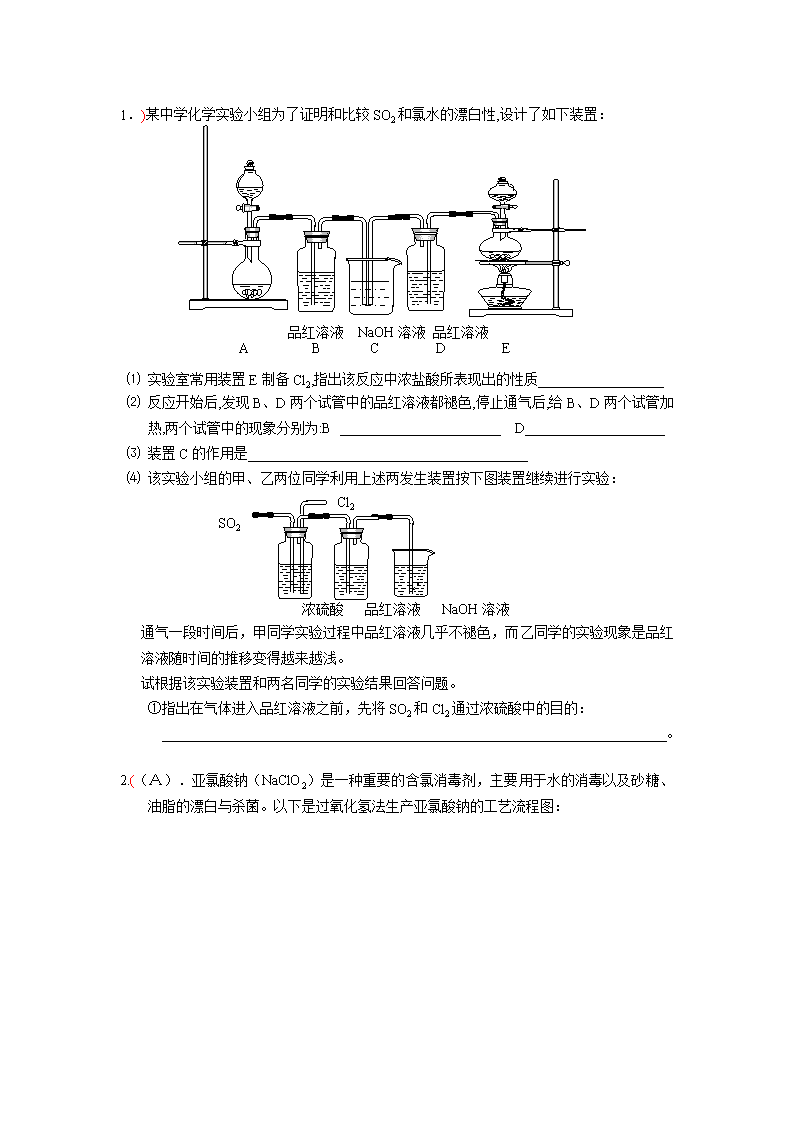
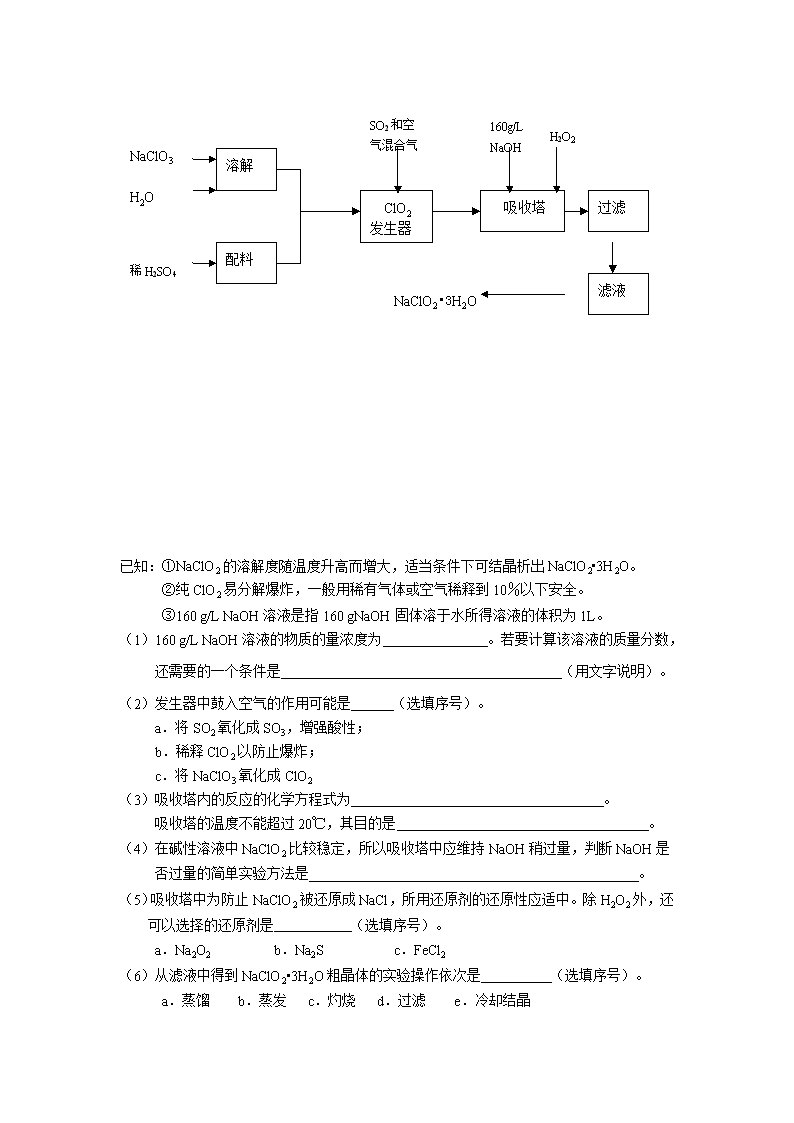
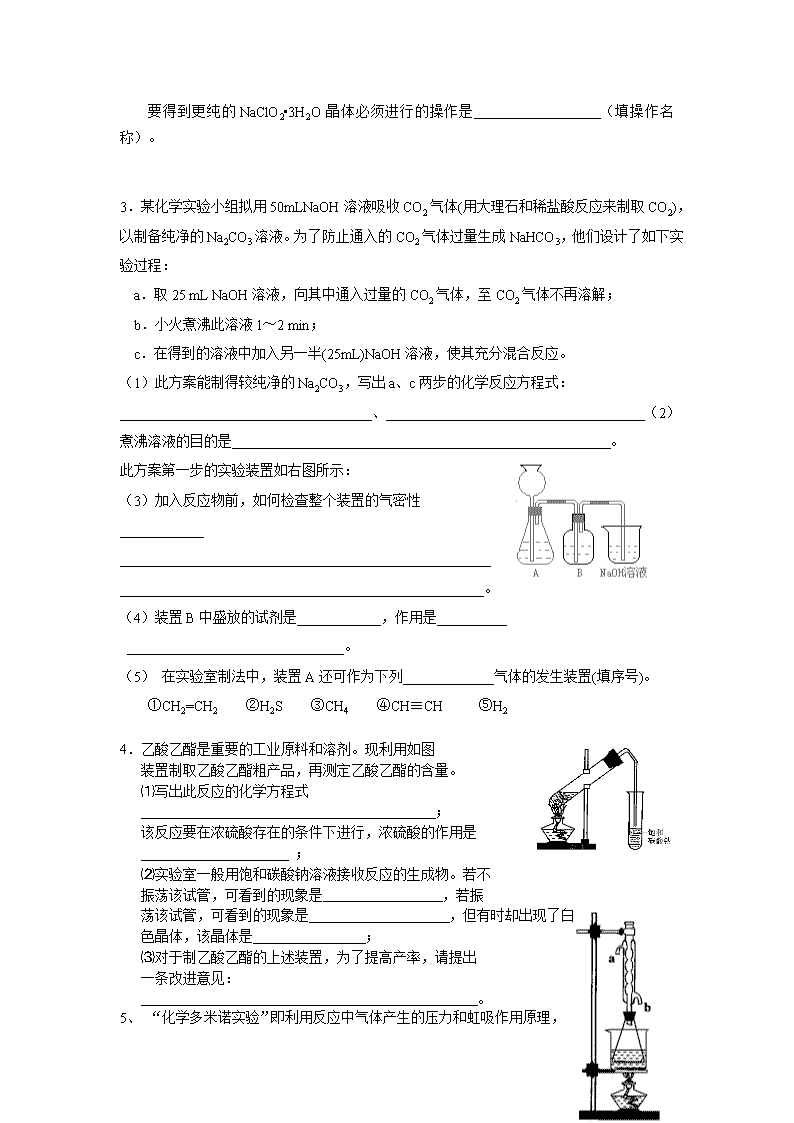
1.)某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如下装置: 品红溶液 NaOH溶液 品红溶液 A B C D E ⑴ 实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质__________________ ⑵ 反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B D____________________ ⑶ 装置C的作用是________________________________________ ⑷ 该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: Cl2 SO2 浓硫酸 品红溶液 NaOH溶液 通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。 试根据该实验装置和两名同学的实验结果回答问题。 ①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的: 。 2.((A).亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: 溶解 吸收塔 NaClO3 配料 ClO2 发生器 H2O 稀H2SO4 160g/L NaOH SO2和空 气混合气 H2O2 过滤 滤液 NaClO2•3H2O 3 已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。 ②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。 ③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。 (1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数, 还需要的一个条件是 (用文字说明)。 (2)发生器中鼓入空气的作用可能是 (选填序号)。 a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸; c.将NaClO3氧化成ClO2 (3)吸收塔内的反应的化学方程式为 。 吸收塔的温度不能超过20℃,其目的是 。 (4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是 否过量的简单实验方法是 。 (5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。 a.Na2O2 b.Na2S c.FeCl2 (6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。 a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶 要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。 3.某化学实验小组拟用50mLNaOH溶液吸收CO2气体(用大理石和稀盐酸反应来制取CO2),以制备纯净的Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,他们设计了如下实验过程: a.取25 mL NaOH溶液,向其中通入过量的CO2气体,至CO2气体不再溶解; b.小火煮沸此溶液1~2 min; c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。 (1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程式:____________________________________、_____________________________________(2)煮沸溶液的目的是 。 此方案第一步的实验装置如右图所示: (3)加入反应物前,如何检查整个装置的气密性____________ _________________________________________________________________________________________________________。 (4)装置B中盛放的试剂是____________,作用是__________ _______________________________。 (5) 在实验室制法中,装置A还可作为下列_____________气体的发生装置(填序号)。 ①CH2=CH2 ②H2S ③CH4 ④CH≡CH ⑤H2 4.乙酸乙酯是重要的工业原料和溶剂。现利用如图 装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。 ⑴写出此反应的化学方程式 ; 该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是 ; ⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不 振荡该试管,可看到的现象是 ,若振 荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ; ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出 一条改进意见: 。 5、 “化学多米诺实验” 即利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只须控制第一个反应,就好像多米诺骨牌游戏一样。右图就是一个“化学多米诺实验”。 各装置中试剂或物质是:A.2mol/LH2SO4 B.Zn C.2mol/LH2SO4+CuSO4 D.Zn E.CuSO4溶液 F.NH3.•H2O G.30%H2O2 H.H2S溶液 I.NaOH溶液 已知:Cu 2++4NH3•H2O →[Cu+(NH3•)4] 2+ +4H2O 该反应产物可作为H2O2分解的催化剂。请回答下列问题: (1)进行实验前必须进行的操作___________________________________。 (2)B与D两容器中反应速率比较B______D(填>、<、=)原因是_ _ ________ __。 (3)H中的现象是_________________________________________________________。 (4)I的作用是(用化学方程式表示)___________________________________。 (5)A和B之间导管a的作用是_________________________________________。 (6)在该实验中不涉及的反应类型是(填序号)____ __。 ①分解反应 ②化合反应 ③置换反应 ④复分解反应 6.某同学用下列装置制备并检验Cl2的性质。 (1)II图中褪色的是 (填a或b),烧杯中反应的离子方程式是 (2)①将Cu丝换成Fe丝,做III实验,结果也能点燃,你认为Fe丝也可点燃的理由是 。 a.Fe与Cu都是金属元素 b.Fe的熔点比Cu高 c.Fe的密度比Cu小 d.Fe的金属性比Cu强 ②通常由燃烧产物(FeCl3) 配制其溶液的方法 。 (3)将IV装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到量筒壁上有油状 液滴生成,饱和食盐水中有少量固体析出,量筒内黄绿色气体颜色变浅 ,量筒内液面上升等。 油状液滴的成分可能是(写分子式) , 水槽用饱和食盐水而不用水的原因是_____________ ____________________。 饱和食盐水中有少量固体析出,其原因是_______________ ______________。 7. (1) 实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净的氮气,反应式为: NaNO2+NH4Cl→NaCl+N2↑+2H2O↑+Q 实验装置如下图所示,试回答: ① 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是 (填写编号) a. 防止饱和溶液蒸发 b. 保证实验装置不漏气 c. 使NaNO2饱和溶液容易滴下 ②加热前必须进行的一个操作步骤是 。 加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。 ③收集N2最适宜的方法是 (填写编号) a. 用排气法收集在集气瓶中 b. 用排水法收集在集气瓶中 c. 直接收集在球胆或塑料袋中 (2) 实验室合成氨装置如下图所示。试回答: 装置甲的作用是:① ② 甲 乙 8.某实验小组演绎实验室制氯化氢的方法,用溴化钠与浓硫酸作用以图甲为主要装置(固定加热等仪器均略去)制取溴化氢气体。 (1) 甲中装在蒸馏烧瓶中的小试管的作用是__________________________________ (2) 为确定从蒸馏烧瓶中排出的气体中有无溴化氢气体,设计了图乙的装置作试验,指出图乙装置中的错误a_________________________、b___________________________。 (3) 图乙装置的广口瓶和试管中分别装有的试剂可以是( ) A、氢氧化钠溶液、硝酸银溶液 B、四氯化碳、硝酸银溶液 C、硝酸银溶液、四氯化碳 D、蒸馏水、硝酸银溶液 (4) 若要在实验室制取碘化氢气体,选择的反应物是( ) A、氢气和碘 B、碘化钠和浓硫酸 C、碘化钾和浓盐酸 D、碘化钾和浓磷酸 (5)若在甲装置的蒸馏烧瓶中分别装入下列药品:a锌粉、b二氧化锰粉、c大理石粉三种固体药品,它们若能与稀盐酸反应,请写出制取气体的化学方程式_________________________________________________________________________ 9、 某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml、18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。 (1)请写出铜跟浓硫酸反应的化学方程式:______________________________ 可以证明有余酸的实验方案是________(填写字母,错选或多选扣分) (a)再加入铁粉 (b)再滴入BaCl2溶液 (c)再加入银粉(d)再滴入Na2CO3溶液 (2)甲学生设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是________(填写字母,错选或多选扣分) (a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。 (b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。 (c)用排水法测定其产生气体的体积(折算成标准状况)。 (d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。 (3)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是_________________________________。 10.某校课外实验小组同学设计下图装置进行实验。(夹持装置已略去)。 (1)该小组同学用如图装置进行“乙炔的制取及燃烧性质验证”实验。 ①制取乙炔的化学方程式是 。 ②点燃乙炔前,需要验纯。简述检验可燃气体纯度的操作方法: 。 ③在导管口c处点燃乙炔,观察到的现象是 ; (2)该小组同学用上图装置进行实验,确定某饱和醇的结构。 ①反应前,先对量气管进行第一次读数。反应后,待装置温度冷却到室温,再对量气管进行第二次读数。读数时,应注意的操作是: ,并使视线与凹液面最低处相平。 11.下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。 请按要求填空: (1)反应③的化学方程式 。 (2)C的结构式 ;H的化学式 。 (3)L的溶液与化合物E反应的离子方程式 。 (4)化合物J的化学式 。 12.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1︰2。在一定条件下,各物质之间的相互转化关系如右(图中部分产物未列出): 请填写下列空白 (1)A是 ,C是 。 (2)H与盐酸反应生成E的化学方程式是 。 (3)E与F反应的化这方程式是 。 13. 铝和氢氧化钾都是重要的工业产品。请回答: (1)工业冶炼铝的化学方程式是__________________________。 (2)铝与氢氧化钾溶液反应的离子方程式是__________________________。 (3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。 ①该电解槽的阳极反应式是__________________________。 ②通电开始后,阴极附近溶液pH会增大,请简述原因____________________________ _______________________________________________________________________________________________________________________________________________。 ③除去杂质后的氢氧化钾溶液从液化出口_____________(填写“A”或“B”)导出。 14. X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。 请回答: (1)W的电子式是_______________________________________。 (2)X与Y在溶液中反应的离子方程式是______________________________。 (3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。 ①装置I中反应的化学方程式是_______________________________________,装置II中物质的化学式是_____________________。 ②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是_______________,所需仪器装置是_____________(从上图选择必要装置,填写编号)。 答案1 (1)酸性(1分)、还原性(1分); (2)B溶液恢复红色(1分), D溶液仍无色(1分) (3)吸收多余的SO2和Cl2,防止污染环境(1分) (4)①使SO2和Cl2混合均匀(1分),通过观察气泡控制气体的流速(1分) ②控制SO2和Cl2按物质的量之比1︰1进气(1分),二者发生反应,生成无漂白性的H2SO4和HCl(1分),SO2 + Cl2 + 2H2O → SO42-+ 2Cl—+ 4H+ (2分) ③控制SO2和Cl2进气的物质的量,使之不相等(2分) 答案2 (1)4mol/L(1分,未写单位不给分),该溶液的密度(1分); (2)b(2分); (3)2NaOH+2ClO2+H2O2→2 NaClO2+2 H2O2+O2(2分);防止H2O2分解(4)连续测定吸收塔内溶液的pH(1分); (5)a (2分); (6)b、e、d(2分),重结晶(1分)。 答案3 (1)强氧化性(漂白性)(2分) (2)a、b、c(各1分,全对给3分,选有d不给分) (3)降低2 Na2CO3·3H2O2的溶解度(1分),析出更多晶体(1分) (4)催化双氧水的分解(2分) (5)温度高时双氧水易分解(1分),温度低时反应缓慢(1分) (6)晶体的洗涤(2分) 答案4 (1) 2NaOH + CO2 → NaHCO3 NaHCO3 + NaOH → Na2CO3 + H2O (各1分) (2)充分将溶液中多余的CO2赶走。(1分) (3)连接和烧杯间的乳胶管用止水夹夹住。然后从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气。(或在锥形瓶中加水超过漏斗下端,对锥开瓶加热,在洗气瓶和烧杯中有气泡溢出,说明装置不漏气。) (2分) (4) 饱和碳酸氢钠溶液 吸收HCl气体 (各1分) (5) ②⑤ (1分) (6) ①③(1分) ②④ (1分) (7) 7.2 mol/L(2分) 答案.5(1)CH3COOH + C2H5OH CH3COOC2H5 + H2O (2分) 催化 吸水 (1分) (2)液体分为两层 无色气泡 NaHCO3(各1分,共3分) (3)水浴加热、加装温度计、用圆底烧瓶代替试管等(合理就给分)(2分) (4)溶液由无色恰好变为浅红色,并在半分钟内不褪色 (1分) b (1分) 79.2%(2分) 答案、6(1)检查装置气密性 (2)<;D中Zn与CuSO4发生反应覆盖在Zn表面形成原电池,从而使反应速率加快 (3)有气泡并有乳白色(或浅黄色)浑浊. (4) (5)平衡烧瓶(B)和漏斗(A)的气压,使液体易于流下 (6)B 答案7 (1) b Cl2+2OH—=Cl—+ClO—+H2O (1×2分) (2)① d (1分) ② 将FeCl3溶解在较浓的盐酸中,然后再用水稀释到所需浓度 (1分) (3)CH2Cl2、CHCl3、CCl4 (分1,不全对不得分) 降低Cl2在水中的溶解度,抑制Cl2和水的反应 (1分) 反应中有HCl生成,使溶液中的Cl-浓度增大,促使NaCl的溶解平衡向生成NaCI固体的方向移动 (1分) (4) Cl—+ClO—+ 2H+= Cl2 ↑+H2O (2分) 答案8 (1) ① c(1分);②检查装置的气密性(1分),该反应是放热反应(1分)。 ③c(2分) (2)①干燥气体②使两种气体充分混合③观察气泡以调节氢气、氮气气流速率(2分)(注:只要求三项中任写两项) NH3及N2、H2的混合物(2分); (3)分 答案 (1) 液封 (防止产生气体从长颈漏斗逸出) (1分) (2) NO2、NO、N2O4、Br2(g)HBr, Br2(g) (3分) (3) 洗气瓶中导管短进长出错误,试管中导管伸到液面下错误 (2分) (4) B (1分)(5) (1分) (6).Zn + 2HCl →H2↑ + ZnCl2 ; CaCO3 + 2HCl →CO2↑+H2O + CaCl2(4分) 答案9 △ (1)Cu + 2H2SO4 CuSO4 + SO2↑+ 2H2O (2分) 反应中硫酸不断消耗,浓度变稀,铜片不再与稀硫酸反应(1分);a、d(2分);(2)a、c(2分);(3)(2分);(4)(烧瓶中)反应后溶液的体积(1分); (5) (2分) 答案.(1)①CaC2+2H2O→Ca(OH)2+C2H2↑ (2分) ②收集一试管气体,用拇指堵住试管口移近火焰点燃,若发出轻微的响声,证明气体比较纯净(3分)(操作1分、现象和判断2分) ③火焰明亮并伴有浓烈的黑烟(2分,少答一条扣1分) (2)①保持装置A和装置B液面相平(2分) ② 二(2分)查看更多