- 2021-05-13 发布 |
- 37.5 KB |
- 14页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学真题分类汇编个专题及套高考试卷化学实验
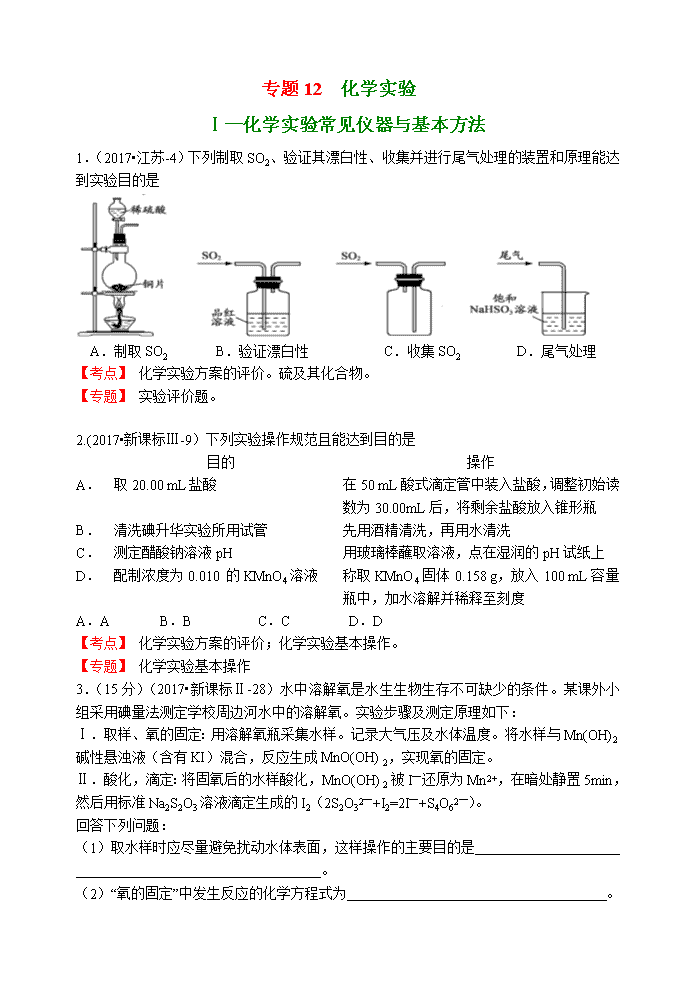
专题12 化学实验 Ⅰ—化学实验常见仪器与基本方法 1.(2017•江苏-4)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是 A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理 【考点】 化学实验方案的评价。硫及其化合物。菁优网版权所有 【专题】 实验评价题。 2.(2017•新课标Ⅲ-9)下列实验操作规范且能达到目的是 目的 操作 A. 取20.00 mL盐酸 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶 B. 清洗碘升华实验所用试管 先用酒精清洗,再用水清洗 C. 测定醋酸钠溶液pH 用玻璃棒蘸取溶液,点在湿润的pH试纸上 D. 配制浓度为0.010 的KMnO4溶液 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 A.A B.B C.C D.D 【考点】 化学实验方案的评价;化学实验基本操作。 菁优网版权所有 【专题】 化学实验基本操作 3.(15分)(2017•新课标Ⅱ-28)水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下: Ⅰ.取样、氧的固定:用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH) 2,实现氧的固定。 Ⅱ.酸化,滴定:将固氧后的水样酸化,MnO(OH) 2被I—还原为Mn2+,在暗处静置5min,然后用标准Na2S2O3溶液滴定生成的I2(2S2O32—+I2=2I—+S4O62—)。 回答下列问题: (1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是 。 (2)“氧的固定”中发生反应的化学方程式为 。 (3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和 ;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除 及二氧化碳。 (4)取100.00mL水样经固氧、酸化后,用a mol•L﹣1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为 ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为 mg•L﹣1。 (5)上述滴定完成后,若滴定管尖嘴处留有气泡会导致测量结果偏 。(填“高”或“低”) 【考点】 探究物质的组成或测量物质的含量。菁优网版权所有 【专题】 化学实验基本操作; 定量测定与误差分析。 4.(2017•江苏-22) 1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm—3。实验室制备少量1﹣溴丙烷的主要步骤如下: 步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr. 步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止. 步骤3:将馏出液转入分液漏斗,分出有机相. 步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷. (1)仪器A的名称是 ;加入搅拌磁子的目的是搅拌和 。 (2)反应时生成的主要有机副产物有2﹣溴丙烷和 。 (3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是 。 (4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 。 (5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡, ,静置,分液。 【考点】 制备实验方案的设计; 卤代烃的性质;醇的性质;萃取的操作;蒸馏的操作;【专题】 有机实验综合 5.(18分)(2017•天津-9)用沉淀滴定法快速测定NaI等碘化物溶液中c(I﹣),实验过程包 括准备标准溶液和滴定待测溶液。 Ⅰ准备标准溶液 a.准确称取AgNO3基准物4.2468g(0.0250mol)后,配制成250mL标准溶液,放在棕色试剂瓶中避光保存,备用。 b.配制并标定100mL 0.1000mol•L﹣1 NH4SCN标准溶液,备用。 Ⅱ滴定的主要步骤 a.取待测NaI溶液25.00mL于锥形瓶中。 b.加入25.00mL 0.1000mol•L﹣1 AgNO3溶液(过量),使I﹣完全转化为AgI沉淀。 c.加入NH4Fe(SO4)2溶液作指示剂。 d.用0.1000mol•L﹣1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,体系出现淡红色,停止滴定。 e.重复上述操作两次.三次测定数据如下表: 实验序号 1 2 3 消耗NH4SCN标准溶液体积/mL 10.24 10.02 9.98 f.数据处理 回答下列问题: (1) 将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有 。 (2)AgNO3标准溶液放在棕色试剂瓶中避光保存的原因是 。 (3)滴定应在pH<0.5的条件下进行,其原因是 。 (4)b和c两步操作是否可以颠倒 ,说明理由 。 (5)所消耗的NH4SCN标准溶液平均体积为 mL,测得c(I﹣) = mol•L﹣1。 (6)在滴定管中装入NH4SCN标准溶液的前一步,应进行的操作为 。 (7)判断下列操作对c(I﹣)测定结果的影响(填“偏高”、“偏低”或“无影响”) ①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果 。 ②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果 。 【考点】 化学实验基本操作;铁盐的的水解知识;卤化银的性质;探究物质的组成或测量物质的含量 菁优网版权所有 【专题】 定量测定与误差分析 6.(15分)(2017•新课标Ⅰ-26)凯氏定氮法是测定蛋白质中氮 含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:; 回答下列问题: (1)a的作用是 。 (2)b中放入少量碎瓷片的目的是 。f的名称是 。 (3)清洗仪器:中加蒸馏水;打开,关闭,加热,蒸气充满管路;停止加热,关闭中蒸馏水倒吸进入,原因是 ;打开放掉水,重复操作次。 (4)仪器清洗后,中加入硼酸()和指示剂。铵盐试样由注入,随后注入氢氧化钠溶液,用蒸馏水冲洗,关闭中保留少量水。打开,加热,使水蒸气进入。 ①中保留少量水的目的是 。 ②中主要反应的离子方程式为 ,采用中空双层玻璃瓶的作用是 。 (5)取某甘氨酸()样品克进行测定,滴定中吸收液时消耗浓度为的盐酸,则样品中氮的质量分数为 ,样品的纯度 。 【考点】探究物质的组成;化学实验基本操作;离子反应与离子方程式;化学计算。 【专题】定量测定与误差分析. Ⅱ—物质的分离、提纯与检验 1.《本草衍义-8》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是 A. 蒸馏 B. 升华 C. 干馏 D. 萃取 【考点】物质的分离、提纯的基本方法选择与应用。 【专题】物质的分离提纯和鉴别。 2.(6分)(2017•天津-4)以下实验设计能达到实验目的是 实验目的 实验设计 A. 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 B. 制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液 C. 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D. 鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取 A.A B.B C.C D.D 【考点】 化学实验方案的评价;钠及其化合物;铝及其化合物、铝盐的水解; 混合物的分离与提纯;卤素单质间的置换反应。 【专题】 物质的分离提纯和鉴别 3.(2017•江苏-4)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是 A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理 【考点】 化学实验方案的评价。硫及其化合物。菁优网版权所有 【专题】 实验评价题。 4.(2017•新课标Ⅰ-10)实验室用还原制备金属的装置如图所示(粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是 A. ①、②、③中依次盛装溶液、浓、焦性没食子酸溶液 B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C. 结束反应时,先关闭活塞,再停止加热 D. 装置(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 【考点】制备实验方案的设计:包括气体除杂、氢气的验纯与操作注意事项、启普发生器的使用。 【专题】无机实验综合。 5.(13分)(2017•北京-26)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 资料:TiCl4及所含杂质氯化物的性质 化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2 沸点/℃ 58 136 181(升华) 316 1412 熔点/℃ ﹣69 25 193 304 714 在TiCl4中的溶解性 互溶 ﹣ 微溶 难溶 (1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ•mol﹣1 2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJ•mol﹣1 ①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式: 。 ②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H 0(填“>”“<”或“=”),判断依据: 。 ③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是 。 ④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有 。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: 物质a是 ,T2应控制在 。 【考点】盖斯定律与热化学方程式的书写; 氯及其化合物;铁及其化合物;金属综合;制备实验方案的设计 菁优网版权所有 【专题】 无机实验综合 6.(12分)(2017•江苏-16)铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下: 注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。 (1)“碱溶”时生成偏铝酸钠的离子方程式为 。 (2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH (填“增大”、“不变”或“减小”)。 (3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是 。 (4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示. 阳极的电极反应式为 ,阴极产生的物质A的化学式为 。 (5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是 。 【考点】 铝及其化合物;铁及其化合物;硅及其化合物;电解原理;物质分离和提纯的方法和基本操作综合应用;菁优网版权所有 【专题】 物质的分离提纯和鉴别 7.(15分)(2017•江苏-19)某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。 已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO═2NaCl+NaClO3 ②AgCl可溶于氨水:AgCl+2NH3•H2O⇌Ag(NH3)2++Cl﹣+2H2O ③常温时 N2H4•H2O(水合肼)在碱性条件下能还原Ag(NH3) 2+: 4Ag(NH3)2++N2H4•H2O═4Ag↓+N2↑+4NH4++4NH3↑+H2O (1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为 。 (2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,该反应的化学方程式为 。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是 。 (3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并 。 (4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3•H2O反应外(该条件下NaClO3与NH3•H2O不反应),还因为 。 (5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案: (实验中须使用的试剂有:2mol•L﹣1水合肼溶液, 1mol•L﹣1H2SO4 )。 【考点】 硝酸的性质;氯及其化合物;物质分离和提纯的方法和基本操作综合应用 菁优【专题】 物质的分离提纯和鉴别 Ⅲ—气体的制取 1.(2017•江苏-4)下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是 A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理 【考点】 化学实验方案的评价。硫及其化合物。菁优网版权所有 【专题】 实验评价题。 Ⅳ—综合实验(实验方案的设计与评价) 1.(2017•江苏-13)根据下列实验操作和现象所得到的结论正确的是 选项 实验操作和现象 实验结论 A 向苯酚溶液中滴加少量浓溴水、振荡,无白色沉淀 苯酚浓度小 B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 部分Na2SO3被氧化 C 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液;未出现银镜 蔗糖未水解 D 向某黄色溶液中加入淀粉 KI 溶液,溶液呈蓝色 溶液中含 Br2 A.A B.B C.C D.D 【考点】实验方案的评价;酚;硫及其化合物; 糖类的水解反应;铁及其化合物;卤素;【专题】 实验评价题 2.(2017•新课标Ⅱ-10)下列由实验得出的结论正确的是 实验 结论 A 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2﹣二溴乙烷无色、可溶于四氯化碳 B 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢与水分子中的氢具有相同的活性 C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性 D 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的一氯甲烷具有酸性 A.A B.B C.C D.D 【考点】 化学实验方案的评价;乙烯的性质;乙醇的性质;乙酸的性质;烷烃的性质; 【专题】有机物的化学性质及推断;化学实验基本操作。 3.(6分)(2017•天津-4)以下实验设计能达到实验目的是 实验目的 实验设计 A. 除去NaHCO3固体中的Na2CO3 将固体加热至恒重 B. 制备无水AlCl3 蒸发Al与稀盐酸反应后的溶液 C. 重结晶提纯苯甲酸 将粗品水溶、过滤、蒸发、结晶 D. 鉴别NaBr和KI溶液 分别加新制氯水后,用CCl4萃取 A.A B.B C.C D.D 【考点】 化学实验方案的评价;钠及其化合物;铝及其化合物、铝盐的水解; 混合物的分离与提纯;卤素单质间的置换反应。 【专题】 物质的分离提纯和鉴别 4.(12分)(2017•江苏-18)碱式氯化铜是重要的无机杀菌剂。 (1)碱式氯化铜有多种制备方法 ①方法1:45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2 Cl2•3H2O,该反应的化学方程式为 。 ②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示. M′的化学式为 。 (2)碱式氯化铜有多种组成,可表示为Cua(OH) bClc•xH2O。 为测定某碱式氯化铜的组成,进行下列实验: ①称取样品1.1160g,用少量稀HNO3溶解后配成100.00mL溶液A; ②取25.00mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722g; ③另取25.00mL溶液A,调节pH 4~5,用浓度为0.08000mol•L﹣1的EDTA(Na2H2Y•2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++H2Y2﹣═CuY2﹣+2H+),滴定至终点,消耗标准溶液30.00mL。通过计算确定该样品的化学式(写出计算过程)。 解: 【考点】 铜及其化合物;制备实验方案的设计;探究物质的组成或测量物质的含量 菁优【专题】 制备实验综合 【解析】(1)①45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2 Cl2•3H2O,反应物为CuCl、氧气、水,Cu元素的化合价升高,O元素的化合价降低,由原子、电子守恒可知反应为4CuCl+O2+8H2O2Cu2(OH)2Cl2•3H2O。 ②Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低,可知M′的化学式为Fe2+。故答案为:Fe2+; (2)略 5.(13分)(2017•北京-26)TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下: 资料:TiCl4及所含杂质氯化物的性质 化合物 SiCl4 TiCl4 AlCl3 FeCl3 MgCl2 沸点/℃ 58 136 181(升华) 316 1412 熔点/℃ ﹣69 25 193 304 714 在TiCl4中的溶解性 互溶 ﹣ 微溶 难溶 (1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。 已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJ•mol﹣1 2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJ•mol﹣1 ①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式: 。 ②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的△H 0(填“>”“<”或“=”),判断依据: 。 ③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是 。 ④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有 。 (2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: 物质a是 ,T2应控制在 。 【考点】盖斯定律与热化学方程式的书写; 氯及其化合物;铁及其化合物;金属综合;制备实验方案的设计 菁优网版权所有 【专题】 无机实验综合 6.(2017•江苏-22) 1﹣溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm—3。实验室制备少量1﹣溴丙烷的主要步骤如下: 步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24g NaBr. 步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止. 步骤3:将馏出液转入分液漏斗,分出有机相. 步骤4:将分出的有机相转入分液漏斗,依次用12mL H2O、12mL 5% Na2CO3溶液和12mL H2O洗涤,分液,得粗产品,进一步提纯得1﹣溴丙烷. (1)仪器A的名称是 ;加入搅拌磁子的目的是搅拌和 。 (2)反应时生成的主要有机副产物有2﹣溴丙烷和 。 (3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是 。 (4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是 。 (5)步骤4中用5%Na2CO3溶液洗涤有机相的操作:向分液漏斗中小心加入12mL 5% Na2CO3溶液,振荡, ,静置,分液。 【考点】 制备实验方案的设计; 卤代烃的性质;醇的性质;萃取的操作;蒸馏的操作;【专题】 有机实验综合 7.(14分)(2017•新课标Ⅲ-26)绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究.回答下列问题: (1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知: 。 (2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A )称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验. ①仪器B的名称是 。 ②将下列实验操作步骤正确排序 (填标号);重复上述操作步骤,直至A恒重,记为m3 g。 a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温 ③根据实验记录,计算绿矾化学式中结晶水数目x= (列式表示)。若实验时按a、d次序操作,则使x (填“偏大”“偏小”或“无影响”). (3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。 ①C、D中的溶液依次为 (填标号)。C、D中有气泡冒出,并可观察到的现象分别为 。 a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4 ②写出硫酸亚铁高温分解反应的化学方程式 。 【考点】 性质实验方案的设计;铁及其化合物;硫及其化合物;化学计量。 优网版权所【专题】 无机实验综合 8.(15分)(2017•新课标Ⅲ-27)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO•Cr2O3,还含有硅、铝等杂质。制备流程如图所示: 回答下列问题:(1)步骤①的主要反应为: FeO•Cr2O3+Na2CO3+NaNO3Na2CrO4+Fe2O3+CO2+NaNO2 。 上述反应配平后FeO•Cr2O3与NaNO3的系数比为 。该步骤不能使用陶瓷容器,原因是 。 (2)滤渣1中含量最多的金属元素是 ,滤渣2的主要成分是 及含硅杂质。 (3)步骤④调滤液2的pH使之变 (填“大”或“小”),原因是 (用离子方程式表示)。 (4)有关物质的溶解度如图所示.向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到 (填标号)得到的K2Cr2O7固体产品最多。 a.80℃ b.60℃ c.40 ℃d.10℃ 步骤⑤的反应类型是 。 (5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为 ×100%。 【考点】 制备实验方案的设计。铁及其化合物;铝及其化合物; 化学计量;有 【专题】 无机实验综合 查看更多