- 2021-05-13 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
全国高考化学 试题分类汇编 专题二十七 化学与技术
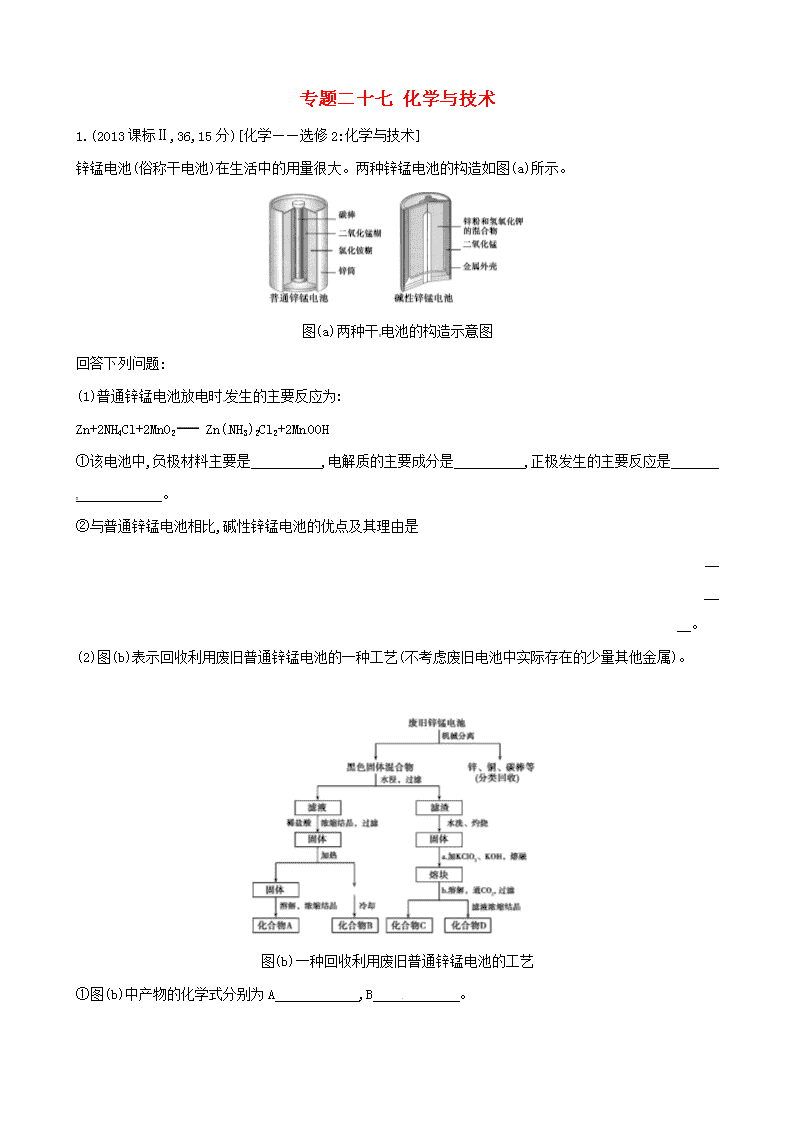
专题二十七 化学与技术 1.(2013课标Ⅱ,36,15分)[化学——选修2:化学与技术] 锌锰电池(俗称干电池)在生活中的用量很大。两种锌锰电池的构造如图(a)所示。 图(a)两种干电池的构造示意图 回答下列问题: (1)普通锌锰电池放电时发生的主要反应为: Zn+2NH4Cl+2MnO2 Zn(NH3)2Cl2+2MnOOH ①该电池中,负极材料主要是 ,电解质的主要成分是 ,正极发生的主要反应是 。 ②与普通锌锰电池相比,碱性锌锰电池的优点及其理由是 。 (2)图(b)表示回收利用废旧普通锌锰电池的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。 图(b)一种回收利用废旧普通锌锰电池的工艺 ①图(b)中产物的化学式分别为A ,B 。 ②操作a中得到熔块的主要成分是K2MnO4。操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为 。 ③采用惰性电极电解K2MnO4溶液也能得到化合物D,则阴极处得到的主要物质是 (填化学式)。 答案 (1)①Zn NH4Cl(每空1分,共2分) MnO2+N+e- MnOOH+NH3(2分) ②碱性电池不易发生电解质的泄漏,因为消耗的负极改装在电池的内部;碱性电池使用寿命较长,因为金属材料在碱性电解质中比在酸性电解质中的稳定性提高(答对一条即可,其他合理答案也给分)(2分) (2)①ZnCl2 NH4Cl(每空2分,共4分) ②3Mn+2CO2 2Mn+MnO2↓+2C(3分) ③H2(2分) 2.(2013浙江自选,16,10分)“化学与技术”模块 电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示: 成分 CaO SiO2 Al2O3 Fe2O3 MgO CaS 其他不溶于 酸的物质 质量分数(%) 65~66 3.5~5.0 1.5~3.5 0.2~0.8 0.2~1.1 1.0~1.8 23-26 用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程: 已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。 (1)反应器中加入的酸应选用 。 (2)脱色槽中应加入的物质X是 ;设备A的作用是 ;设备B的名称为 ;设备C的作用是 。 (3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是 。 A.水 B.浓硫酸 C.石灰乳 D.硝酸 (4)将设备B中产生的母液重新引入反应器的目的是 。 答案 (1)盐酸 (2)活性炭 蒸发浓缩 过滤器 脱水干燥 (3)C (4)对母液回收利用,降低废弃物排放量,提高经济效益 3.(2013课标Ⅰ,36,15分)[化学——选修2:化学与技术]草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: 回答下列问题: (1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 、 。 (2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 ;过滤操作②的滤液是 和 ,滤渣是 。 (3)工艺过程中③和④的目的是 。 (4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。 (5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为 ;列式计算该成品的纯度 。 答案 [化学——选修2:化学与技术] (1)CO+NaOH HCOONa 2HCOONa Na2C2O4+H2↑ (2)NaOH溶液 CaC2O4 H2C2O4溶液 H2SO4溶液 CaSO4 (3)分别循环利用氢氧化钠和硫酸(降低成本),减小污染 (4)Na2SO4 (5)5C2+2Mn+16H+ 2Mn2++8H2O+10CO2↑ ×100%=94.5% 4.(2013山东理综,31,8分)【化学——化学与技术】 废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下: (1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为 。 (2)净化步骤所得滤饼的主要成分是 。回收的洗涤液代替水配制电解液,目的是回收利用其中的 。 (3)溶液Ⅰ的主要成分是 。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是 。 (4)将Co2O3还原成Co粉的化学反应方程式为 。 答案 (1)2H++2e- H2↑ (2)Fe(OH)3 Co2+(或Co) (3)NH4Cl 焙烧时NH4Cl分解产生NH3和HCl (4)Co2O3+3H2 2Co+3H2O查看更多