- 2021-05-13 发布 |
- 37.5 KB |
- 8页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届中考化学复习 第1部分 第九讲 海水中的化学 第1课时 海洋化学资源练习
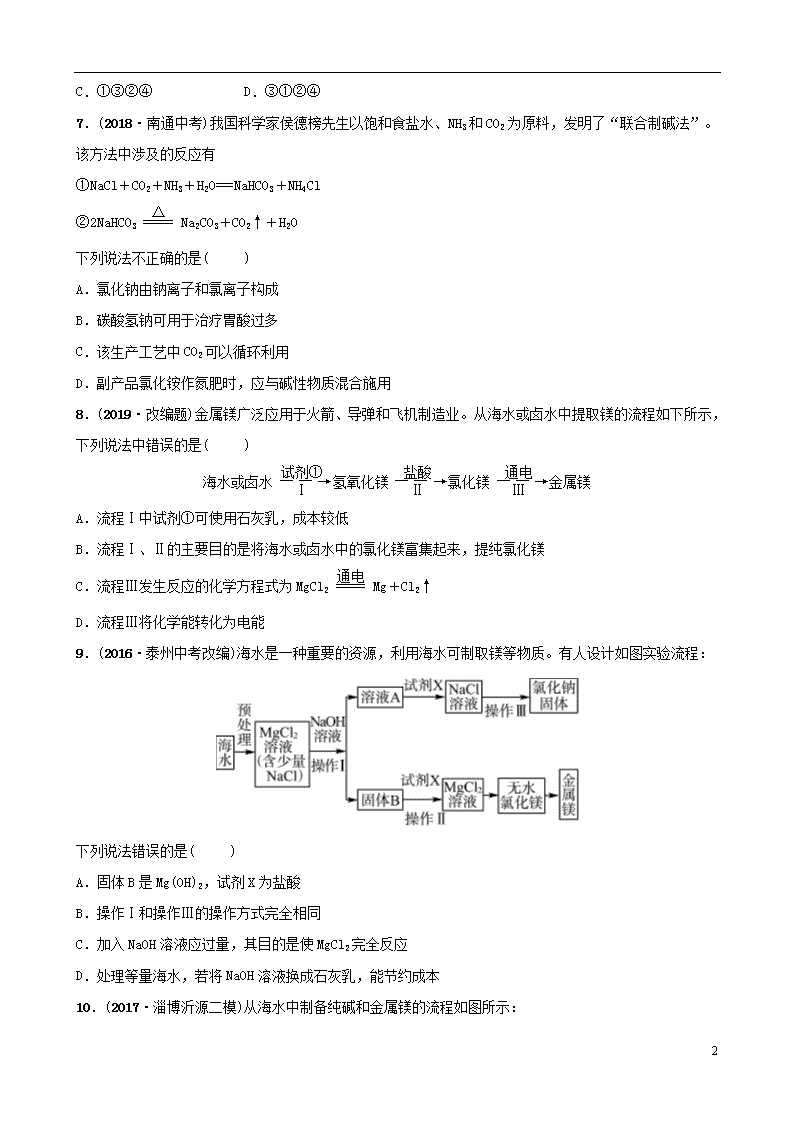
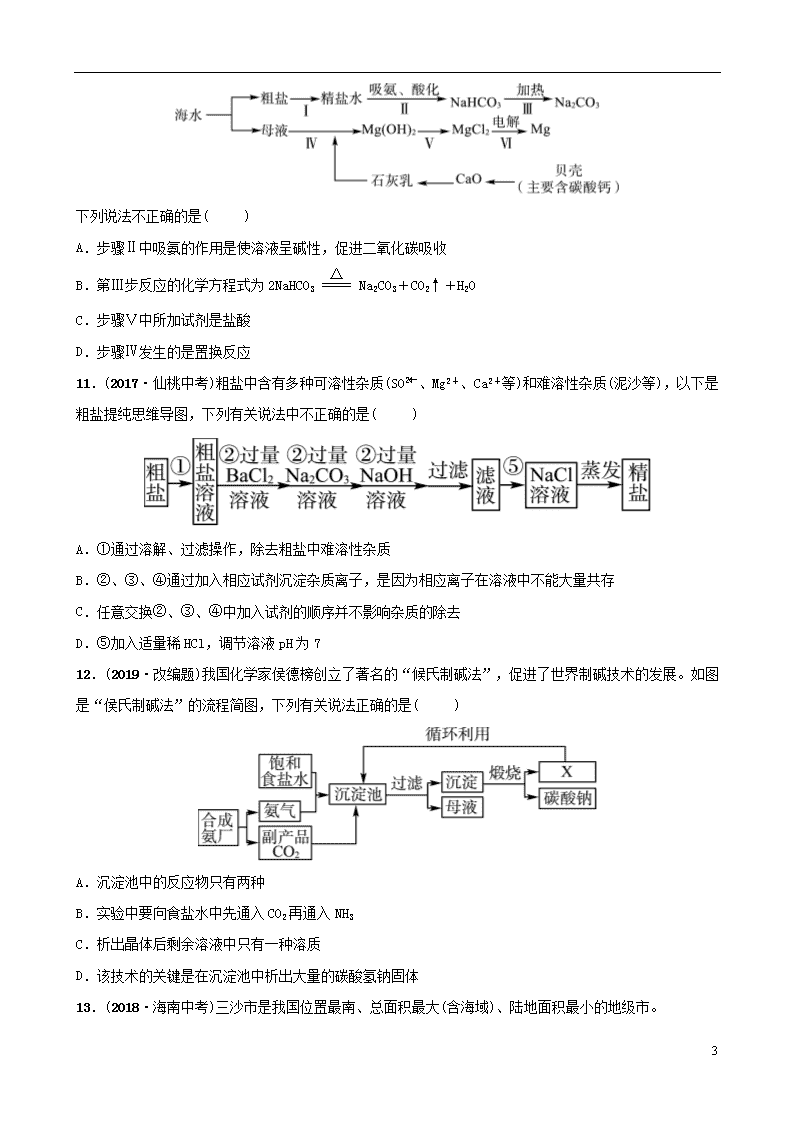
第九讲 海水中的化学 第1课时 海洋化学资源 姓名:________ 班级:________ 限时:______分钟 1.下列有关海洋资源及其综合利用的说法错误的是( ) A.海水制镁应用了富集提纯的思想 B.蒸馏法淡化海水是利用了海水中各组分的颗粒大小不同 C.海底的可燃冰大量燃烧后,也会造成温室效应 D.侯氏制碱法生产过程需要同合成氨厂联合,故称联合制碱法 2.(2019·易错题)浩瀚的海洋中含量最多的物质是( ) A.NaCl B.MgCl2 C.CaCl2 D.H2O 3.下列方法可使海水转化为饮用水的是( ) A.蒸馏 B.静置沉淀 C.活性炭吸附 D.过滤 4.(2018·南京中考)在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途不正确的是( ) A.称取粗盐后,把粗盐研磨细 B.溶解时搅拌,加速粗盐溶解 C.称量精盐前,把精盐固体转移到纸上 D.蒸发时搅拌,防止局部温度过高,造成液滴飞溅 5.(2018·梧州中考)海水综合利用流程如图,有关说法错误的是( ) A.从母液中可进一步制得金属镁 B.①处操作是溶解、过滤、蒸发结晶 C.海水“晒盐”得到的粗盐还含有杂质 D.析出粗盐后的母液是氯化钠的不饱和溶液 6.(2018·广西中考)粗盐含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH ②Na2CO3 ③BaCl2溶液,过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( ) A.②③①④ B.③②①④ 8 C.①③②④ D.③①②④ 7.(2018·南通中考)我国科学家侯德榜先生以饱和食盐水、NH3和CO2为原料,发明了“联合制碱法”。该方法中涉及的反应有 ①NaCl+CO2+NH3+H2O===NaHCO3+NH4Cl ②2NaHCO3Na2CO3+CO2↑+H2O 下列说法不正确的是( ) A.氯化钠由钠离子和氯离子构成 B.碳酸氢钠可用于治疗胃酸过多 C.该生产工艺中CO2可以循环利用 D.副产品氯化铵作氮肥时,应与碱性物质混合施用 8.(2019·改编题)金属镁广泛应用于火箭、导弹和飞机制造业。从海水或卤水中提取镁的流程如下所示,下列说法中错误的是( ) 海水或卤水氢氧化镁氯化镁金属镁 A.流程Ⅰ中试剂①可使用石灰乳,成本较低 B.流程Ⅰ、Ⅱ的主要目的是将海水或卤水中的氯化镁富集起来,提纯氯化镁 C.流程Ⅲ发生反应的化学方程式为MgCl2Mg+Cl2↑ D.流程Ⅲ将化学能转化为电能 9.(2016·泰州中考改编)海水是一种重要的资源,利用海水可制取镁等物质。有人设计如图实验流程: 下列说法错误的是( ) A.固体B是Mg(OH)2,试剂X为盐酸 B.操作Ⅰ和操作Ⅲ的操作方式完全相同 C.加入NaOH溶液应过量,其目的是使MgCl2完全反应 D.处理等量海水,若将NaOH溶液换成石灰乳,能节约成本 10.(2017·淄博沂源二模)从海水中制备纯碱和金属镁的流程如图所示: 8 下列说法不正确的是( ) A.步骤Ⅱ中吸氨的作用是使溶液呈碱性,促进二氧化碳吸收 B.第Ⅲ步反应的化学方程式为2NaHCO3Na2CO3+CO2↑+H2O C.步骤Ⅴ中所加试剂是盐酸 D.步骤Ⅳ发生的是置换反应 11.(2017·仙桃中考)粗盐中含有多种可溶性杂质(SO、Mg2+、Ca2+等)和难溶性杂质(泥沙等),以下是粗盐提纯思维导图,下列有关说法中不正确的是( ) A.①通过溶解、过滤操作,除去粗盐中难溶性杂质 B.②、③、④通过加入相应试剂沉淀杂质离子,是因为相应离子在溶液中不能大量共存 C.任意交换②、③、④中加入试剂的顺序并不影响杂质的除去 D.⑤加入适量稀HCl,调节溶液pH为7 12.(2019·改编题)我国化学家侯德榜创立了著名的“候氏制碱法”,促进了世界制碱技术的发展。如图是“侯氏制碱法”的流程简图,下列有关说法正确的是( ) A.沉淀池中的反应物只有两种 B.实验中要向食盐水中先通入CO2再通入NH3 C.析出晶体后剩余溶液中只有一种溶质 D.该技术的关键是在沉淀池中析出大量的碳酸氢钠固体 13.(2018·海南中考)三沙市是我国位置最南、总面积最大(含海域)、陆地面积最小的地级市。 8 (1)永兴岛上的饮用水主要利用海水淡化膜对海水进行二级脱盐后获得。分离原理如图所示,该原理与化学实验中常见的________操作相似。 (2)三沙海域的海水盐度高,从海水中获得食盐的方法是_________________ _________________________________________________________________。 (3)海水提取粗盐后的母液(苦卤)还可以用来提取金属镁,其流程如下,流程中,溶液A为________,其中没有发生的基本反应类型为______________________。 14.(2018·自贡中考)2017年5月,我国南海海域首次实现“可燃冰”试采成功。“可燃冰”为甲烷的水合物,其化学式为CH4·8H2O,主要是由甲烷与水在高压低温条件下形成的类冰状物质,可燃烧。 (1)目前使用的主要化石燃料有______、石油和天然气等。 (2)甲烷属于__________(填“有机物”或“无机物”) (3)可燃冰中元素质量比C∶H∶O为________________。 (4)可燃冰在空气中燃烧的化学方程式为___________________________。 (5)与化石燃料相比较,开采可燃冰的积极意义有__________________(写一条)。 15.(2017·淄博博山一模)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其模拟流程如图: (1)反应①的基本反应类型为____________,反应②的化学方程式________ ________________________________________________________________。 (2)工业上用分离液态空气的方法制取氮气,属于________(填“物理”或“化学”)变化。 8 (3)写出NH4Cl的一种用途:__________。 16.(2017·淄博张店三模)如图是模拟海水制盐的流程。 (1)操作a所需要的玻璃仪器有______________________。 (2)如何用实验证明第①步所加的Ca(OH)2溶液已过量? ____________________________________________________________________ ____________________________________________________________________ __________________________________________________________________。 (3)实验过程中,滤液的成分除了含有水和氯化钠外,还含有__________________________。 (4)为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式:____________________________________。如果要将精盐水继续提纯成NaCl晶体,应进行的操作是____________。 17.(2018·淄博周村一模)海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品。 (1)要鉴别海水是硬水还是软水,可选用__________。 (2)步骤①中选用蒸发结晶法而不用降温结晶法的理由是_________________ ________________________________________________________________。 (3)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和__________。 (4)步骤②发生反应的化学方程式是____________________________________ _____________________________,其基本反应类型为______________。 (5)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式______________________________________________。 18.(2018·淄博博山一模)二十一世纪是海洋开发与利用的世纪,海洋化学资源的综合利用将是重点发展领域之一。 8 (1)海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。海水晒盐是________(填“物理”或“化学”)变化,包含蒸发、________等过程。 (2)海水制镁:海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如图所示: Ⅰ.步骤①所加的碱应该是__________(填“氢氧化钠”或“石灰乳”),步骤②反应的化学方程式是_____________________________________________。 Ⅱ.Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些阻燃剂(阻碍燃烧的物质)的有效成分是Mg(OH)2。你认为Mg(OH)2能够阻燃的原因可能是__________(填序号)。 A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点 B.生成的氧化镁覆盖在可燃物表面,隔绝了空气 C.生成的水蒸气降低了可燃物周围氧气浓度 D.反应因吸热降低了环境温度,使可燃物不易达到着火点 19.(2019·原创题)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。 Ⅰ.工业制碱。工业上以粗盐(含少量MgCl2、CaCl2杂质)为原料,利用电解饱和食盐水的方法制备NaOH,其简要工艺流程如下: (1)步骤①中发生反应的基本反应类型是__________反应。 (2)步骤③中加入适量稀盐酸的目的是______________________________。 (3)验证步骤②中CaCl2已完全转化为CaCO3的方法是___________________ _______________________________________________________________。 (4)写出步骤④中反应的化学方程式_________________________________ ________________________________________________________________。 Ⅱ.海水提溴。从海水中提取的溴约占世界溴产量的1/3,工业上常用“吹出法”制溴,其工艺流程如下: 8 (1)步骤②中的化学方程式为2NaBr+Cl2===2NaCl+Br2,其反应类型是____________。 (2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:Cl2+2KBr===2KCl+Br2,Br2+2KI===2KBr+I2由此可判断Cl2、I2、Br2活动性由强到弱顺序是___________________________________________ ________________________。 参考答案 1.B 2.D 3.A 4.A 5.D 6.A 7.D 8.D 9.B 10.D 11.C 12.D 13.(1)过滤 (2)蒸发结晶(或蒸发溶剂) (3)盐酸 置换反应和化合反应 14.(1)煤 (2)有机物 (3)3∶5∶32 (4)CH4·8H2O+2O2CO2+10H2O (5)几乎不会造成环境污染(合理即可) 15.(1)分解反应 2NaHCO3Na2CO3+H2O+CO2↑ (2)物理 (3)作氮肥 16.(1)烧杯、漏斗、玻璃棒 (2)用玻璃棒蘸取第①步反应的上层清液,滴在pH试纸上,若试纸变蓝,则溶液显碱性,则所加的Ca(OH)2溶液已经过量 (3)Na2CO3、NaOH (4)Na2CO3+2HCl===2NaCl+H2O+CO2↑(或NaOH+HCl===NaCl+H2O) 蒸发结晶 17.(1)肥皂水 (2)氯化钠的溶解度受温度变化影响很小 (3)玻璃棒 (4)Mg(OH)2+2HCl===MgCl2+2H2O 复分解反应 (5)2NaBr+Cl2===2NaCl+Br2 8 18.(1)物理 结晶 (2)Ⅰ.石灰乳 Mg(OH)2+2HCl===MgCl2+2H2O Ⅱ.BCD 19.Ⅰ.(1)复分解 (2)除去过量的氢氧化钠、碳酸钠 (3)取反应后的滤液,加入碳酸钠,没有明显现象,证明氯化钙全部转化成碳酸钙沉淀 (4)2NaCl+2H2O2NaOH+H2↑+Cl2↑ Ⅱ.(1)置换反应 (2)Cl2、Br2、I2(或Cl2>Br2>I2) 8查看更多