新课标1高考化学试题及答案解析版
2015年高考化学试题及解析新课标1
7.我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写到:“性最烈,能蚀五金……其水甚强,五金八石皆能穿滴,惟玻璃可盛。”这里的“强水”是指( )
A.氨水 B.硝酸 C.醋 D.卤水
【答案】B
【解析】古代五金八石,五金指金、银、铜、铁、锡:八石,一般指朱砂、雄黄、云母、空青、硫黄、戎盐、硝石雌黄等八种矿物。卤水与我们生活息息相关,很多菜都与卤水有关,根据能腐蚀五金,显然只有硝酸符合答案。
8.NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 18gD2O和18gH2O中含有的质子数均为10NA
B.2L0.5mol﹒L-1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
D. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
【答案】 C
【解析】 D、H的相对原子质量不同,18gD2O中含有质子数18÷20×10NA=9NA,18gH2O中含有质子数18÷18×10NA=10NA,A错;亚硫酸是弱酸,H+不可能完全电离,溶液中含有的H+离子数小于2NA,所以B错;2molNO与1molO2恰好反应生成2molNO2,但NO2能转化为N2O4,存在化学平衡2 NO2 N2O4,所以D错过氧化钠与水反应时,过氧化钠既做氧化剂又做还原剂,2mol过氧化钠参加反应,生成1mol氧气,转移2mol电子,所以C对。
9.乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。
将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛
托品,则甲醛与氨的物质的量之比为( )
A.1:1 B.2:3 C.3:2 D. 2:1
【答案】 C
【解析】 根据乌洛托品的结构简式,可知它的分子式为C6H12N3,甲醛分子式为CH2O,氨的分子式为NH3,题干已说原料完全反应生成乌洛托品,根据C元素与N元素守恒,可知甲醛与氨的物质的量之比为6:4=3:2。
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A.
将硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液成血红色
稀硝酸将Fe氧化为Fe3+
B.
将铜粉加入1.0 mol﹒L-1Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将0.1 mol﹒L-1MgSO4溶液滴入NaOH溶液中至不在有沉淀产生,再滴加0.1 mol﹒L-1CuSO4溶液
先有白色沉淀生成,后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
【答案】 D
【解析】将硝酸加入过量铁粉中,生成硝酸亚铁,而KSCN溶液遇Fe3+,溶液成血红色,所以A错;铜与硫酸铁发生氧化还原反应:Cu + Fe2(SO4)3 = 2FeSO4 + CuSO4,没有黑色固体出现,所以B错;砂纸仔细打磨过的铝箔在酒精灯上加热,会在表面生成一层熔点很高的氧化铝薄膜,薄膜里面已熔化的单质铝不会滴落下来,所以C错;MgSO4溶液滴入NaOH溶液,生成Mg(OH)2沉淀,再滴加CuSO4溶液,生成Cu(OH)2沉淀,符合溶解度较小的沉淀易转化为溶解度更小的沉淀,所以Cu(OH)2的溶度积比Mg(OH)2的小。
- 8 -
11.微生物电池是指在微生物的作用下将化学能转化为电能的装置,
其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有CO2生成 B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区 D.电池总反应为C6H12O6 +6O2=6CO2+6H2O
【答案】 A
【解析】氧气通正极,介质环境为酸性(质子交换膜),所以正极反应为O2+4e-+4H+=2H2O,所以A错;微生物存在,装置原理为原电池原理,加快了化学反应速率,促进了反应中电子的转移,B正确;原电池中,带正电荷的离子移向正极,C正确;电池总反应相当于C6H12O6燃烧,所以D 正确。
12.W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A. 单质的沸点:W>X
B. 阴离子的还原性:W>Z
C.氧化物的水化物的酸性:Y
Cl-,所以B正确;S和Cl都不止一种含氧酸,题目没有说最高价态的氧化物的水化物的酸性,HClO是弱酸,H2SO4是强酸,所以C错;铵盐为离子化合物,H与N能存在于同一离子化合物中,所以D错误。
13.浓度为0.10 mol﹒L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示下列叙述错误的是( )
pH
13
12
11
10
9
8
1 2 3 4 lg
MOH
ROH
﹒
﹒
a
b
A. MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则增大
【答案】D
【解析】 0.10 mol﹒L-1的MOH和ROH溶液,看其图像上起点,MOH
的pH值为13,MOH完全电离,为强碱,ROH的pH值小于13,ROH
没有完全电离,为弱碱,所以A正确;弱电解质越稀释越电离,
- 8 -
b点稀
释100倍大于a点稀释10倍 ,所以B正确;碱性溶液无限稀释,溶液
pH值无限接近于7,所以C正确;升高温度,促进弱电解质电离,当
lg=2时,若两溶液同时升高温度,没有变化,增
大,减小,所以D错。
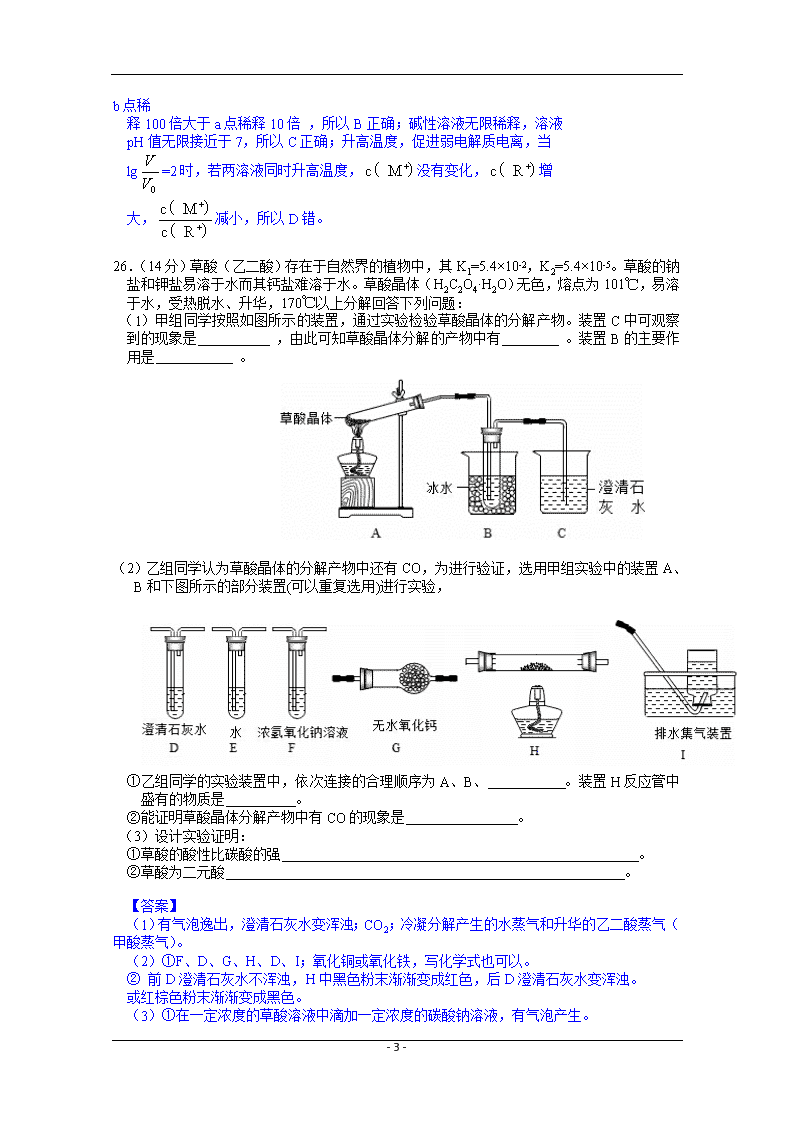
26.(14分)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水而其钙盐难溶于水。草酸晶体(H2C2O4·H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 。装置B的主要作用是 。
(2)乙组同学认为草酸晶体的分解产物中还有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验,
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 。装置H反应管中盛有的物质是 。
②能证明草酸晶体分解产物中有CO的现象是 。
(3)设计实验证明:
①草酸的酸性比碳酸的强 。
②草酸为二元酸 。
【答案】
(1)有气泡逸出,澄清石灰水变浑浊;CO2;冷凝分解产生的水蒸气和升华的乙二酸蒸气(甲酸蒸气)。
(2)①F、D、G、H、D、I;氧化铜或氧化铁,写化学式也可以。
② 前D澄清石灰水不浑浊,H中黑色粉末渐渐变成红色,后D澄清石灰水变浑浊。
或红棕色粉末渐渐变成黑色。
(3)①在一定浓度的草酸溶液中滴加一定浓度的碳酸钠溶液,有气泡产生。
- 8 -
或向碳酸氢钠溶液中滴加一定浓度的草酸溶液,有气泡产生。
②用0.10mol﹒L-1NaOH溶液来滴定10mL0.10 mol﹒L-1草酸溶液,消耗NaOH溶液的体积为20mL。
或在滴有酚酞的10mL0.10 mol﹒L-1草酸溶液中,滴加10mLNaOH溶液后,再滴加10mLNaOH溶液,溶液颜色由无色变为红色。
方案合理即可。
【解析】(1)根据澄清石灰水,可知考察CO2相关知识,根据题干,草酸晶体受热脱水、升华,装置B作用是冷凝水蒸气和草酸蒸气。
(2)①考察CO2、CO混合气体相关性质,检验CO时,用CO的还原性将CuO还原,先要将CO2除去,并确保除去,再干燥。还要注意尾气处理。
②前D澄清石灰水不浑浊,H中黑色粉末渐渐变成红色,后D澄清石灰水变浑浊。
(3)① 根据草酸能制取碳酸设计方案
② 二元酸与一元碱进行滴定实验,消耗的碱的物质的量是二元酸的2倍。
【2015新课标Ⅰ卷理综化学】(14分)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。 然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是 (填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
【答案】(1) Mg2B2O5·H2O+2H2SO42MgSO4+2H3BO3;减小铁硼矿粉粒径、提高反应温度。
(2) Fe3O4; SiO2和CaSO4;
- 8 -
(3)将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物而除去。
(4)(七水)硫酸镁
(5)
(6) 2H3BO3 B2O3+3HO B2O3+3Mg 3MgO+2B
27.(15分)碘及化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,。该反应的还原产物为 。
(2)上述浓缩液中主要含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时溶液中为 。已知KSP(AgCl)=1.8×10-10,KSP(AgI)=8.5×10-17。
(3)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需要吸收的能量为 kJ。
(4)Bodensteins研究了下列反应:2HI(g) H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
①根据上述实验结果,该反应的平衡常数K的计算式为 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数则k逆为 (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= 。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 (填字母)。
【答案】
(1)MnSO4(或Mn2+)
(2)4.7×10-7
(3)299
(4)①
②,1.95×10-3min-1
③A、E
【解析】(1)用水浸取后碘以I-存在,加了MnO2和H2SO4后发生氧化还原反应,I-被氧化成I2,MnO2做氧化剂,被还原成+2价的Mn2+还原产物。
(2)KSP(AgCl)=1.8×10-10>KSP(AgI)=8.5×10-17,滴加AgNO3溶液,当AgCl开始沉淀时, AgI
- 8 -
肯定已经沉淀,此时溶液中c(Ag+)·c(Cl-)= KSP(AgCl),c(Ag+)·c(I-)= KSP(AgI),而c(Ag+)是相同的,所以=4.7×10-7。
(3)△H=反应物的键能和-生成物的键能和,则1mol HI(g)分子中化学键断裂时需要吸收的能量为(11+436+151)÷2=299kJ。
(4)①根据表格,两种投料建立化学平衡,一个从正反应建立平衡,一个从逆反应建立平衡,2HI(g) H2(g)+I2(g)是等气反应,x(HI)交叉点在0.784,所以在120min反应达到平衡。根据x(HI)=1(0min)和x(HI)=0.784(120min),可求出平衡时x(H2)= x(I2)=0.108。根据平衡常数定义,物质的量分数还需转换为浓度,设起始投有amolHI,容器体积为V,
则K==
② 由①可知,K=, v正=k正x2(HI),v逆=k逆x(H2)x(I2), ,平衡时v正= v逆,
k逆==;40min时,v正=k正x2(HI)=0.852×0.0027=0.00195075≈1.95×10-3min-1,注意带单位。
③升高温度,2HI(g) H2(g)+I2(g),正反应吸热,平衡向右移动,正逆化学反应速率等倍增大(排除F、C),x(HI)减小,x(H2)增大(排除D、B)。
36.[化学——选修2:化学与技术](15分)
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下:
回答下列问题:
(1)步骤①中得到的氧化产物是 。溶解温度应控制在60~70℃,原因是 。
(2)写出步骤③中的主要反应的离子方程式: 。
(3)步骤⑤中包括用pH=2酸洗、水洗两步操作,酸洗采用的酸是 (写名称)。
(4)上述工艺中,步骤⑥不能省略,理由是 。
(5)步骤②、④、⑤、⑧都要进行固液分离,工业上常用的固液分离设备有 (填字母)。
A.分馏塔 B.离心机 C.反应塔 D.框式压滤机
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3
- 8 -
溶液中,待样品完全溶解后,加入适量稀硫酸用
amol﹒L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中Cr2O72-被还原成Cr3+。样品中CuCl的质量分数为 。
【答案】
(1)CuSO4或Cu2+;温度低溶解速度慢、温度过高铵盐分解。
(2)2Cu2++SO32-+2Cl-+H2O=2CuCl↓+SO42-+2H+
(3)硫酸
(4)醇洗有利于加快去除CuCl表面水分,防止其水解氧化。
(5)B、D
(6)
37.[化学——选修3:物质结构与性质](15分)
碳及化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态14C原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 ,C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于 晶体。
(5)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
【答案】
(1)电子云;2 (2)C有4个价电子且半径小,难以通过得或失电子达到稳定电子结构。
(3)键和键;sp;CO2,SCN-,COS等 (4)分子 (5)①3;2②12;4
38.[化学——选修3:有机化学基础](15分)
A(C2H2)是基本有机化工原料,由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
回答下列问题:
- 8 -
(1)A的名称是 ,B含有的官能团是 。
(2)①的反应类型是 ,⑦的反应类型是 。
(3)C和D的结构简式分别为 、 。
(4)异戊二烯分子中最多有 个原子共面,顺式聚异戊二烯的结构简式为 。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体 (填结构简式)。
(6)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线 。
参考【答案】
(1)乙炔;碳碳双键和酯基(写结构式也可)
(2)加成反应;消去反应
[CH2-CH ] n
;________________________________________________________________________________________________________OH
(3) ;CH3CH2CH2CHO
[CH2 CH2 ] n
C= ;________________________________________________________________________________________________________CCC
H3C
H
(4) 11个;
CH3-CH-C≡CH
CH3
(5)
;CH3-CH2-CH2-C≡CH ;CH3-CH2-C≡C-CH3
KOH
H2
Pd/PbO
CaCO3
CH3-CH-C≡CH
OH
Al2O3
△
C2H2
CH3CHO
CH3-CH-C=CH2
OH
(6)
【解析】本题较简单。
(1)反应②是B的加聚反应,根据加聚反应只与不饱和键相关,所以B含有的官能团是碳碳双键和酯基。
[CH2-CH ] n
;________________________________________________________________________________________________________OH
(2)把乙炔和CH3COOH原子相加的C4H6O2,所以①的反应类型是加成反应;根据反应⑦反应前后分子结构易判断⑦的反应类型是消去反应。
[CH2-CH ] n
OCCH3
O
(3) 在酸性条件水解属于酯类水解,所以C的结构简式为 ;
根据反应④及产物聚乙烯醇缩丁醛,易知D为正丁醛,结构简式为CH3CH2CH2CHO。
[CH2 CH2 ] n
C= ;________________________________________________________________________________________________________CCC
H3C
H
(4)根据乙烯所有原子共面和甲烷最多三原子共面原理,可推异戊二烯分子中除了甲基上有两个H原子不能与其他原子共面,其他原子都可以共面,异戊二烯分子中最多有11个原子共面;顺式聚异戊二烯,两个亚甲基在双键的同侧,结构简式为:
(5)相当于写戊炔的同分异构体。
(6)根据题干弄清碳碳三键与羰基的加成反应原理即可。
- 8 -