- 2021-05-13 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
离子浓的大小比较一轮复习高考使用
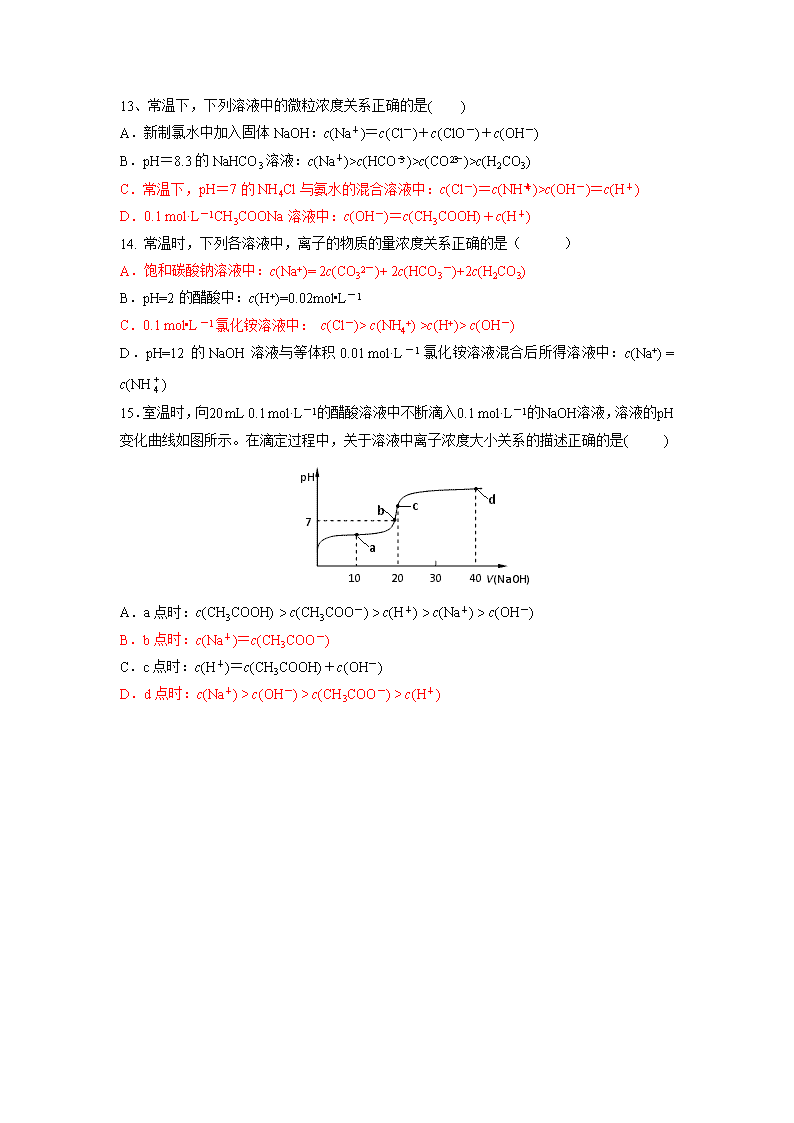
水溶液中的离子平衡(一) ★ 备注:以下选择题均为双选 1、25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是 ( ) A.溶液中的 c(OH-) = 1×10-10 mol·L-1 B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-) C.溶液中的c(H+) + c(NH4+) = c(Cl-) + c(OH-) D.溶液中的c(NH3·H2O) = c(NH4+) 2.对于常温下pH=3的乙酸溶液,下列说法正确的是 ( ) A.与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 B.加水稀释到原体积的10倍后溶液pH变为4 C.加入少量乙酸钠固体,溶液pH升高 D.加水稀释后,溶液中c(H+)和c(OH-)都减小 3.在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2OHCO3-+OH-。下列说法正 确的是 ( ) A.Na2CO3溶液中:2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3) B.加入NaOH固体,溶液中c(Na +)和c(CO32-)都增大 C.稀释Na2CO3溶液,溶液中的离子浓度都减少 D.升高温度,Na2CO3溶液pH增大 4、对于常温下pH为12的氢氧化钠溶液,叙述正确的是 ( ) A.将此溶液稀释106倍,溶液的pH=6 B.与等体积等浓度的氯化铵溶液混合后所得溶液呈中性 C.与pH=2的CH3COOH溶液任意比混合: c(H+) + c(Na+) =c(OH-) + c(CH3COO-) D.与0.01 mol·L-1 的CH3COOH溶液等体积混合所得溶液中: c (Na+)>c(CH3COO-)>c(OH-)>c(H+) 5. 下列关于pH=12的Na2CO3溶液说法正确的是 ( ) A. 升高溶液温度,溶液pH增大 B. c(Na+) +c(H+)=c(CO32-)+ c(HCO3-)+ c(OH-) C. 溶液中c(OH-)>c(HCO3-)> c(H+) D. 2c(Na+)=c(CO32-)+ c(HCO3-)+ c(H2CO3) 6.HA为一元弱酸,在0.1 mol·L-1NaA溶液中,下列说法正确的是:( ) A.室温下,该溶液的pH=7 B.适当加热该溶液,溶液的PH值升高 ① pH V(HCl)/mL 10 20 7 ② ③ C.c(Na+)> c(A-)> c(H+)> c(OH-) D.c(Na+)+ c(H+)= c(A-)+ c(OH-) 7.常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3•H2O溶液,滴定曲线如下图。下列说法正确的是 ( ) A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+) B.②溶液:c(NH4+) = c(C1—)>c(OH—) = c(H+) C.③溶液:c(OH—)>c(H+) D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+) 8.常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化) ( ) A.溶液的pH值:②>③>① B.水电离出的c(OH-):③>①=② C.①和③等体积混合后的溶液:c(CH3COOH)+ c(CH3COO-)=0.1mol/L D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-) 9.常温下,100ml 蒸馏水中加入0.1mol CH3COONa ,下列说法正确的是 ( ) A、该溶液中存在: c(Na+) + c(H+)=c(OH—)+c(CH3COO—) B、加入酚酞后加热,溶液颜色变浅 C、若在该溶液再通入0.1mol HCl,存在: c(Na+)>c(CH3COO—)> c(H+) D、若在该溶液中再投入0.1mol NaCl,存在: c(Na+)=c(Cl—)+c(CH3COO—)+c(CH3COOH) 10.下列各溶液中,微粒的物质的量浓度关系正确的是 A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合后: c(NH4+)>c(Cl-)> c(OH-)>c(H+) B.0.1 mol·L-1 Na2CO3溶液:c(Na+)=2c(HCO)+2c(CO32¯)+2c(H2CO3) C.0.1 mol·L-1 NH4Cl溶液:c(NH)=c( Cl-) D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 11.下列各溶液的叙述中不正确的是 pH a b c Ⅰ Ⅱ 溶液体积 A.等pH的硫酸与醋酸稀释后pH的变化如右图所示, 则曲线Ⅱ表示的是醋酸的稀释图像 B.溶有等物质的量的NaClO、NaHCO3的溶液中: c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) C.若NH4HCO3溶液、NH4HSO4溶液中c(NH4+)相等,则: c(NH4HSO4)﹥c(NH4HCO3) D.已知某温度下Ksp(CH3COOAg) = 2.8×10-3,浓度均为0.1 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定能产生CH3COOAg沉淀 12.下列叙述正确的是 ( ) A.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-)+c(CH3COOH)=2c(Na+) C.常温下,向NH4Cl溶液中加入氨水至溶液的pH=7,此时溶液中c(NH4+)>c(C1-) D.0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH-)>c(H+) 13、常温下,下列溶液中的微粒浓度关系正确的是( ) A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO)>c(CO)>c(H2CO3) C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH)>c(OH-)=c(H+) D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+) 14. 常温时,下列各溶液中,离子的物质的量浓度关系正确的是( ) A.饱和碳酸钠溶液中:c(Na+)= 2c(CO32-)+ 2c(HCO3-)+2c(H2CO3) B.pH=2的醋酸中:c(H+)=0.02mol•L-1 C.0.1 mol•L-1氯化铵溶液中: c(Cl-)> c(NH4+) >c(H+)> c(OH-) D.pH=12的NaOH溶液与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH) 15.室温时,向20 mL 0.1 mol·L-1的醋酸溶液中不断滴入0.1 mol·L-1的NaOH溶液,溶液的pH 变化曲线如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述正确的是( ) 40 V(NaOH) (mL) pH 30 20 10 7 b d c a A.a点时:c(CH3COOH) > c(CH3COO-) > c(H+) > c(Na+) > c(OH-) B.b点时:c(Na+)=c(CH3COO-) C.c点时:c(H+)=c(CH3COOH)+c(OH-) D.d点时:c(Na+) > c(OH-) > c(CH3COO-) > c(H+) 水溶液中的离子平衡(二) ★ 备注:以下选择题均为双选 1.现有常温下的四份溶液:①0.01 mol·L-1 CH3COOH;②0.01 mol·L-1 HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是( ) A.①中水的电离程度最小,③中水的电离程度最大 B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③ C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性 D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①>② 2.下列有关电解质溶液中微粒的关系不正确的是( ) A.25℃时,pH=4的氯化铵溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) B.25℃时,pH=3的氯化铵溶液中: c(OH-)=1.0×10-11mol·L-1 C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中: c(Na+) = c(SO42-) >c(NH4+) >c(H+) > c(OH-) 3.50℃时,下列各溶液中,离子的物质的量浓度关系正确的是( ) A.pH=4的醋酸中:c(H+)=4.0 mol·L-1 B.饱和小苏打溶液中:c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+ c(OH-) D. pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1 4.有关下列溶液的叙述正确的是( ) A.醋酸与醋酸钠的混合溶液中:c(CH3COO-) + c(OH-) = c(Na+) + c(H+) B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) C.0.1 mol·L-1的硫酸铵溶液中: c(SO42-) >c(NH4+)>c(H+)> c(OH-) D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: n(K+) = n(S2-)+n(HS-)+n(H2S) = 1mol 5.下列叙述正确的是( ) A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则: c(CH3COO-)+ c(CH3COOH) = 2c(Na+) 6.在25℃时,将0.2molCH3COONa晶体和0.1molHCl气体同时溶解于同一烧杯的水中,制 得1L溶液,若此溶液中c(CH3COO—)>c(Cl—),则下列判断不正确的是( ) A.该溶液的pH大于7 B.c(CH3COOH)+c(CH3COO—)=0.20mol·L—1 C.c(CH3COOH)查看更多