- 2021-05-13 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
通用版高考化学微一轮复习物质的分离和提纯学案20180509154
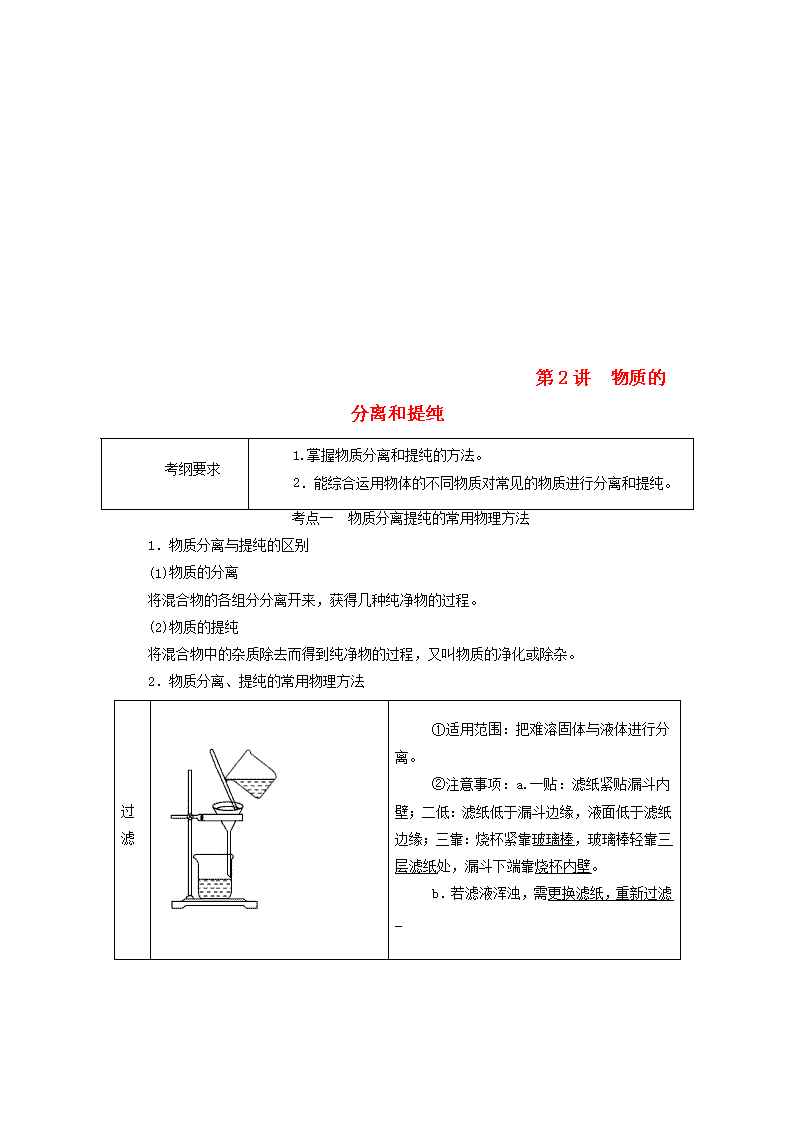
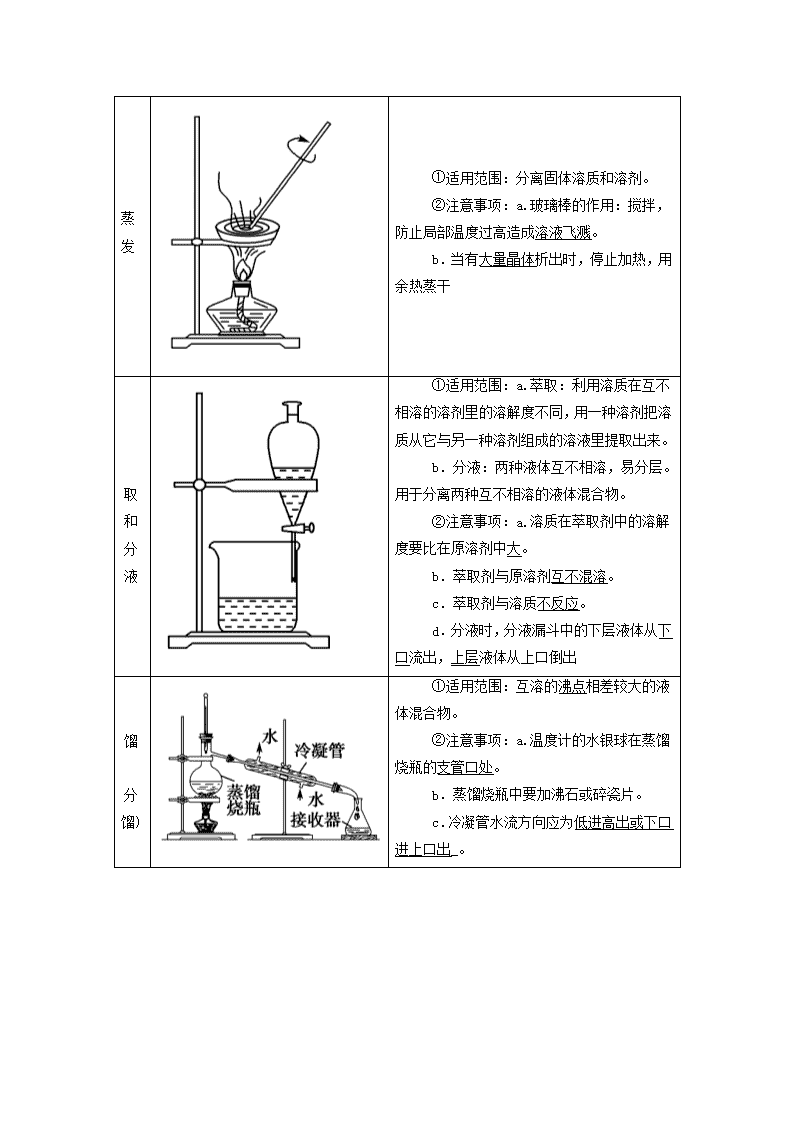
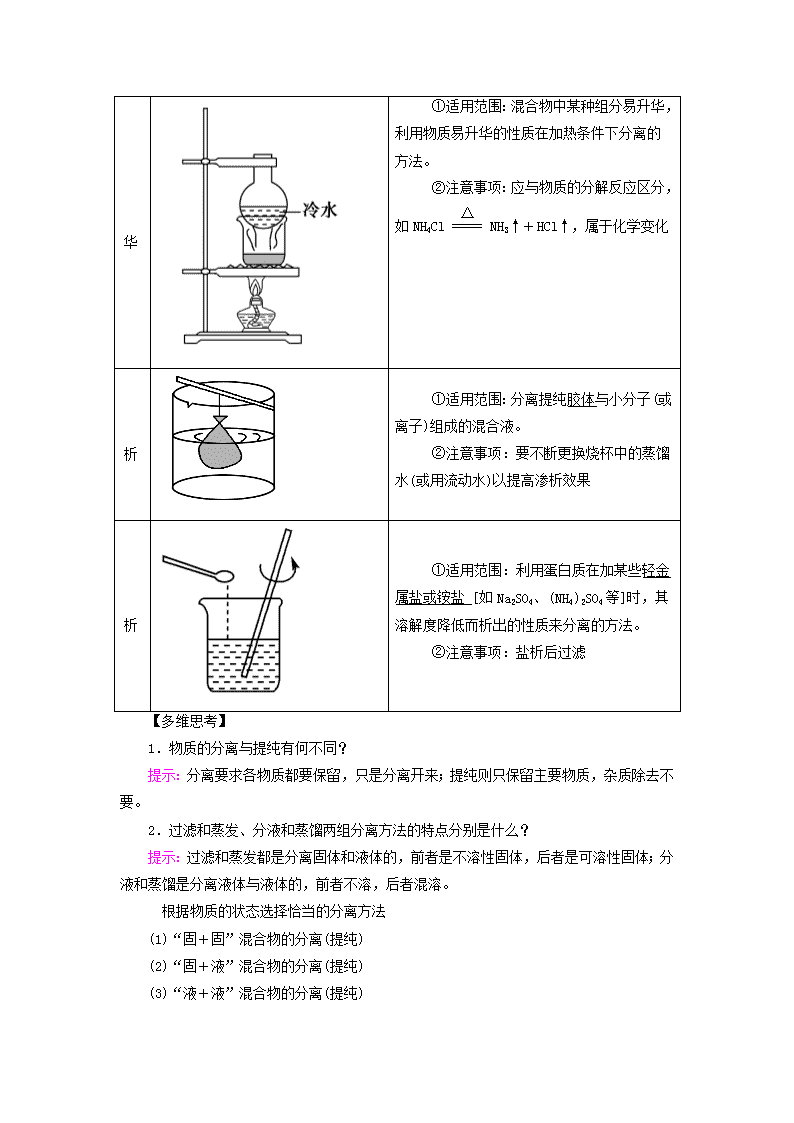
第2讲 物质的分离和提纯 考纲要求 1.掌握物质分离和提纯的方法。 2.能综合运用物体的不同物质对常见的物质进行分离和提纯。 考点一 物质分离提纯的常用物理方法 1.物质分离与提纯的区别 (1)物质的分离 将混合物的各组分分离开来,获得几种纯净物的过程。 (2)物质的提纯 将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。 2.物质分离、提纯的常用物理方法 过滤 ①适用范围:把难溶固体与液体进行分离。 ②注意事项:a.一贴:滤纸紧贴漏斗内壁;二低:滤纸低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端靠烧杯内壁。 b.若滤液浑浊,需更换滤纸,重新过滤_ 蒸发 ①适用范围:分离固体溶质和溶剂。 ②注意事项:a.玻璃棒的作用:搅拌,防止局部温度过高造成溶液飞溅。 b.当有大量晶体析出时,停止加热,用余热蒸干 萃取和分液 ①适用范围:a.萃取:利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液里提取出来。 b.分液:两种液体互不相溶,易分层。用于分离两种互不相溶的液体混合物。 ②注意事项:a.溶质在萃取剂中的溶解度要比在原溶剂中大。 b.萃取剂与原溶剂互不混溶。 c.萃取剂与溶质不反应。 d.分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出 蒸馏 (分馏) ①适用范围:互溶的沸点相差较大的液体混合物。 ②注意事项:a.温度计的水银球在蒸馏烧瓶的支管口处。 b.蒸馏烧瓶中要加沸石或碎瓷片。 c.冷凝管水流方向应为低进高出或下口进上口出_。 升华 ①适用范围:混合物中某种组分易升华,利用物质易升华的性质在加热条件下分离的方法。 ②注意事项:应与物质的分解反应区分,如NH4ClNH3↑+HCl↑,属于化学变化 渗析 ①适用范围:分离提纯胶体与小分子(或离子)组成的混合液。 ②注意事项:要不断更换烧杯中的蒸馏水(或用流动水)以提高渗析效果 盐析 ①适用范围:利用蛋白质在加某些轻金属盐或铵盐_[如Na2SO4、(NH4)2SO4等]时,其溶解度降低而析出的性质来分离的方法。 ②注意事项:盐析后过滤 【多维思考】 1.物质的分离与提纯有何不同? 提示:分离要求各物质都要保留,只是分离开来;提纯则只保留主要物质,杂质除去不要。 2.过滤和蒸发、分液和蒸馏两组分离方法的特点分别是什么? 提示:过滤和蒸发都是分离固体和液体的,前者是不溶性固体,后者是可溶性固体;分液和蒸馏是分离液体与液体的,前者不溶,后者混溶。 根据物质的状态选择恰当的分离方法 (1)“固+固”混合物的分离(提纯) (2)“固+液”混合物的分离(提纯) (3)“液+液”混合物的分离(提纯) 考向一 物质分离、提纯方法的选择 1.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。 下列说法错误的是 ( ) A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗 C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置 解析:滤液与不溶物是用过滤的方法分离的,A项正确;分离水层与有机层,需要用分液漏斗,B项正确;溶液蒸发结晶应用蒸发皿,C项错误;用蒸馏的方法从有机层溶液中蒸出甲苯,D项正确。 答案:C 2.下列实验中,所采取的分离方法与对应原理都正确的是( ) 选项 目的 分离 方法 原理 A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大 B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同 C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大 D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大 解析:乙醇与水互溶,不能作萃取剂,A错误;乙酸乙酯与乙醇互溶,不能用分液的方法分离,B错误;除去硝酸钾中的氯化钠可用重结晶的方法,是由于氯化钠在水中的溶解度受温度变化的影响较小,故C错误;乙醚和丁醇互溶,但沸点相差较大,可用蒸馏的方法进行分离,D正确。 答案:D 考向二 对分离、提纯操作的考查 3.下列实验操作中错误的是 ( ) A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 B.蒸馏操作时.应使温度计水银球靠近蒸馏烧瓶的支管口处 C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出 D.蒸发操作时,应使混合物中的水分完全蒸干后,再停止加热 答案:D 4.海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图: (1)实验室焙烧海带,需要下列仪器中的________(填字母)。 a.试管 b.烧杯 c.坩埚 d.泥三角 e.三脚架 f.酒精灯 (2)指出提取碘的过程中有关的实验操作名称:①________,③________。 (3)提取碘的过程中,可选择的有机试剂是______(填字母)。 A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油 (4)为使海藻灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______、______。 (5)小组用CCl4萃取碘水中的碘,在右图的分液漏斗中,下层液体呈________色;他们打开分液漏斗活塞,却未见液体流下,原因可能是_________________________________________。 (6)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出下面实验装置图中的错误之处: ①___________________________________________________; ②___________________________________________________; ③___________________________________________________。 (7)进行上述蒸馏操作时,使用水浴加热的原因是__________________________________________________________ ________________________________________________________________________,最后晶体碘在________里聚集。 解析:海带要在坩埚中焙烧,选择萃取剂要与水互不相溶。蒸馏操作时注意冷凝水的方向,加热烧杯要垫石棉网。 答案:(1)cdef (2)过滤 萃取分液 (3)B (4)分液漏斗 普通漏斗 (5)紫红 分液漏斗上口活塞小孔未与空气相通 (6)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒 (7)使蒸馏烧瓶受热均匀,控制加热温度不至过高 蒸馏烧瓶 考点二 物质分离、提纯的化学方法 物质分离、提纯的化学方法 方法 适用条件 举例 加热 分解法 混合物中混有热稳定性差的杂质时,可直接加热,使热稳定性差的杂质分解而分离出去 纯碱中混有小苏打 沉淀法 在混合物中加入某 试剂,使杂质离子以沉淀形式分离出去的方法 加适量AgNO3溶液除去KNO3溶液中的KCl 转化法 不能通过一次反应达到分离的目的时,要经过转化为其他物质才能分离,然后将转化物质恢复为原物质 分离Fe3+和Al3+时,可加入过量的NaOH溶液,生成Fe(OH)3沉淀和NaAlO2溶液,过滤后,向Fe(OH)3中加入盐酸重新生成Fe3+,向NaAlO2中通入过量CO2,生成Al(OH)3沉淀,过滤后向Al(OH)3中加入盐酸重新生成Al3+ 酸碱 溶解法 被提纯物质不与酸碱反应,而杂质可与酸碱发生反应 用盐酸除去SiO2中的石灰石;用NaOH溶液除去铁粉中的铝粉 氧化 还原法 ①对混合物中混有的还原性杂质,可加入适当的氧化剂使其被氧化为被提纯物质 ②对混合物中混有的氧化性杂质,可加入适当的还原剂将其还原为被提纯物质 通入Cl2将FeCl3加混有的FeCl2氧化成FeCl3,达到除杂目的;将过量铁粉加入混有FeCl3的FeCl2溶液中,振荡、过滤,可除去FeCl3杂质 调节 pH法 通过加入试剂来调节溶液的pH,使溶液中某种成分沉淀分离的方法 CaCl2溶液中含有FeCl3杂质,由于FeCl3的水解,溶液呈酸性,可采用调节溶液pH的方法将Fe3+沉淀,为此,可加CaCO3 电解法 利用电解原理来分离、提纯物质 电解精炼铜 气化法 将杂质离子转化为气体 把CO、HCO、SO、HSO、NH转化为气体 【多维思考】 1.用过量氨水除去Al3+溶液中的Fe3+是否可行,为什么? 提示:不可行,因为生成的Al(OH)3不溶于过量氨水,无法与Fe(OH)3分离。 2.除去乙醇中少量H2O,如何操作? 提示:先加入生石灰与H2O反应生成Ca(OH)2,然后蒸馏,得到纯净的乙醇。 分离和提纯物质应遵循的原则 (1)不引入新杂质的原则。如果引入杂质则在后续操作中必须除去。 (2)不损耗、不减少被提纯物质的原则。 (3)实验操作要简便易行的原则。 1.下列实验操作正确的是( ) A.向混有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡静置,用装置甲分液,放出水相后再从分液漏斗下口放出有机相 B.用装置乙加热分解法除去Na2CO3中混有的少量NaHCO3 C.用装置丙除去氯气中的HCl气体 D.除去Cu粉中混有的CuO:加适量稀硫酸后,过滤、洗涤 答案:D 2.下列除杂方案错误的是( ) 选项 被提纯的物质 杂质 除杂试剂 除杂方法 A CO(g) CO2(g) NaOH溶液、浓H2SO4 洗气 B NH4Cl(aq) Fe3+(aq) NaOH溶液 过滤 C Cl2(g) HCl(g) 饱和食盐水、浓H2SO4 洗气 D Na2CO3(s) NaHCO3(s) - 灼烧 答案:B 3.除去下列混合物中少量的杂质(括号内的物质为杂质)所选试剂、主要仪器及操作方法都合理的是( ) 选项 样品(杂质) 加入试剂 主要仪器 主要操 作方法 A Fe2O3(Al2O3) NaOH溶液 长颈漏斗 过滤、洗涤 B 乙醇(水) CaO 蒸馏烧瓶 蒸馏 C C2H6(C2H4) 酸性 KMnO4溶液 洗气瓶 洗气、干燥 D NaCl溶 液(Br2) CCl4 分液漏斗 萃取、蒸馏 解析:A项中加入NaOH溶液后用普通漏斗过滤;C项中酸性KMnO4溶液将C2H4氧化为CO2,会引入新的杂质,应选择溴水;D项中操作方法应为萃取、分液。 答案:B 1.(2019·高考全国卷Ⅰ)《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是( ) A.蒸馏 B.升华 C.干馏 D.萃取 解析:“将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结……”,属于固体直接转化为气体,类似于碘的升华,因此涉及的操作方法是升华,故选B。 答案:B 2.(2019·高考北京卷)下列中草药煎制步骤中,属于过滤操作的是( ) A.冷水浸泡 B.加热煎制 C.箅渣取液 D.灌装保存 解析:A.冷水浸泡属于物质的溶解,故错误;B.加热煎制属于加热,故错误;C.箅渣取液属于过滤操作,故正确;D.灌装是液体转移,故错误。 答案:C 3.(2019·高考全国卷Ⅲ)过氧化钙微溶于水,溶于酸,可用作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题: (一)碳酸钙的制备 (1)步骤①加入氨水的目的是________。小火煮沸的作用是使沉淀颗粒长大,有利于________。 (2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。 a.漏斗末端颈尖未紧靠烧杯壁 b.玻璃棒用作引流 c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗 e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度 (二)过氧化钙的制备 CaCO3滤液 白色结晶 (3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是________________。 (4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是________________。 (5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是____________。 (6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是________,产品的缺点是________。 解析:(1)反应中盐酸过量,且溶液中含有铁离子,因此步骤①加入氨水的目的是中和多余的盐酸,沉淀铁离子;小火煮沸的作用是使沉淀颗粒长大,有利于过滤。 (2)a.过滤时漏斗末端颈尖应该紧靠烧杯内壁,a错误;b.玻璃棒用作引流,b正确;c.将滤纸湿润,使其紧贴漏斗壁,防止有气泡,c正确,d.滤纸边缘应该低于漏斗,d错误;e.用玻璃棒在漏斗中轻轻搅动容易弄碎滤纸,e错误,答案选ade。 (3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中有二氧化碳生成,因此溶液呈酸性。溶液含有二氧化碳,而过氧化钙能与酸反应,因此将溶液煮沸的作用是除去溶液中溶解的CO2。 (4)根据原子守恒可知反应中还有氯化铵和水生成,则步骤③中反应的化学方程式为CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O;双氧水不稳定,受热易分解,因此该反应需要在冰浴下进行的原因是防止过氧化氢分解。 (5)过氧化钙在乙醇中的溶解度小,使用乙醇洗涤的目的是去除结晶表面的水分。 (6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是原料来源丰富、操作简单,产品的缺点是得到产品的纯度较低。 答案:(1)调节溶液pH使Fe(OH)3沉淀 过滤分离 (2)ade (3)酸 除去溶液中溶解的CO2 (4)CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2O 温度过高时过氧化氢分解 (5)去除结晶表面水分 (6)工艺简单、操作简单 纯度较低 4.研究物质的性质时,首先要分离提纯物质,对物质进行分离提纯是化学实验的重要内容。 Ⅰ.现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体。某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案: (1)操作①中发生反应的化学方程式是_____________________ _________________________________________________________。 (2)操作②中BaCl2溶液能否改用硝酸钡溶液________(填“能”或“不能”)。如果能,下一空不需要回答;如果不能,请说明理由:__________________________________________________ __________________________________________________________ _________________________________________________________。 (3)操作③的目的是____________________________________ _________________________________________________________。 (4)操作④的目的是___________________________________。 Ⅱ.为提纯某Fe2O3样品(主要杂质有SiO2、Al2O3)参照上述实验操作,请设计一种以框图形式表示的实验方案(注明物质和操作)。 解析:Ⅰ.NH4HCO3可通过加热分解而除去;Na2SO4中的SO可通过加入BaCl2溶液除去。Ba(NO3)2会引入NO杂质。操作③加过量Na2CO3除去过量的Ba2+;加热煮沸除去滤液中溶解的CO2和HCl。Ⅱ.Fe2O3是碱性氧化物,SiO2是酸性氧化物,Al2O3是两性氧化物,可据此选择试剂。 答案:Ⅰ.(1)NH4HCO3NH3↑+CO2↑+H2O (2)不能 选用Ba(NO3)2溶液会引入新的杂质离子NO (3)除去过量的Ba2+ (4)除去溶解在溶液中的CO2气体和HCl查看更多