化学选修四高考试题汇编
化学选修四试题汇编
1、 下列说法正确的是( )
A.铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
B. 汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
C. 原电池中阳离子向负极移动,电解池中阳离子向阴极移动
D.某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
E. 明矾可以用于净水,将明矾溶液加热、蒸干、灼烧,得到氧化铝
F.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
2. 短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A. W2-、X+ B. X+、Y3+ C. Y3+、Z2- D. X+、Z2-
3. 银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S = 6Ag+A12S3 D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
4.已知KSP(AgCl)=1.56×10-10,KSP(AgBr)=7.7×10-13,KSP(Ag2CrO4)=9.0×10-12。某溶液中含有C1-、Br-和CrO42-,浓度均为0.010 mo1·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,产生沉淀的先后顺序为( )
A. C1- 、Br- 、CrO42- B. CrO42-、Br- 、C1- C. Br-、C1- 、CrO42- D. Br- 、CrO42- 、C1-
5.将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是
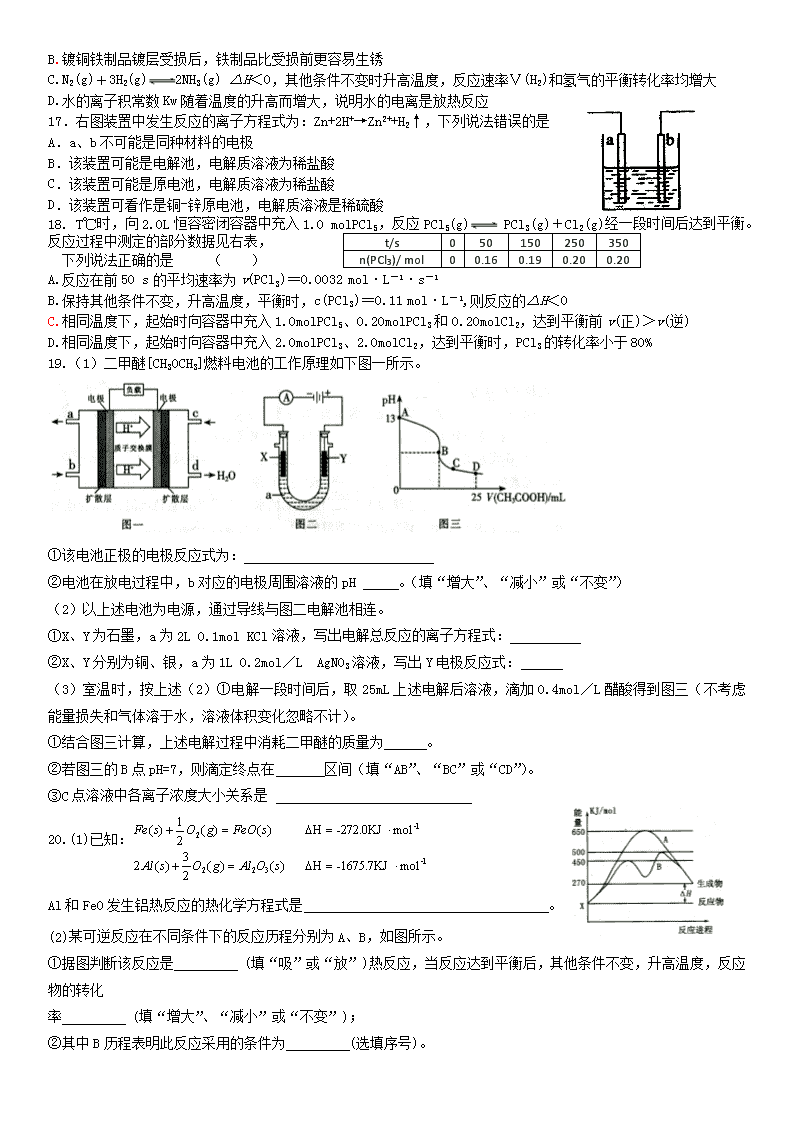
A.标准状况下,反应过程中得到7.84L的气体 B.最终得到的溶液中c(Na+)=c(Cl-)
C.最终溶液改为通入CO2气体,仍能得到沉淀 D.最终得到的溶液中c(Al3+)=1.0 mol·L-1
6.下列事实与其对应的方程式解释均正确的是 ( )
A.用惰性电极电解MgCl2 溶液:2Cl- + 2H2O 2OH- + H2↑ + Cl2↑
B.1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:
N2(g)+3H2(g) 3NH3(g)△H=-73kJ/mol
C.0.05mol/LNaH2PO4溶液pH<1的原因:NaH2PO4=Na++2H++PO43-
D.SO2使酸性KMnO4溶液褪色:5SO2+2MnO4-+2H2O====5SO2-4+2Mn2++4H+
E.将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-===Al2S3↓
7.氨的催化氧化过程主要有以下两个反应:
(ⅰ)4NH3(g) + 5O2(g)4NO(g) + 6H2O(g) ΔH=—905.5kJ/mol
(ⅱ)4NH3(g) + 3O2(g)2N2(g) + 6H2O(g) ΔH=—1267kJ/mol
测得温度对NO、N2产率的影响如下图所示。下列说法错误的是( )
A.升高温度,反应(ⅰ)和(ⅱ)的平衡常数均减小
B.840℃后升高温度,反应(ⅰ)的正反应速率减小,反应(ⅱ)的正反应速率增大
C.900℃后,NO产率下降的主要原因是反应(ⅰ)平衡逆向移动
D.400℃-700℃,N2产率降低的主要原因是反应(ⅱ)平衡逆向移动
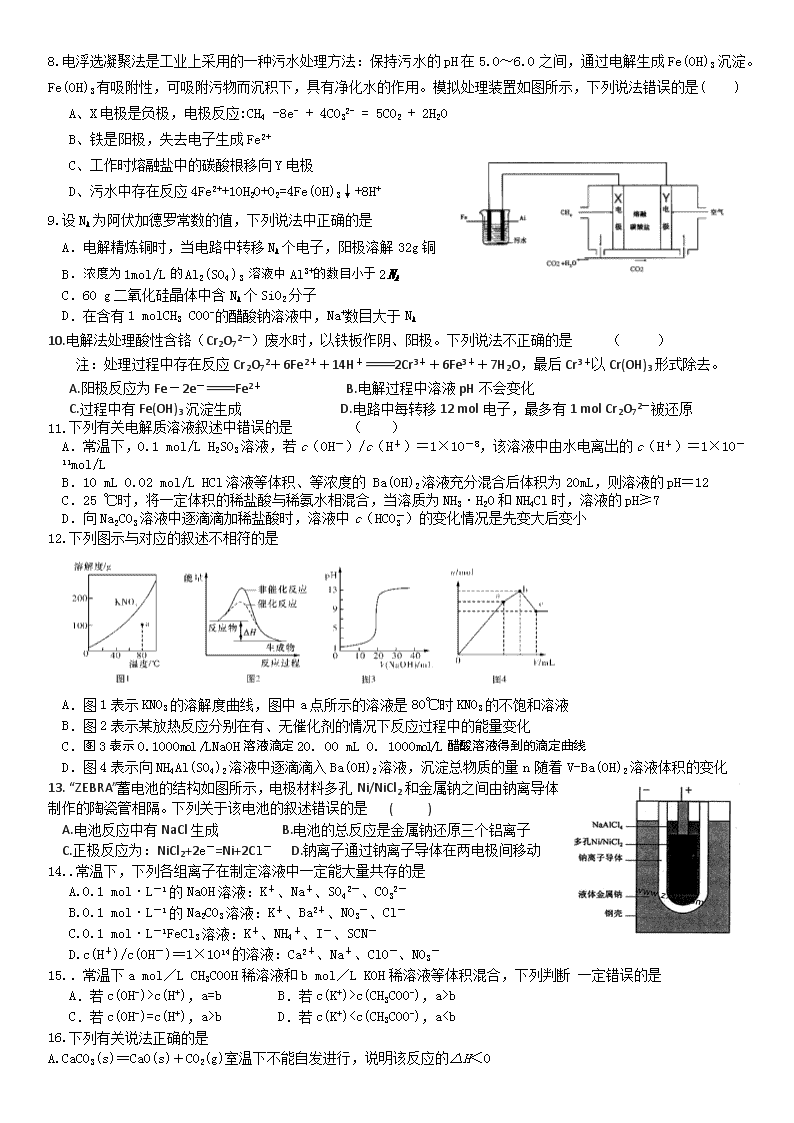
8.电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下,具有净化水的作用。模拟处理装置如图所示,下列说法错误的是( )
A、X电极是负极,电极反应:CH4 -8e- + 4CO32- = 5CO2 + 2H2O
B、铁是阳极,失去电子生成Fe2+
C、工作时熔融盐中的碳酸根移向Y电极
D、污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
9.设NA为阿伏加德罗常数的值,下列说法中正确的是
A.电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜
B.浓度为1mol/L的Al2(SO4)3溶液中Al3+的数目小于2NA
C.60 g二氧化硅晶体中含NA个SiO2分子
D.在含有1 molCH3 COO-的醋酸钠溶液中,Na+数目大于NA
10.电解法处理酸性含铬(Cr2O72-)废水时,以铁板作阴、阳极。下列说法不正确的是 ( )
注:处理过程中存在反应Cr2O72+6Fe2++14H+2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去。
A.阳极反应为Fe-2e-Fe2+ B.电解过程中溶液pH不会变化
C.过程中有Fe(OH)3沉淀生成 D.电路中每转移12 mol电子,最多有1 mol Cr2O72-被还原
11.下列有关电解质溶液叙述中错误的是 ( )
A.常温下,0.1 mol/L H2SO3溶液,若c(OH-)/c(H+)=1×10-8,该溶液中由水电离出的c(H+)=1×10-11mol/L
B.10 mL 0.02 mol/L HCl溶液等体积、等浓度的 Ba(OH)2溶液充分混合后体积为20mL,则溶液的pH=12
C.25 ℃时,将一定体积的稀盐酸与稀氨水相混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH≥7
D.向Na2CO3溶液中逐滴滴加稀盐酸时,溶液中c(HCO3- )的变化情况是先变大后变小
12.下列图示与对应的叙述不相符的是
A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图3表示0.1000mol /LNaOH溶液滴定20. 00 mL 0. 1000mol/L醋酸溶液得到的滴定曲线
D.图4表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,沉淀总物质的量n随着V-Ba(OH)2溶液体积的变化
13. “ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离导体 制作的陶瓷管相隔。下列关于该电池的叙述错误的是 ( )
A.电池反应中有NaCl生成 B.电池的总反应是金属钠还原三个铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl- D.钠离子通过钠离子导体在两电极间移动
14..常温下,下列各组离子在制定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
15..常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断 一定错误的是
A.若c(OH-)>c(H+),a=b B.若c(K+)>c(CH3COO-),a>b
C.若c(OH-)=c(H+),a>b D.若c(K+)
或=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
21.废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:
(1)①铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2S2O32-=2I-+S4O62-
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中H2O2没有除尽,所测定的Cu2+的含量将会 (填“偏高”“偏低”“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了
几种离子生成氢氧化物沉淀pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
开始沉淀的pH
完全沉淀的pH
Fe3+
1.1
3.2
Fe2+
5.8
8.8
Zn2+
5.9
8.9
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。
由除去铜的滤液制备ZnO的实验步骤依次为:① ;
② ;
③过滤;
④ ;
⑤过滤、洗涤、干燥
⑥900℃煅烧。
22. 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。有合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:(i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
(ii)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 k·mol-1
水煤气变换反应: (iii)CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:(iv)2CH3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
(1) Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3主要流程是_______________________(以化学方程式表示)。
(2)分析二甲醚合成反应((iv)对于CO转化率的影响__________________________________。
(3) 由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式________________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响_____________________________。
(4)有研究者在催化剂厂含(Cu—Zn—Al—O和A12O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如右图所示。其中CO转化率随温度升高而降低的原因是________________________。
二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为__________________________________,一个二甲醚分子经过电化学氧化,可以产生__________个电子的电量:该电池的理论输出电压为1.20 V,能量密度E=____________________________(列式计算。能量密度=电池输出电能/燃料质量,1 kW·h=3.6×106 J)。
23.酸、碱、盐在水溶液中的反应是中学化学研究的主题。
(1)0.4 mol/L的NaOH溶液与0.2mol/L HnA溶液等体积混合后pH = 10,则HnA是______(①一元强酸 ②一元弱酸 ③二元强酸 ④二元弱酸),理由是______________________________。
(2)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图像正确的是_______(填图像符号)
(3)已知PbI2的Ksp = 7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为__________。
(4)在25℃下,将a mol/L的氨水与0.1mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+) = c(Cl-),则溶液显中性,用含a的代数式表示NH3·H2O的电离常数Kb = _________。
(5)等体积的pH均为4的盐酸与NH4Cl溶液中,发生电离的水的物质的量前者与后者的比值为________。
(6)已知KBiO3 + MnSO4 + H2SO4 →Bi2(SO4)3 + KMnO4 + H2O + K2SO4(未配平),利用上述化学反应设计成如图所示原电池,其盐桥中装有饱和K2SO4溶液。
①电池工作时,盐桥中的K+移向_______(填“甲”或“乙”烧杯)
②甲烧杯中发生反应的电极方程式为_____________________________。
24.随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度。目前,消除氮氧化物污染有多种方法。
(1)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)N2(g)+CO2 (g) △H。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min
NO
N2
CO2
0
0.100
0
0
10
0.058
0.021
0.021
20
0.040
0.030
0.030
30
0.040
0.030
0.030
40
0.032
0.034
0.017
50
0.032
0.034
0.017
①T1℃时,该反应的平衡常数K= (保留两位小数)。
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0。
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为 。
25.化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
⑴催化反硝化法中,H2能将NO3- 还原为N2。25℃时,反应进行10min,溶液的pH由7变为12。
H
Pt
电
极
Ag-Pt
电
极
直流电源
质子交换膜
题29图
A
B
·
·
①N2的结构式为
②上述反应的离子方程式为,其平均反应速率υ(NO3- )为 mol·L- 1/min
③还原过程中可生成中间产物NO2- ,写出3种促进NO2- 水解的方法 、 、
⑵电化学降解NO3- 的原理如图所示。
①电源正极为 (填A或B),阴极反应式为
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为 克
26.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件为给出)。(1)LiCoO2中,Co元素的化合价为_________。
(2)写出“正极碱浸”中发生反应的离子方程式__________________________。
(3)“酸浸”一般在80 ℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式______________________________________________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________________。
(4)写出“沉钴”过程中发生反应的化学方程式_____________________________。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式____________________________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有_____________________(填化学式)。
27.铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=3Al(l)+AlCl3(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式 。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2=17MgH2+12Al。得到的混合物Y(17MgH2+12
Al)在一定条件下释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6.0mol·L-1HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 。
③在0.5 mol·L-1 NaOH和1.0 mol·L-1 MgCl2溶液中,
混合物Y均只能部分放出氢气,反应后残留固体物质X-射线衍射谱图如右图所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式)。
(3)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
(4) 铝电池性能优越,Al-AgO电池可用作水下动力电源,其原理如右下图所示。该电池反应的化学方程式为:
参考答案:
题号
1
2
3
4
5
6
7
8
9
答案
F
C
B
C
C
D
B
C
D
题号
10
11
12
13
14
15
16
17
18
答案
B
C
C
B
A
D
B
A
C
19.(1)①O2+4e-+4H+=2H2O ②减小
(2)①2Cl-+2H2OCl2↑+H2↑+2OH- ②Ag - e- = Ag+
(3)①0.77g ②AB ③c(CH3COO-)>c(K+)>c(H+)>c(OH-)
20.(1)3FeO(s)+2Al(s)﹦Al2O3(s)+3Fe(s) △H=-859.7KJ/mol(3分)
(2) ①吸 增大 ② D
(3) K= c4(H2O)/c4(H2) 减小 (4) ①107 ②> c>a>b>d
21.(1)①Cu+H2O2+H2SO4CuSO4+2H2O ②加热(至沸)
(2)①淀粉溶液 蓝色褪去 ②偏高
(3)①向滤液中加入适量30% H2O2,使其充分反应
②滴加1.0 mol·L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
④向滤液中滴加1.0 mol·L-1 NaOH,调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全
22.(1)Al2O3(铝土矿)+2NaOH+3H2O=2NaAl(OH)4,
NaAl(OH)4+CO2=Al(OH)3↓+NaHCO3,2Al(OH)3Al2O3+3H2O
(2)消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO.
(3)2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ•mol-1.
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大.
(4)反应放热,温度升高,平衡左移.
(5)CH3OCH3+3H2O=2CO2+12H++12e-,12
能量密度E=[(1.2V×1000g÷46g/mol×12×96500C/mol)÷1Kg]÷(3.6×106J•kw−1•h−1)=8.39KW•h•kg-1
23.(1)④,生成正盐水解显碱性 (2)B (3)5.6×10-mol/L 4)10-8/(a – 0.1),
(5)10-6 (6)乙,Mn2+ - 5e- + 4H2O = MnO4- + 8H+
24.(1)①0.56;②减小CO2的浓度;③<
(2)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955kJ/mol
(3)NO2+NO3--e-=N2O5
25. ⑴①N≡N ②2NO3-+5H2N2+2OH- +4H2O, 0.001 ③加酸,升高温度,加水
⑵①A,2NO3-+6H2O+10e-=N2↑+12OH- ②14.4
26.(1)+3. (2)2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)2LiCoO2+3H2SO4+H2O2 Li2SO4+2CoSO4+O2↑+4H2O 2H2O22H2O+O2↑;
有氯气生成,污染较大.
(4)CoSO4+2NH4HCO3=CoCO3↓+(NH4)2SO4+CO2↑+H2O.
(5)Li1-xCoO2+LixC6=LiCoO2+6C.
(6)Al(OH)3、CoCO3、Li2SO4
27.(1)①a+b ②Al4C3+12HCl=4AlCl3+3CH4↑
(2)②防止Mg、Al 被空气氧化 ②52 mol ③Al
(3)2Al2O3(熔融)4Al+3O2↑(4)2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O