- 2021-05-13 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学实验探究题目一轮专题目复习4
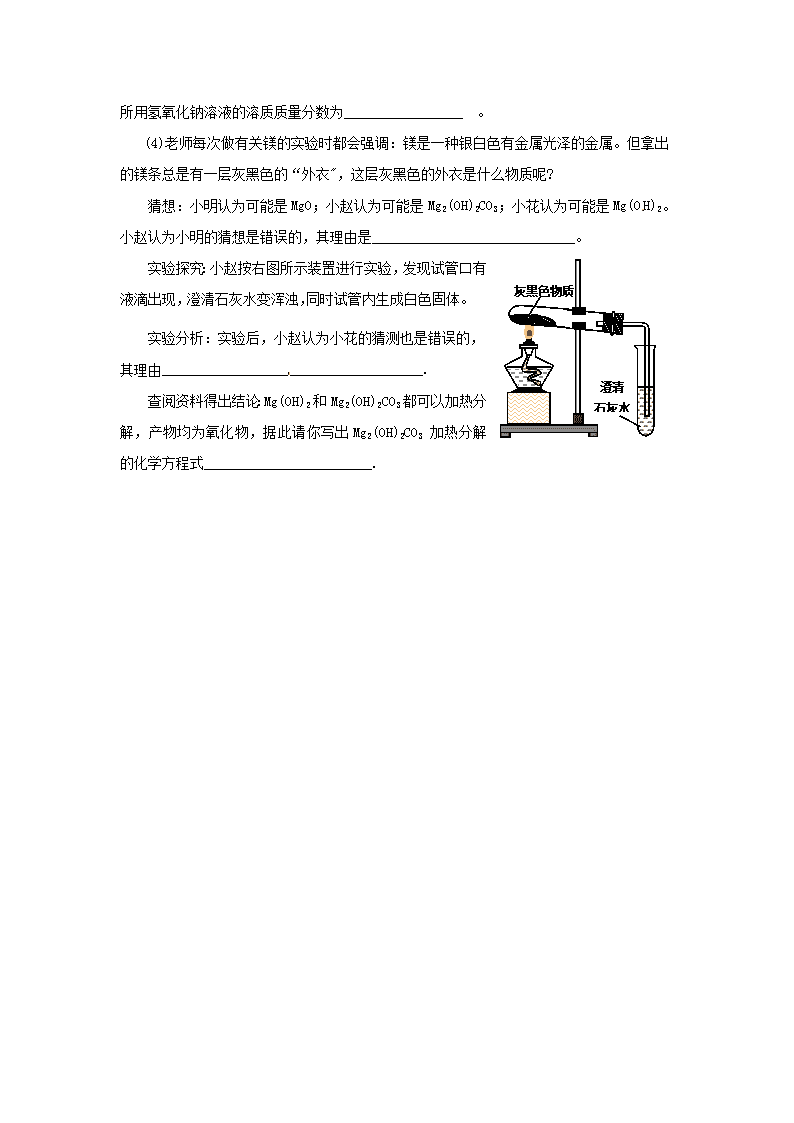
中考化学专项练习——实验探究题(四) 共3小题,共35分 1(6分)小婧同学做硫在氧气中燃烧的实验前,预先在集气瓶底装有少量水。实验 过程中她联想到老师介绍过二氧化硫排放到空气中会形成酸雨,于是想了解燃烧后集气瓶底部残留的“水”是否也呈酸性。她取“水”多次测其pH,发现其pH始终小于7并逐渐减小,直至稳定在pH=4,证明集气瓶底残留液呈酸性。随后小婧想进一步了解该残留液是否具有酸的通性,请你与她一起探究: [提出问题]残留液还能与什么物质反应呢?(至少写出3种) [猜想]___________________________________________________________________ [设计方案]请你设计实验来验证你的猜想: 实验方法 可能观察到的现象 结论 2(6分) 实验小组的同学在做氧化钙与水反应的实验时,观察到有白色烟雾状物质生成,生成的是什么物质?下面请你就这一问题进行探究: (1)你猜测生成的物质是什么?(至少写出2种)______________和______________。 (2)“为什么烟雾还会在空气中上升呢?”有同学又提出了这个问题。你能解释是 什么原因吗__________________________________________________________________ _________________________________________________________________________。 (3)你如何通过实验证明你在(1)所做猜测的合理性(请简要写出实验步骤、现象、 结)______________________________________________________________________ __________________________________________________________________________。 3(9分)小明在学习金属活动性顺序时,对课本上“活动性较强的金属一般可以将位于其后面的金属从它们的盐溶液中置换出来”这句话产生了好奇。为什么用“一般”这个词呢?难道还有例外吗? [查阅资料]Na性质活泼,常温下,与氧气反应,也可以与水反应放出氢气。 [实验与分析]①在实验室中,金属钠保存在煤油中;②用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投人蒸馏水中,发现钠块立刻熔化成银白色小球,在水面上到处游动,滴入酚酞试液后溶液变成红色;③往硫酸铜溶液中,投入一小块钠,又出现蓝色沉淀,但没有红色物质析出。 (1)金属钠保存在煤油中的原因_________________________。 (2)从实验②中,你能得出哪些信息?(任写三条)。____________________________, ______________________________,____________________________________。 (3)写出钠与硫酸铜溶液反应的化学方程式__________________ _ ; __________________ 。 [结论]活动性较强的金属不一定将位于其后面的金属从它们的盐溶液中置换出来。 4(14分)镁将成为2 1世纪重要的轻型环保材料,我国含有非常丰富的镁资源。 (1)占地球表面积70%的海洋是天然的镁元素宝库,从海水中提取镁的流程如下: 海水中的MgCl2 熟石灰 过滤 Mg(OH)2 蒸发、浓缩、结晶 MgCl2·6H2O 脱水 MgCl2 通电 Mg ①在实验室进行过滤操作时需要用到玻璃棒,其作用是__________________ ②电解熔融氯化镁的过程中,_______能转化为__________能。 (2)①金属镁是一种较活泼金属,在二氧化碳气体中也能燃烧。燃烧的化学方程式为 2 Mg+CO2=C+2MgO,此反应类型属于( ) A.分解反应 B.化合反应 C.置换反应 D.复分解反应 ②金属镁在高温下与氮气反应生成氮化镁,在氮化镁中氮元素的化合价为 一3。据此 写出氮化镁的化学式____________________________ 。 (3)镁铝合金广泛用于火箭、导弹和飞机制造业等。某兴趣小组为探究镁铝合金的组成,取16 g镁铝合金样品,把60 g氢氧化钠溶液平均分成三份依次加入样品中(铝与氢氧化钠溶液反应的化学方程式为2 Al+2NaOH+2H2O==2NaAlO2+3H2↑,镁与氢氧化钠溶液不反应),充分反应后,过滤出固体,将其洗涤、干燥、称量,得实验数据如下: 所加氢氧化钠溶液的次数 第一次 第二次 第三次 剩余固体的质量/g 10.6 5.2 4.0 从以上数据可知,该合金中,镁元素与铝元素的质量比为_____________ 所用氢氧化钠溶液的溶质质量分数为_________________ 。 (4)老师每次做有关镁的实验时都会强调:镁是一种银白色有金属光泽的金属。但拿出 的镁条总是有一层灰黑色的“外衣",这层灰黑色的外衣是什么物质呢? 猜想:小明认为可能是MgO;小赵认为可能是Mg2(OH)2CO3;小花认为可能是Mg(OH)2。小赵认为小明的猜想是错误的,其理由是_____________________________。 澄清 石灰水 灰黑色物质 实验探究:小赵按右图所示装置进行实验,发现试管口有液滴出现,澄清石灰水变浑浊,同时试管内生成白色固体。 实验分析:实验后,小赵认为小花的猜测也是错误的, 其理由_____________________________________. 查阅资料得出结论:Mg(OH)2和Mg2(OH)2CO3都可以加热分解,产物均为氧化物,据此请你写出Mg2(OH)2CO3加热分解的化学方程式________________________. 参考答案 1. 能与活泼金属反应(或答能与某些盐反应、酸碱指示剂、碱性氧化物、碱等具体物质亦 可,其他答案合理均可) 2.(1)可能是水蒸气也可能是随热气飘出的氢氧化钙固体小颗粒或两者都有 (2)由于氧化钙与水反应热使其上方的空气被加热,体积膨胀,密度变小,气团上升 (3)反应时,在其上方罩一干净的小烧杯,若有水珠,则说明是小水滴;若杯壁有粉末出现,将粉末加水溶解后加入酚酞,变红则证明是氢氧化钙固体小颗粒,若两种现象都有 则证明既有水蒸气也有氢氧化钙固体小颗粒 3.(1)可以防止钠与氧气和水反应 (2)质软,能与水反应得到的溶液显碱性,熔点低, (3)2Na+2H2O = 2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 4.(1)①引流 ②电能 化学能(2)①C ②Mg3N2 (3)3:1 40% (4)MgO也是白色固体 Mg(OH)2中不含C元素,所以加热后不会出现CO2 Mg2(OH)2CO3加热2MgO+CO2↑+H2O 查看更多