- 2021-05-13 发布 |
- 37.5 KB |
- 5页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
上海新教材中考化学总复习汇总二
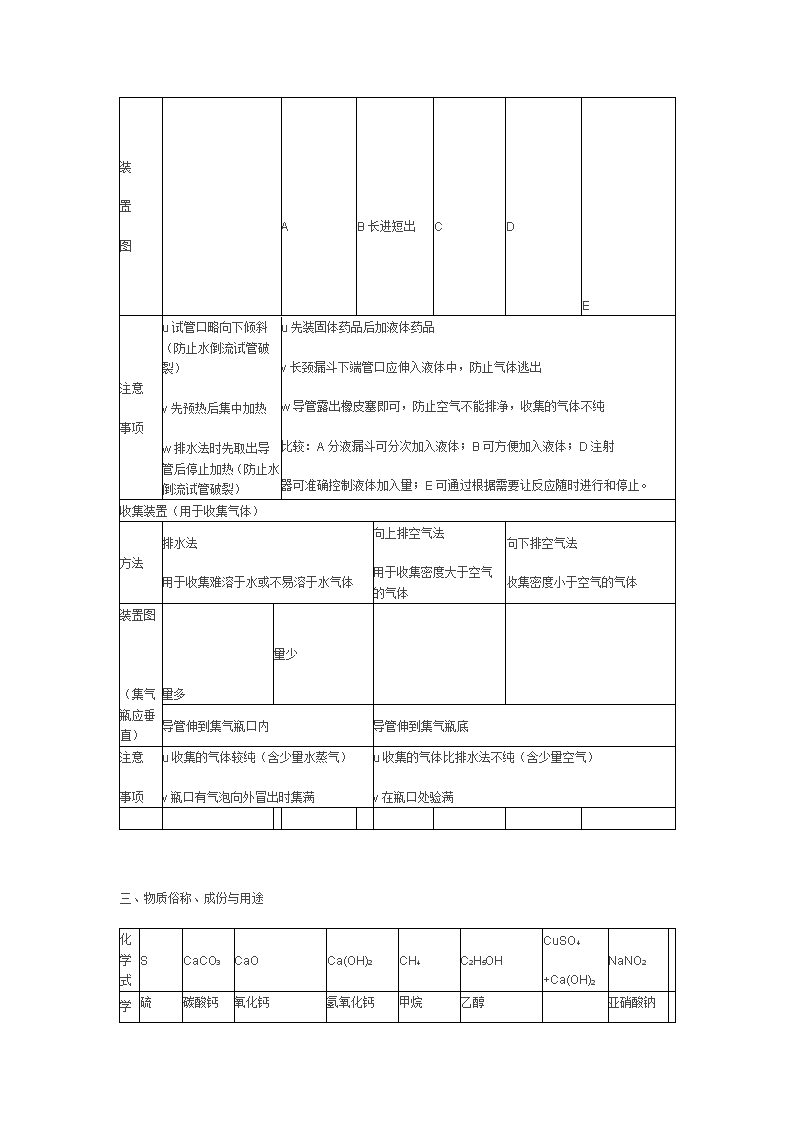
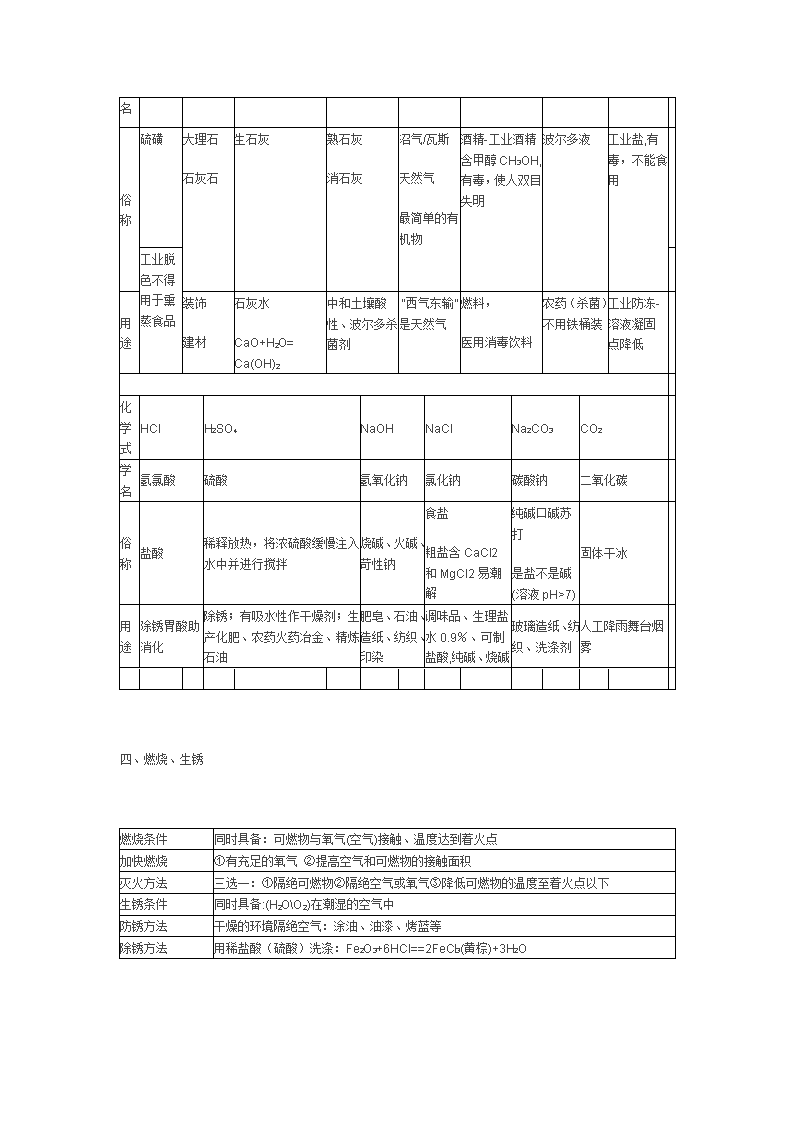
上海新教材中考化学总复习汇总二 **初中各学科资源 ** 2009-12-26 11:42:36 阅读43 评论0 字号:大中小 二、几种气体的实验室制法以及它们的区别: 气体 氧气(O2) 氢气(H2) 二氧化碳(CO2) 药品 ①高锰酸钾(KMnO4) ②双氧水(H2O2)和二氧化锰(MnO2)催化 [固+固-加热]或[固+液] ①锌粒(Zn)和稀盐酸(HCl) ②锌粒(Zn)和稀硫酸(H2SO4)[固+液] 石灰石(大理石)(CaCO3)和 稀盐酸(HCl) [固+液] 反应原理 ①2KMnO4 K2MnO4+MnO2+O2↑ ②2H2O2 2H2O+O2↑ Zn+H2SO4=ZnSO4+H2↑ Zn+2HCl=ZnCl2+H2↑ CaCO3+2HCl= CaCl2+H2O+CO2↑ 检验 用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气 点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气 通入澄清的石灰水,看是否变浑浊, 若浑浊则是CO2。 验满 用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满 用燃着的木条,平放在集气瓶口, 若火焰熄灭,则已满;否则没满 放置 正放 倒放 正放 11、选择气体发生装置考虑:①反应物的状态 ②反应的条件 2、收集装置的选用应考虑:①密度和空气比较 ②该气体对水的可溶性 3、排空气法收集气体时,导气管应伸到集气瓶的底部 4、制氧气的注意事项:①高锰酸钾制氧气时,试管口应略向下倾斜并放一小团棉花, ②导气管应只伸入试管少许 5 5、制二氧化碳的注意事项: ①应用大理石或石灰石,不能用碳酸钠 ②应用稀盐酸,不能用 浓盐酸和硫酸 (因为硫酸与大理石反应会生成硫酸钙附着在大理石表面阻碍反应进行。若一定 要用稀硫酸,则可用碳酸钙粉末取代大理石。用稀盐酸不用浓盐酸是因为浓盐酸具有挥发性, 制得的二氧化碳不纯,夹带氯化氢气体。) ③不能用排水集气法收集(CO2溶于水) 装 置 图 A B长进短出 C D E 注意 事项 u试管口略向下倾斜(防止水倒流试管破裂) v先预热后集中加热 w排水法时先取出导管后停止加热(防止水倒流试管破裂) u先装固体药品后加液体药品 v长颈漏斗下端管口应伸入液体中,防止气体逃出 w导管露出橡皮塞即可,防止空气不能排净,收集的气体不纯 比较:A分液漏斗可分次加入液体;B可方便加入液体;D注射 器可准确控制液体加入量;E可通过根据需要让反应随时进行和停止。 收集装置(用于收集气体) 方法 排水法 用于收集难溶于水或不易溶于水气体 向上排空气法 用于收集密度大于空气的气体 向下排空气法 收集密度小于空气的气体 装置图 (集气瓶应垂直) 量多 量少 导管伸到集气瓶口内 导管伸到集气瓶底 注意 事项 u收集的气体较纯(含少量水蒸气) v瓶口有气泡向外冒出时集满 u收集的气体比排水法不纯(含少量空气) v在瓶口处验满 三、物质俗称、成份与用途 化学式 S CaCO3 CaO Ca(OH)2 CH4 C2H5OH CuSO4 +Ca(OH)2 NaNO2 硫 碳酸钙 氧化钙 氢氧化钙 甲烷 乙醇 亚硝酸钠 学名 俗称 硫磺 大理石 石灰石 生石灰 熟石灰 消石灰 沼气/瓦斯 天然气 最简单的有机物 酒精-工业酒精含甲醇CH3OH,有毒,使人双目失明 波尔多液 工业盐,有毒,不能食用 工业脱色不得用于熏蒸食品 用途 装饰 建材 石灰水 CaO+H2O= Ca(OH)2 中和土壤酸性、波尔多杀菌剂 “西气东输”是天然气 燃料, 医用消毒饮料 农药(杀菌)不用铁桶装 工业防冻-溶液凝固点降低 化学式 HCl H2SO4 NaOH NaCl Na2CO3 CO2 学名 氢氯酸 硫酸 氢氧化钠 氯化钠 碳酸钠 二氧化碳 俗称 盐酸 稀释放热,将浓硫酸缓慢注入水中并进行搅拌 烧碱、火碱、苛性钠 食盐 粗盐含CaCl2和MgCl2易潮解 纯碱口碱苏打 是盐不是碱(溶液pH>7) 固体干冰 用途 除锈胃酸助消化 除锈;有吸水性作干燥剂;生产化肥、农药火药冶金、精炼石油 肥皂、石油、造纸、纺织、印染 调味品、生理盐水0.9%、可制盐酸,纯碱、烧碱 玻璃造纸、纺织、洗涤剂 人工降雨舞台烟雾 四、燃烧、生锈 燃烧条件 同时具备:可燃物与氧气(空气)接触、温度达到着火点 加快燃烧 ①有充足的氧气 ②提高空气和可燃物的接触面积 灭火方法 三选一:①隔绝可燃物②隔绝空气或氧气③降低可燃物的温度至着火点以下 生锈条件 同时具备:(H2OO2)在潮湿的空气中 防锈方法 干燥的环境隔绝空气:涂油、油漆、烤蓝等 除锈方法 用稀盐酸(硫酸)洗涤:Fe2O3+6HCl==2FeCl3(黄棕)+3H2O 五、酸碱度的表示方法——pH值 酸性(酸类—H+) 中性(部份盐类、水) 碱性(碱类—OH-) 石蕊溶液 红色 紫色 蓝色 酚酞溶液 无色 无色 红色 pH值 说明 (1)pH值=7,溶液呈中性;pH值<7,溶液呈酸性;pH值>7,溶液呈碱性。 (2)pH值越接近0,酸性越强;pH值越接近14,碱性越强;pH值越接近7, 溶液的酸、碱性就越弱,越接近中性。 (3)纯碱Na2CO3溶液呈碱性 六、物质颜色、气味、毒性 黄 色 硫 磺S 红 色 铜Cu, 铁锈Fe2O3, 氧化汞HgO 蓝 色 硫酸铜溶液(CuSO4), Cu(OH)2沉淀〖都是唯一的蓝色物质〗; 含Cu2+离子的溶液是(蓝或绿),如CuCl2是绿色 绿 色 铜绿Cu2(OH)2CO3 CuCl2 浅绿色 亚铁(+2价)化合物,含Fe2+离子溶液,如FeCl2;FeSO4 置换反应中一般只生成亚铁(+2价)化合物 黑紫色 高锰酸钾KMnO4 黑 色 氧化铜CuO,木炭C,四氧化三铁Fe3O4,二氧化锰MnO2 黄棕色 含铁离子Fe3+溶液(如FeCl3、Fe2(SO4)3、Fe(NO3)3溶液) 〖Fe(OH)3-是唯一的黄棕(红褐)色沉淀〗 白 色 其他不含Mn,Fe,Cu的化合物固体为白色,溶液无色。金属单质为银白色 (1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色) (2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒) ▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸 酒精为有特殊气体的液体。 (3)有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液) 七、几种暴露空气中质量改变的物质 干燥剂 名称 可干燥物质 现象 浓硫酸 除会反应的碱性物质外,如NH3 吸水性,增重 NaOH固体 除会反应的酸性物质外,如CO2等 潮解有吸水性,增重 生石灰CaO CaCl2固体 可干燥较多物质 潮解有吸水性,增重 无水硫酸铜 吸水后白色变蓝色 性质、变化 质量改变 质% *检验NaOH固体、溶液是否变质(与 检验CO32—同);取样,滴加稀HCl。产生 大量气泡(将气体通入澄清石灰水,产生 白色浑浊) Na2CO3+2HCl=2NaCl+HO2+CO2↑ 浓盐酸、硝酸 溶质有挥发性 减少、物变、 变小 浓硫酸 吸水性 增大、物变 变小 NaOH固体 吸水潮解 增大、物变 吸CO2变质 增大、化变 2NaOH+CO2=Na2CO3+H2O 生石灰CaO 吸 水 增大、化变 CaO+H2O=Ca(OH)2 石灰水Ca(OH)2 吸CO2变质 增大、化变 CO2+Ca(OH)2===CaC03↓+H2O 查看更多