- 2021-05-13 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届中考化学复习汇编 7 金属材料和金属资源的保护 新人教版
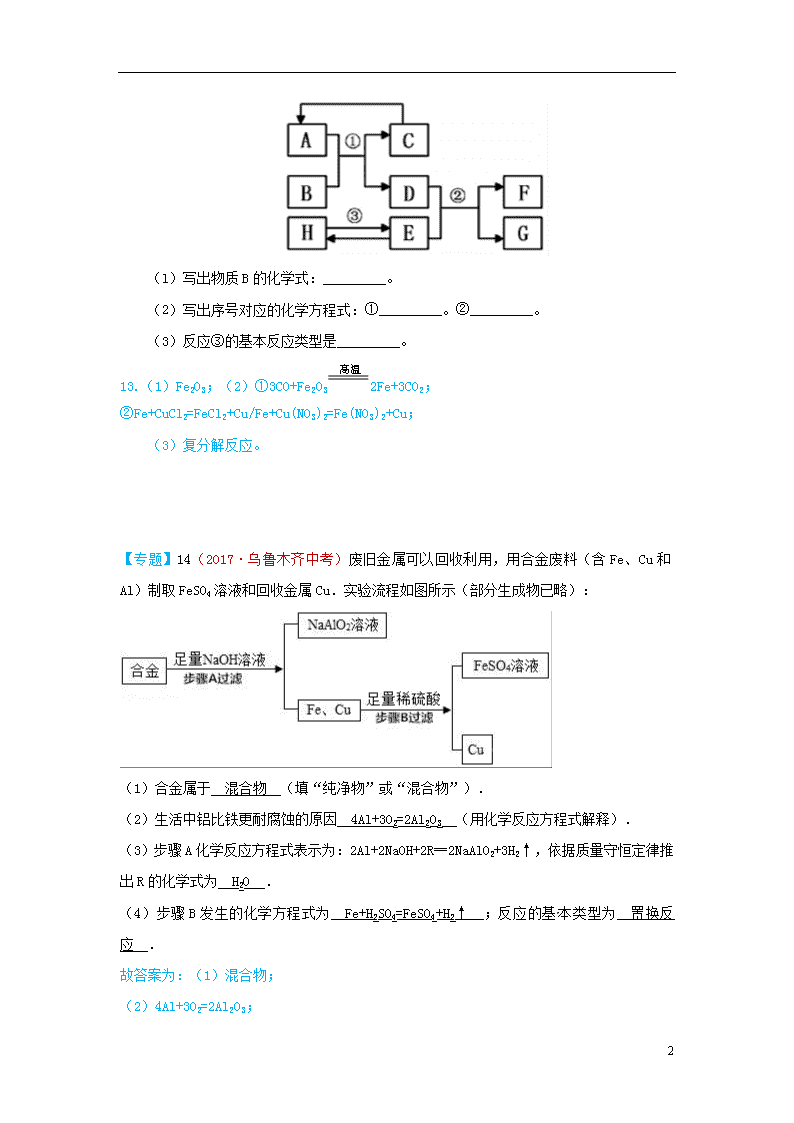
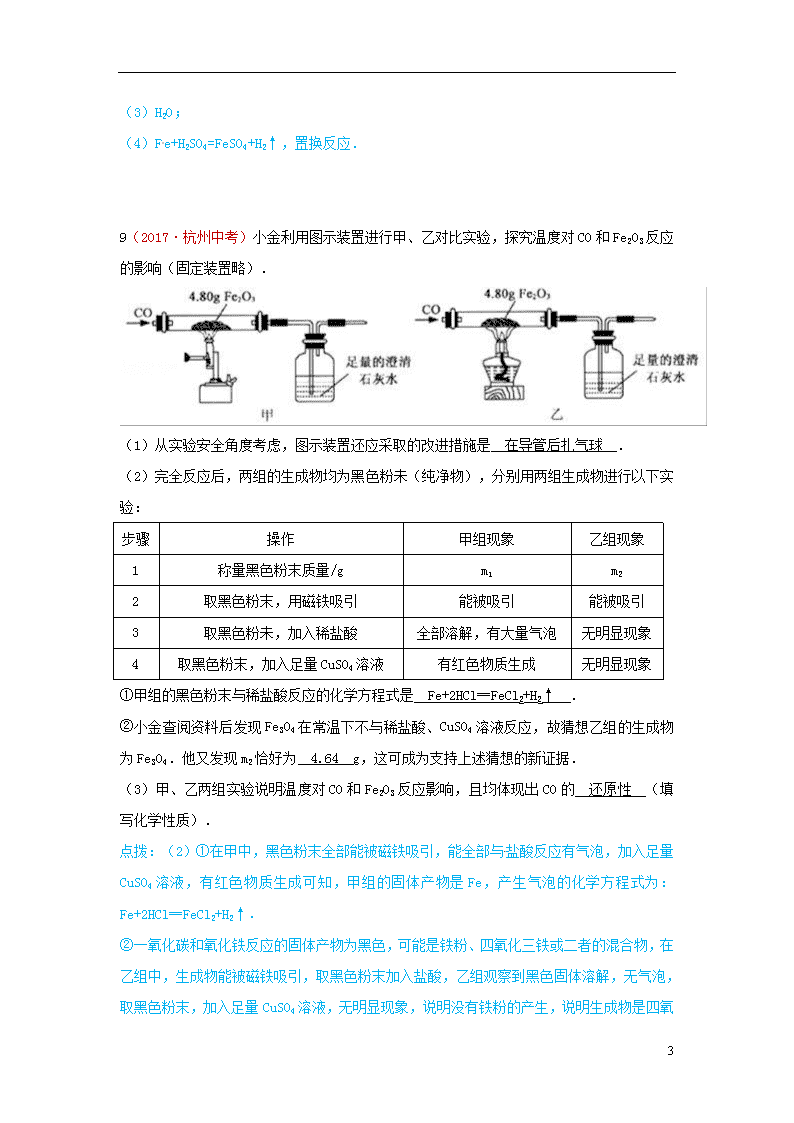
金属材料和金属资源的保护 7(2017·庆阳中考)自2011年我省实施找矿战略行动以来,在铜、铅、锌、金、铁、铌、钽等金属方面取得找矿新成果。下列关于铁、锌、铜三种金属及其合金的说法不正确的是 A.铁在潮湿的空气中易生锈 B.可以用铁桶盛放硫酸铜溶液 C.可以用稀硫酸鉴别锌与铜的金属活动性强弱 D.黄铜(铜与锌的合金)的硬度大于纯铜 B 点拨:A.铁在潮湿的空气中易生锈,故正确。B.铁会与硫酸铜反应生成硫酸亚铁和铜,所以不能用铁桶盛放硫酸铜溶液,故错误。C.稀硫酸和锌能发生反应,和铜不能发生反应,所以可以鉴别锌与铜的金属活动性强弱,故正确。D.黄铜属于铜的合金,合金要比组成成分金属的硬度大,故错误。 13(2017·宿迁中考)人类社会的发展离不开金属. (1)钢铁的锈蚀主要是铁与空气中的 氧气和水蒸气(或O2和H2O) 等物质发生化学反应的结果; (2)在空气中,铝的表明易生成致密的氧化膜,氧化膜的主要成分是 Al2O3 (写化学式); (3)某同学取少量工厂废液[溶质是AgNO3、Cu(NO3)2],向其中加入一定量的金属锌,反应结束后,发现溶液仍然是蓝色.据此推断,反应后溶液中一定含有的溶质是 硝酸铜和硝酸锌[或Cu(NO3)2和Zn(NO3)2] . 13(2017·六盘水中考)(4分)已知A~H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且c能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据如图所示的转化关系(图中反应条件均已略去),请回答: 13 (l)写出物质B的化学式:_________。 (2)写出序号对应的化学方程式:①_________。②_________。 (3)反应③的基本反应类型是_________。 13.(1)Fe2O3;(2)①3CO+Fe2O32Fe+3CO2;②Fe+CuCl2=FeCl2+Cu/Fe+Cu(NO3)2=Fe(NO3)2+Cu; (3)复分解反应。 【专题】14(2017·乌鲁木齐中考)废旧金属可以回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属Cu.实验流程如图所示(部分生成物已略): (1)合金属于 混合物 (填“纯净物”或“混合物”). (2)生活中铝比铁更耐腐蚀的原因 4Al+3O2=2Al2O3 (用化学反应方程式解释). (3)步骤A化学反应方程式表示为:2Al+2NaOH+2R═2NaAlO2+3H2↑,依据质量守恒定律推出R的化学式为 H2O . (4)步骤B发生的化学方程式为 Fe+H2SO4=FeSO4+H2↑ ;反应的基本类型为 置换反应 . 故答案为:(1)混合物; (2)4Al+3O2=2Al2O3; 13 (3)H2O; (4)Fe+H2SO4=FeSO4+H2↑,置换反应. 9(2017·杭州中考)小金利用图示装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置略). (1)从实验安全角度考虑,图示装置还应采取的改进措施是 在导管后扎气球 . (2)完全反应后,两组的生成物均为黑色粉未(纯净物),分别用两组生成物进行以下实验: 步骤 操作 甲组现象 乙组现象 1 称量黑色粉末质量/g m1 m2 2 取黑色粉末,用磁铁吸引 能被吸引 能被吸引 3 取黑色粉未,加入稀盐酸 全部溶解,有大量气泡 无明显现象 4 取黑色粉末,加入足量CuSO4溶液 有红色物质生成 无明显现象 ①甲组的黑色粉末与稀盐酸反应的化学方程式是 Fe+2HCl═FeCl2+H2↑ . ②小金查阅资料后发现Fe3O4在常温下不与稀盐酸、CuSO4溶液反应,故猜想乙组的生成物为Fe3O4.他又发现m2恰好为 4.64 g,这可成为支持上述猜想的新证据. (3)甲、乙两组实验说明温度对CO和Fe2O3反应影响,且均体现出CO的 还原性 (填写化学性质). 点拨:(2)①在甲中,黑色粉末全部能被磁铁吸引,能全部与盐酸反应有气泡,加入足量CuSO4溶液,有红色物质生成可知,甲组的固体产物是Fe,产生气泡的化学方程式为:Fe+2HCl═FeCl2+H2↑. ②一氧化碳和氧化铁反应的固体产物为黑色,可能是铁粉、四氧化三铁或二者的混合物,在乙组中,生成物能被磁铁吸引,取黑色粉末加入盐酸,乙组观察到黑色固体溶解,无气泡,取黑色粉末,加入足量CuSO4 13 溶液,无明显现象,说明没有铁粉的产生,说明生成物是四氧化三铁,m2=4.8g××100%=4.64g; (3)甲、乙两组实验说明温度对CO和Fe2O3反应影响,且均体现出CO的还原性. 故答案为; (1)在导管后扎气球; (2)①Fe+2HCl═FeCl2+H2↑;②4.64; (3)还原性 7(2017·东营中考)今年春季,在张献忠沉银考古现场,整齐堆放着金册、银册、金币、银币、铜币和银锭,还有铁刀、铁矛等兵器.下列说法中错误的是( ) A.“真金不怕火炼”说明了黄金的化学性质稳定 B.上述钱币用金、银、铜而不用铁,从化学角度看主要原因是铁的冶炼困难 C.自然界有天然的铜、银、金却没有天然的金属铁 D.常温下验证铁、铜、银三种金属的活动性顺序时,至少需一种金属单质 13(2017·菏泽中考)2017年5月5日,我国国产大型客机C919在上海浦东机场首飞成功,标准着我国航空事业有了最大突破.结合所学知识回答下列问题: (1)大型客机大量使用了铝锂合金、钛合金等,其原因是合金比纯金属具有 合金具有更高的强度、硬度和更好的抗腐蚀性 . (2)空气中,铝比铁具有更好的抗腐蚀性.原因是 铝与空气中的氧气反应生成致密的氧化膜对里面的金属起着保护作用 (用文字叙述). (3)已知金属M和N能够发生如下反应:Fe+MCl2=M+FeCl2,N+FeCl2=Fe+NCl2,判断Fe、M、N三种金属的活动性有强到弱的顺序是 N>Fe>M . 17(2017·沈阳中考)人类制得并利用金属有着悠久的历史: 13 (1)利用孔雀石冶炼铜的主要反应: ①Cu2(OH)2CO32CuO+H2O+CO2↑,该反应的类型是_________(选填“化合”“分解”或“置换”)反应; ② 2CuO+C2Cu+CO2↑,该反应前后铜元素化合价发生的变化是__________。 (2)高炉炼铁的主要反应过程如下。请写出对应的化学方程式: ①____________________________________; ②____________________________________; ③____________________________________。 (3)冶炼金属铝的主要反应:2Al2O34Al+3O2↑,该反应的条件是__________。下图的装置中,两种金属的活动性:Zn______(选填“>”或“<”)Cu。当电流表指针发生偏转时,化学能转化为___________。 (1)① 分解 ② +2→0(其他合理答案均可) 13 (2)①C+O2CO2 ②CO2+C2CO ③Fe2O3+3CO2Fe+3CO2 (3)通电(其他合理答案均可) > 电能(其他合理答案均可) 35(2017·哈尔滨中考)(5分)某钢铁厂实验室为测定赤铁矿中Fe2O3的含量,将矿石粉碎(其中杂质既不溶于水也不与酸反应),进行如下实验: 请回答下列问题: (1)上述实验过程中发生反应的化学方程式为__________________________________; (2)样品中Fe2O3的质量分数是_______; (3)根据已知条件列出求解200g稀硫酸中溶质质量(x)的比例式___________________; (4)若向最终滤液中加入16g水,所得不饱和溶液中溶质的质量分数为_________; (5)该钢铁厂每天用上述赤铁矿石1900t来生产生铁。则理论上日产含杂质5%的生铁的质量为_________。 18(2017·海南中考)人类对材料的发现和使用经历了从石器、青铜器、铁器到铝的大规模使用等漫长的征程。 请回答: (1)我国最早使用的合金是______; (2)我国是最早采用湿法冶铜的国家。文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜。铁与硫酸铜溶液反应的化学方程式为______; (3)下列金属矿物中,可以用来炼铁的是______(填正确选项前的字母); A. 赤铜矿(Cu2O) B.赤铁矿(Fe2O3) C.软锰矿(MnO2) (4)19世纪初,铝的发现得益于电解技术的应用。下图为用铝土矿炼制铝的生产流程。 13 现有含Al2O351%的铝土矿200t,经上述反应后可制得铝_____t(假设上述各步反应中,铝元素一共损失10%。计算结果精确到小数点后一位)。 18.(1)青铜 (2)Fe + CuSO4 = Cu + FeSO4 (3) B (4) 48.6 【新】14(2017·海南中考)英国化学家亨利·卡文迪许是燃素说的信仰者。1766年,他用铁、锌、锡等六种金属与稀硫酸、稀盐酸作用制得“可燃空气”,并将其表示为: 用所学化学知识判断,下列说法正确的是 A.“可燃空气”是从金属中分解出来的 B.上述六种金属包括铜 C.“可燃空气”可以用排水集气法收集 D.上述反应属于复分解反应 【理化综合题】15(2017·河北中考)阅读短文并回答问题.白炽灯泡 白炽灯泡的灯丝是由金属钨制作的,其灯丝发光时温度可达2000℃左右,为防止灯丝在高温下氧化,在制作灯泡时要抽真空,在制作大功率灯泡时,还要把灯泡内充入稀有气体氩等,主要是为了防止灯丝在高温下升华.白炽灯泡工作时,电能转化为光能的效率较低,因此逐渐被节能灯和LED灯所替代. (1)由于钨的 熔、沸点 较高,所以用钨制作灯丝; (2)灯泡内充入稀有气体氦等,主要是为了 做保护气,使灯泡耐用 ; (3)白炽灯泡逐渐退出市场,是由于 白炽灯泡工作时,电能转化为光能的效率较低,浪费能源 . 16(2017·玉林中考)下列环境中,铁钉表面最容易产生铁锈的是 A.在稀盐酸中 B.在潮湿的空气中 C.在干燥的空气中 D.浸没在植物油中 13 13(2017·深圳中考)我国矿物种类齐全,储量丰富.工业上从从含有金属元素的矿石中提炼金属.其中赤铁矿是炼铁的主要原料.请回答下列问题: I.铁制品广泛应用于生产、生活中. (1)下列不属于铁合金的是 A (选填字母). A.Fe(OH)3 B.生铁 C.不锈钢 (2)铁钉生锈,属于 化学 变化(选填“物理”“化学”):如图1是探究铁钉在不同条件下发生生锈的实验,其中铁锈蚀最快的是 B (选填字母). II.赤铁矿(主要成分为Fe2O3)可用于生产催化剂. (3)在Fe2O3中,氧元素的质量分数为 30% . (4)赤铁矿经提纯后得到的纯净Fe2O3可用于生产某种工业催化剂(主要成分为FeO和Fe2O3),其反应原理为:2 Fe2O3+C4FeO+CO2↑.现将焦炭和过量的Fe2O3混合均匀,按上述原理充分反应,如图2为固体混合物的质量随反应时间的变化曲线. ①由图可知:生成CO2气体的质量为 1.1 g. ②计算反应后固体混合物中FeO的质量分数(请根据化学方程式写出完整的计算步骤). 故答案为:(1)A. (2)化学; B. (3)30%. (3)在Fe2O3中,氧元素的质量分数为×100%=30%. (4)由图和质量守恒定律可得,生成CO2气体的质量为 21.1g=﹣20.0g=1.1g. 设反应后固体混合物中FeO的质量为x 2 Fe2O3+C4FeO+CO2↑ 288 44 x 1.1g 13 = x=7.2g 反应后固体混合物中FeO的质量分数为×100%=36.0% 21(2017·广州中考)金属钨(W)可做灯泡的灯丝,钨合金材料非常坚硬和耐磨、耐热.用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4,Na2WO4与热的浓盐酸反应生成H2WO4,H2WO4受热分解生成H2O和WO3. (1)钨合金材料属于 D .(填选项) A.单质B.化合物C.纯净物D.混合物 (2)4FeWO4+4Na2CO3+O24Na2WO4+2Fe2O3+4 CO2 (3)H2WO4读作 钨酸 .H2WO4中钨元素的化合价为 +6 . (4)H2WO4受热分解的化学方程式为 H2WO4H2O+WO3 . (5)H2与WO3在1000℃条件下反应可得到金属W和水,其反应类型为 置换反应 . 50(2017·眉山中考)(7分)合金中除含金属外,也可以含有非金属。已知某铝合金粉末除含铝、铜外,还含镁和硅中的一种或两种。小冬设计实验对该铝合金粉末进行探究。 【查阅资料】 (1)硅不能与盐酸反应。 . (2)铜、镁不能与氢氧化钠溶液反应 (3)铝、硅能与氢氧化钠溶液反应且得到相同的气体。硅有氢氧化钠的溶液反应的方程式为 13 Si+2NaOH+H2O=Na2SiO3+2H2↑,足量铝与氢氧化钠溶液反应后溶液的溶质为NaAlO2,则铝与氢氧化钠溶液反应的化学方程式为 。 【提出猜想】 猜想一:该粉末中除含铝、铜外,还含有镁。 猜想二:该粉末中除含铝、铜外,还含有硅。 猜想三:该粉末中除含铝、铜外,还含有 。 【设计实验】 实验步骤 实验现象 实验结论 实验一 ①取一定量的合金粉末,加过量 的 ,充分反应后过滤 粉末部分溶解,并有无色气体放出 粉末中还含有硅 ②取步骤①所得滤渣,加过量 的 ,充分反应 滤渣部分溶解,并有无色气体放出 实验二 略 【实验结论】猜想三正确 50. (7分)【查阅资料】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ [提出猜想] 猜想三:镁和硅 【设计实验】 实验步骤 实验现象 实验结论 实验一 盐酸或硫酸 NaOH 实验二 ① 取一定量的合金粉末,加过量NaOH溶液,充分反应后过滤。 ② 取滤渣,加盐酸或硫酸 粉末中还含有镁 (2017·成都中考) 13 10(2017·长沙中考)下列关于金属材料的说法不正确的是( ) A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜 B.铁在干燥的空气中容易生锈 C.硬铝(铝合金)的硬度大于纯铝 D.金属资源的回收利用既保护了环境,又节约了金属资源 23(2017·湘潭中考)金属的用途很广,我们应该保护好金属资源.回答以下问题: (1)金属能用于做炊具,是因为金属具有 导热性 (填“导电性”或“导热性”); (2)黄铜片和铜片相比较,硬度较大的是 黄铜片 ; 13 (3)写出一条防止铁生锈的建议 涂油漆 . 29(2017·邵阳中考)人们常说的“五金”是指:金、银、铜、铁、锡.根据所学知识回答: (1)“真金不怕火炼”是指金即使在高温下也不与 氧气 反应; (2)黄铜片(铜锌合金)和铜片相互刻画,在铜片上留下刻痕,说明黄铜片的硬度比铜片的硬度 大 (填“大”或“小”); (3)铁制容器不能用来盛放农药波尔多液(主要成分是硫酸铜和氢氧化钙),用化学方程式表示其原因 Fe+CuSO4═Cu+FeSO4 ; (4)防止金属腐蚀是保护金属资源的有效途径之一,写出一种防止铁制品生锈的具体方法 刷漆等 . 故答为:(1)氧气;(2)大;(3)Fe+CuSO4═Cu+FeSO;(4)刷漆等. 19(2017·娄底中考)铝是一种常见的金属,用途十分广泛.请回答下列问题: (1)如图甲是铝在元素周期表中的信息以及原子结构示意图.铝的相对原子质量是 26.98 .图乙原子结构示意图所对应的元素与铝元素化学性质相似的是 D .(填字母序号) (2)氮化铝(AIN)是一种良好的耐热冲击材料,氮化铝中铝元素的化合价为+3价,则N元素的化合价为 ﹣3 价. (3)氮化铝遇水缓慢反应产生一种白色胶状物质氢氧化铝和氨气(NH3),则该反应的化学方程式为 AlN+3H2O=Al(OH)3↓+NH3↑ . 13 8.(2017·鄂州中考)下列关于金属材料的说法中正确的是 A.铝制品表面应常用钢刷擦洗 B.可用铁桶盛装农药波尔多液 C.焊锡(锡铅合金)的熔点低,常用来焊接金属 D.钢因为比生铁的含碳量高,所以应用范围更广 8.C (2017·黄冈中考) 13查看更多