- 2021-05-11 发布 |
- 37.5 KB |
- 21页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学黄金30题系列专题06考前必做难题30题含解析
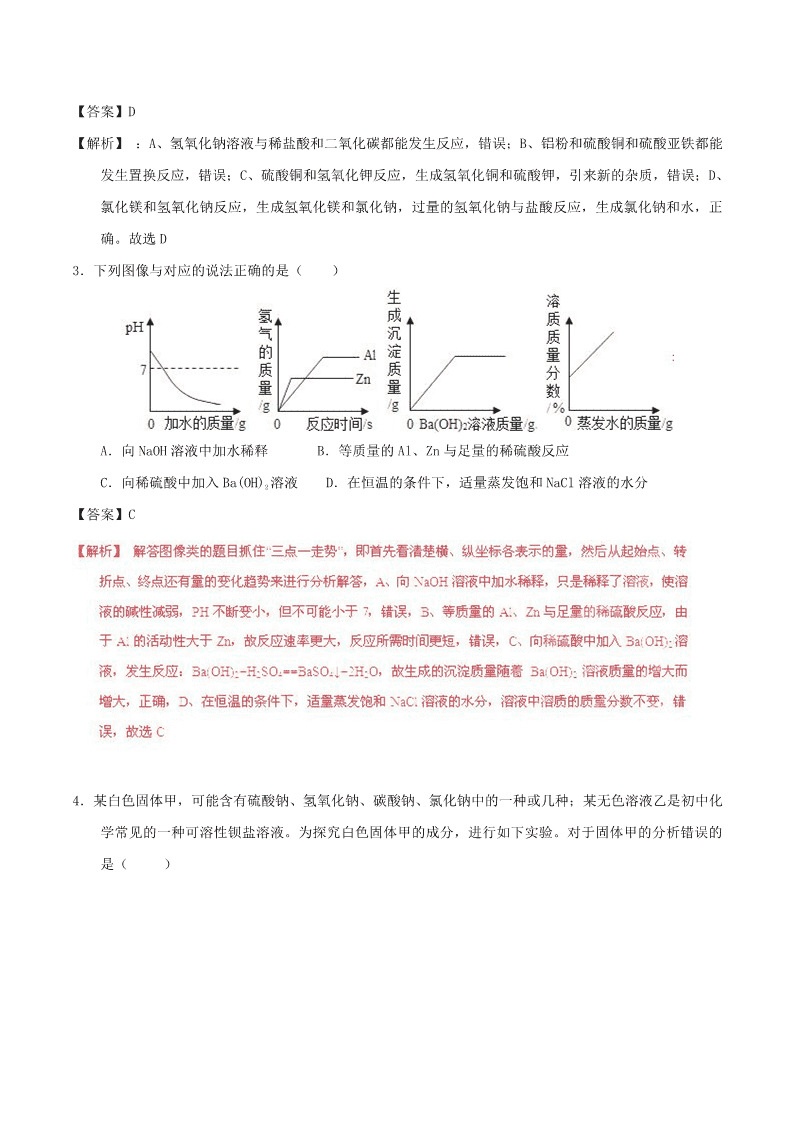
专题06 考前必做难题30题 一、选择题 1.某CaCl2样品中,可能含有KNO3、CuCl2、MgCl2、NaCl和Na2CO3中的某些物质,取该样品11.1克溶于适量水中,得到澄清的无色溶液,然后向其中加入足量.AgNO3溶液,得到28.7克白色沉淀,则该样品组成的下列推断中正确的是( ) A.只有MgCl2,没有NaCl B.肯定没有CuCl2和Na2CO3 C.肯定有MgCl2和KNO3 D.样品可能由CaCl2、NaCl、MgCl2组成 【答案】BD 【解析】 取该样品11.1克溶于适量水中,得到澄清的无色溶液,说明一定不含蓝色的氯化铜和碳酸钠溶液;因为碳酸钠和氯化钙反应生成沉淀,故选项B正确;然后向其中加入足量.AgNO3溶液,得到28.7克白色沉淀,假设11.1g为纯净的氯化钙生成的氯化银的质量为X; 都没有,含有不反应的硝酸钾;故答案选择BD 2.为除去下列物质中的杂质(括号内为杂质),选用的试剂和操作方法都正确的是( ) 序号 物 质 选用试剂 操作方法 A CO2气体(HCl) NaOH溶液 洗气 B FeSO4溶液(CuSO4) Al粉 加过量Al粉、过滤 C KNO3固体(KOH) H2O、CuSO4溶液 溶解、过滤、蒸发结晶 D NaCl固体(MgCl2) H2O、NaOH溶液、盐酸 溶解、加过量NaOH溶液、过滤、加过量盐酸、蒸发结晶 【答案】D 【解析】 :A、氢氧化钠溶液与稀盐酸和二氧化碳都能发生反应,错误;B、铝粉和硫酸铜和硫酸亚铁都能发生置换反应,错误;C、硫酸铜和氢氧化钾反应,生成氢氧化铜和硫酸钾,引来新的杂质,错误;D、氯化镁和氢氧化钠反应,生成氢氧化镁和氯化钠,过量的氢氧化钠与盐酸反应,生成氯化钠和水,正确。故选D 3.下列图像与对应的说法正确的是( ) A.向NaOH溶液中加水稀释 B.等质量的Al、Zn与足量的稀硫酸反应 C.向稀硫酸中加入Ba(OH)2溶液 D.在恒温的条件下,适量蒸发饱和NaCl溶液的水分 【答案】C 4.某白色固体甲,可能含有硫酸钠、氢氧化钠、碳酸钠、氯化钠中的一种或几种;某无色溶液乙是初中化学常见的一种可溶性钡盐溶液。为探究白色固体甲的成分,进行如下实验。对于固体甲的分析错误的是( ) A.一定有硫酸钠 B.一定有氢氧化钠 C.若乙溶液为硝酸钡溶液,一定有氯化钠 D.至少含有碳酸钠、氢氧化钠中的一种 【答案】D 5.为除去物质中的少量杂质,选用的试剂及操作均正确的一组是( ) 选项 物质 杂质 选用的试剂 选用的操作 A CO2 H2O蒸气 固体NaOH 通过盛NaOH的U型管 B CuSO4粉末 Fe粉 水 加水,搅拌、过滤、蒸发 C O2 H2O蒸气 足量浓硫酸 洗气 D NaHCO3粉末 Na2CO3粉末 适量稀盐酸 滴加后蒸发 【答案】C 【解析】 除杂质的要求是:要把杂质除去,但不能除去了需要的物质,更不能带入新的杂质。A中氢氧化钠固体会与二氧化碳反应,要除去二氧化碳中的水蒸汽可用浓硫酸,错误;B中铁会与硫酸铜溶液发生置换反应,错误;C中浓硫酸能吸收水蒸汽,蒸汽;D中碳酸钠和碳酸氢钠均能与稀盐酸反应,错误。故选C。 6.现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示。则X 是( ) A.水 B.澄清石灰水 C.纯碱溶液 D.稀盐酸 【答案】C 【解析】 加入水后溶液的酸性减弱,但不能达到7,所以A错误。加热澄清的石灰水反应时溶液的PH会升高,当反应完后继续加时,溶液的PH还是继续升高,不会出不变的情况,所以B错误,D加热稀盐酸后溶液仍显酸性,不会升高到7,所以D错误。故选C. 7.将质量相等的A、B、C三种金属,同时分别放入三份质量分数相同且足量的的稀盐酸中,反应生成的H2质量与时间关系如图,得出结论正确的是(已知A、B、C在生成物中均为+2价)( ) A.金属的活动性顺序A﹥B﹥C B.生成H2的质量C﹥B﹥A C.相对原子质量C﹥B﹥A D.反应速率最大的是A 【答案】C 8.设计实验方案是科学探究的重要环节,以下化学实验设计中,不能达到实验目的的是( ) A.厨房中用食醋鉴别纯碱和食盐 B.用AgNO3溶液鉴别H2中混入的少量HCl杂质 C.用稀硫酸除去铁粉中混有的少量铜粉 D.用稀盐酸检验暴露在空气中的NaOH固体是否变质 【答案】C 【解析】 A.食醋可以与纯碱反应产生二氧化碳气体,氯化钠不能与食醋反应,该选项正确; B.硝酸银溶液可与氯化氢杂质反应,从而除去氯化氢,该选项正确;C.稀硫酸能与铁反应,不能与铜反应,达不到除去铜的目的,该选项错误;D.氢氧化钠变质会生成碳酸钠,碳酸钠能与稀盐酸反应产生二氧化碳气体,有明显现象,该选项正确。 9.下列关于化学实验的“目的——操作——现象——结论”的描述正确的是( ) 实验目的 所加试剂 (或操作、图示) 实验现象 实验结论 A 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 在反应后的溶液中滴加无色酚酞试液 无明显现象 恰好完全 反应 B 检验某溶液中是否含有Fe3+ 加入NaOH溶液 有红褐色沉淀产生 该溶液中含有Fe3+ C 除去NaCl溶液中含有的少量KCl 加入过量AgNO3溶液,过滤 有白色沉淀生成 所得溶液为NaCl溶液 D 测定空气中氧气的体积分数(反应前在瓶中放有少量水) 完全燃烧后,立即打开弹簧夹,进入集气瓶中水的体积约为集气瓶总体积的五分之一 氧气约占空气体积的五分之一 【答案】B 10.某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法正确的是( ) A.滤出的固体中一定含有银,也可能含有铜 B.滤出的固体中一定含有银和铜,一定不含铁 C.滤液中一定含有硝酸亚铁,一定没有硝酸根 D.滤液中一定含有硝酸亚铁和硝酸铜,可能含有硝酸银 【答案】AC 【解析】 反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,说明混合物中的硝酸银完全反应,没有剩余,所以D错误,所以滤出的固体中一定有银,而滤液中一定含有硝酸亚铁溶液,所以C正确,故选AC 11.已知某固体粉末是由NaCl、Ba(NO3)2、CuSO4、Na2SO4、Na2CO3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀全部不溶解,过滤后得无色滤液,取滤液并滴加AgNO3溶液,产生白色沉淀,对原固体粉末的判断正确的是( ) A.可能含CuSO4和Na2CO3 B.一定含NaCl,可能含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 C.一定含NaCl、Ba(NO3)2、Na2SO4,一定不含Na2CO3,可能含CuSO4 D.可能含NaCl,一定含Ba(NO3)2、Na2SO4,一定不含Na2CO3、CuSO4 【答案】 D 12.有一包“铁”的粉末,可能含有Fe 、Fe2O3 Fe3O4 中的一种或几种,现称取23.2g放在试管中,通入足量的一氧化碳并加热充分反应,将生成的气体全部通入足量的澄清石灰水,共得到40g的碳酸钙固体。关于这包“铁” 的粉末成分判断正确的是( ) A.一定是纯净物 B.一定有Fe 、Fe2O3 Fe3O4三种 C.如果有Fe ,就一定有Fe2O3 D.如果有Fe2O3 ,就一定有Fe3O4 【答案】C 【解析】 假设这一包白色粉末是一种物质(铁的氧化物),设铁元素在氧化物中的化合价是X,则铁的氧化物是Fe2OX,根据两个方程式可以找到如下关系: Fe2OX~XCO2~XCaCO3 (112+16X) 100X 23.2g 40g 112+16X/100x=23.2g/40g 得:X=+8/3 ∵单质中铁的化合价为零,四氧化三铁中铁元素的化合价是:+8/3价,氧化铁中铁元素的化合价是:+3价.又∵0<8/3<3. ∴该混合物有三种可能:四氧化三铁;铁和氧化铁的混合物;四氧化三铁和氧化铁和铁的混合物.故选C. 13.目前,我国拟规定在公共场所全面禁烟。调查显示,约12%中国男性的死亡归因于烟草使用,每年有60万人因二手烟草烟雾暴露而死亡。烟草的重要成分烟碱,俗名尼古丁(C10H14N2) 会使人上瘾或产生依赖性并引发多种疾病。下列有关烟碱的说法错误的是 ( ) A.烟碱属于有机物 B.烟碱中碳、氢元素质量比为12:1 C.烟碱的相对分子质量为162 D.烟碱中碳元素的质量分数最高 【答案】B 【解析】 A、有机物:含碳元素的化合物,烟碱(C10H14N2) 属于有机物,正确,B、烟碱(C10H14N2)中碳、氢元素质量比=12×10:1×14=60:7,错误,C、烟碱(C10H14N2)的相对分子质量=12×10+1×14+14×2=162,正确,D、根据元素质量发生的表达式,烟碱中碳元素的质量分数最高,正确,故选A 14.下列各组溶液,不用其他试剂就能鉴别出来的是( ) A.HCl、Na2CO3、CaCl2、HNO3 B.FeCl3、NaOH、MgSO4、HCl C.NH4Cl、NaOH、K2SO4、BaCl2 D.KNO3、AgNO3、KCl、NaCl 【答案】B 为:B. 15.下列离子可在同一溶液中大量共存的是( ) A.SO42﹣ H+ Na+ OH﹣ B.H+ SO4 2﹣ K+ CO3 2﹣ C.Cl﹣ K+ Ca2+ NO3﹣ D.Ca 2+ CO3 2﹣ NO3﹣ Na+ 【答案】C 【解析】 A、H+、OH﹣两种离子能结合成水,不能大量共存.故选项错误; B、CO32﹣、H+能结合生成水和二氧化碳,则不能共存,故选项错误; C、四种离子间不能结合成沉淀、气体或水,能大量共存,故选项正确; D、Ca2+和CO32﹣结合生成碳酸钙沉淀,则不能共存,故选项错误;故答案为:C 16.某化学小组用一定量AgNO3和Al(NO3)3的混合溶液加入铜粉和锌粉,充分反应后过滤,得到溶液甲和固体乙,如图所示,则:①溶液甲中一定含有Al(NO3)3和Zn(NO3)2②固体乙中一定含有Ag,可能含有Cu和Zn ③若溶液甲是蓝色,则溶液甲一定含有Al( NO3) 3、Zn(NO3)2和Cu(NO3)2④向固体乙上滴加盐酸有气泡产生,则溶液甲中一定没有AgNO3和Cu(NO3 ) 2。上述四种说法正确的个数为( ) A.1个 B.2个 C.3个 D.4个【答案】D 17.CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( ) A.4.4g B.2.8g C.1.4g D.0.8g 【答案】C 【解析】根据质量守恒定律:化学反应前后的质量不变,所以将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,,可判断反应生成的二氧化碳质量为4.4g,即气体质量增加了4.4g-3.6g=0.8g,再根据方程式:3CO+ Fe2O3 高温 2Fe + 3CO2中一氧化碳与气体增量比为28:16,故原混合气体中CO质量为1.4g,故选C 二、非选择题 18.在生活中经常曝出某品牌金饰品掺假的事件,引起学生的好奇,某化学兴趣小组在老师的帮助下,对几种常见金属饰品所含的金属进行了相关的探究活动. 【提出问题】(1)怎样鉴别真假黄金?(2)怎样确定钯的金属活动性? 【查阅资料】 (1)假黄金通常是黄铜(Cu﹣Zu合金) (2)钯(Pd)呈银白色,有金属光泽,可用作饰品 【实验药品】钯、铂(Pt)、稀盐酸、硝酸银溶液和氯化钯(PdCl2)溶液 【实验探究】 (1)鉴别黄金样品的真假:取黄金样品于试管中,滴加稀盐酸后,观察黄金样品表面有气泡产生,该气体是 (填名称),说明此样品为 (填“真”或“假”)黄金. (2)探究钯的金属活动性:依据生活经验,同学们猜测钯的活动性可能与银和铂相近,于是他们利用上述药品进行如下实验: 实验步骤 实验现象 实验结论 把钯浸入硝酸银溶液中 无明显现象 钯的活动性比银 把铂浸入氯化钯溶液中 钯的活动性比铂强 初步得出结论:钯、银、铂的金属活动性由强到弱的顺序为 . 【废液处理】 (1)转化成沉淀.小组同学所有液体倒入废液缺缸中,出现白色沉淀.写出产生该现象的化学方程式: (写出一个即可). (2)通过科学合理的方法进一步回收金属钯. 【答案】【实验探究】(1)氢气;假. (2)弱;无明显现象;银、钯、铂. 【废液处理】ZnCl2+2AgNO3═2AgCl↓+Zn(NO3)2. 学方程式为:ZnCl2+2AgNO3═2AgCl↓+Zn(NO3)2. 19.某化学小组在探究碱的化学性质时,做了如图所示的两个实验. (1)写出A试管中发生反应的化学方程式 . (2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想: 【提出猜想】甲:滤液中的溶质是Na2SO4 CuSO4 乙:滤液中的溶质是Na2SO4 H2SO4 丙:滤液中的溶质是 4 丁:滤液中的溶质是Na2SO4 【交流讨论】同学们对以上的猜想提出质疑,认为猜想 不合理,理由是 【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验报告. 实验内容 预计现象 预计结论 (1)取少量滤液于试管中,观察 溶液呈无色 猜想 不成立 (2)继续在上述试管中加入 产生蓝色沉淀 猜想 成立 【答案】 (1)2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.(2)NaOH、Na2SO4.乙;如果滤液中含有稀硫酸,则不可能出现蓝色沉淀.【设计实验】(1)甲.(2) 硫酸铜溶液;产生蓝色沉淀;丙. 20.小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3.出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体. 【提出问题】白色固体是什么? 【作出猜想】 猜想Ⅰ:只有Na2CO3; 猜想Ⅱ:可能是Na2CO3和NaOH的混合物; 猜想Ⅲ: _________ 【査阅资料】 (1)碳酸氢钠不稳定受热易分解2NaHCO3Na2CO3+CO2↑+H2O (2)Na2CO3与NaOH的热稳定性较好 (3)CaCl2和NaCl的水溶液呈中性 【设计实验】 取一定量的白色固体,加热,若固体质量不变,猜想 _________ 错误;若固体质量减少,则二氧化碳与氢氧化钠反应后, _________ 过量. 【交流讨论】 小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行? _________ ;理由是 _________ . 【继续探究】白色固体中是否有氢氧化钠? 实验操作 实验现象 目的/结论 ①取白色固体适量配制成溶液.往所得溶液中滴加过量的 _________ ,充分反应后,过滤. 有白色沉淀生成 除去白色固体中的 _________ ②取滤液,往滤液中滴入几滴 _________ _________ 白色固体中没有氢氧化钠 【交流与反思】 由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 _________ . 【答案】【作出猜想】可能是Na2CO3和NaHCO3的混合物; 【设计实验】Ⅲ;二氧化碳;【交流讨论】不可行;氢氧化钠溶液和碳酸钠溶液都呈碱性,溶液的pH值都大于7;【继续探究】 实验操作 实验现象 目的/结论 氯化钙溶液 碳酸钠 酚酞试液 溶液仍为无色 碳酸钠溶液能和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,氢氧化钠溶液呈碱性,能使酚酞试液变红,所以实验方案是: 实验操作 实验现象 目的/结论 ①取白色固体适量配制成溶液.往所得溶液中滴加过量的氯化钙溶液,充分反应后,过滤. 有白色沉淀生成 除去白色固体中的碳酸钠 ②取滤液,往滤液中滴入几滴酚酞试液 溶液仍为无色 白色固体中没有氢氧化钠 【交流与反思】由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意密封保存. 21.如图所示,某实验小组进行以下实验: (1)上述实验进行对比的目的是 . (2)实验后,将A、B两试管中的溶液倒入同一个洁净的烧杯中,溶液无色.再向其中加入一定量的碳酸钠溶液(提示:CaCl2+Na2CO3═CaCO3↓+2NaCl),所得混合物中溶液的溶质成分有四种情况,请补充完整(酚酞省略不写):①NaCl;② ;③ ;④ .若该混合物中溶液无色,选用一种试剂即可确定溶质成分是哪种情况,写出所加试剂,预期现象和结论. 【答案】(1)稀盐酸能与氢氧化钙反应;(2)②NaCl、CaCl2;③NaCl、Na2CO3④NaCl、HCl;可选用碳酸钠溶液进行测试,取少量的待测溶液放于试管中,滴加少量的碳酸钠溶液,无任何现象时,溶液中仅含有氯化钠;若出现白色沉淀,溶液中含有氯化钠和氯化钙;若有气泡产生,溶液中含有氯化钠和氯化氢; 钠和氯化钙;若氢氧化钙与盐酸反应,盐酸有剩余,所加碳酸钠也与盐酸反应,且反应完毕后盐酸继 22.氯化钾固体样品中混有少量碳酸钾和硫酸钾两种杂质,为了获得纯净的氯化钾,将样品溶解,按如图所示步骤进行提纯.已知试剂1为氯化钡溶液,B、C为固体难溶物,每步骤加稍过量的试剂. (1)固体难溶物B含有碳酸钡和 ; (2)检验步骤①已除去杂质的方法(操作、现象、结论)是 ; (3)试剂Ⅱ中溶质的化学式: ,试剂Ⅲ的名称是 ; (4)由E获得氯化钾晶体的分离操作名称是 . 【答案】 (1)硫酸钡;(2)取少量A溶液滴加氯化钡溶液,如果没有出现白色沉淀生成,说明硫酸钾和碳酸钾已经除去;(3)K2CO3;盐酸;(4)蒸发结晶 【解析】 (1)氯化钡溶液和硫酸钾溶液反应生成硫酸钡沉淀和氯化钾,氯化钡溶液和碳酸钾溶液反应生成碳酸钡沉淀和氯化钾,所以可用氯化钡溶液除去硫酸钾和碳酸钾,所以固体难溶物B含有碳酸钡和硫酸钡;(2)氯化钡溶液和硫酸钾溶液反应生成硫酸钡沉淀和氯化钾,氯化钡溶液和碳酸钾溶液反应生成碳酸钡沉淀和氯化钾,所以可取少量A溶液滴加氯化钡溶液,如果没有出现白色沉淀生成,说明硫酸钾和碳酸钾已经除去;(3)氯化钡溶液过量,所以A中含有氯化钾和氯化钡,碳酸钾溶液和氯化钡溶液反应生成碳酸钡沉淀和氯化钾,所以试剂Ⅱ为碳酸钾;盐酸和碳酸钾反应生成氯化钾、水和二氧化碳,所以试剂Ⅲ的名称是盐酸;(4)氯化钾溶于水,所以由E获得氯化钾晶体的分离操作名称是蒸发结晶. 23.有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种。为确定其组成,小杨设计出实验方案,实验步骤及现象如下。请回答: 固体粉末 溶于水 ① 无色溶液 加过量Ba(NO3)2溶液 ② 过滤 白色沉淀 无色溶液 滴加足量稀H2SO4 ③ 产生气体, 沉淀不消失 滴加AgNO3溶液 ④ 产生白色沉淀 (第23题图) (1)写出步骤④中产生白色沉淀的化学方程式 ▲ 。 (2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。 ▲ 。 【答案】(1)NaCl+AgNO3=AgCl↓+NaNO3 或BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 (2)将步骤③中“稀H2SO4”改成“稀HCl(或稀HNO3)”; 如果产生气体,沉淀完全溶解,说明固体粉末中含Na2CO3(或Na2CO3和NaCl);如果产生气体,沉淀不完全溶解,说明固体粉末中含Na2CO3、Na2SO4(或Na2CO3、Na2SO4和NaCl)。 24.实验室有两瓶失去标签的稀盐酸和氢氧化钠溶液(记作A、B),小强用下列方法进行鉴别,回答下列问题。 (1)他取适量的A、B两种溶液于试管中,分别加入适量氯化铁溶液,观察到A中产生红褐色沉淀,则A是 NaOH,发生反应的化学方程式为 ↓+3NaCl; (2)他另取适量的A、B两种溶液于试管中,分别加入适量碳酸钠溶液,观察到B中的现象为 有气泡产生,发生反应的化学方程式为 ↑; (3)他通过测定溶液的酸碱度来鉴别:若pH >7,则溶液为 氢氧化钠; (4)他还利用了下列试剂进行鉴别,其中能鉴别的试剂是 AC.(填字母) A.锌 B.硝酸钠 C.石蕊试液. 【答案】(1)NaOH ;3NaOH+FeCl3=Fe(OH)3↓+3NaCl;(2)有气泡产生; 2HCl+Na2CO3=2NaCl+H2O+CO2↑;(3)>;氢氧化钠溶液氢氧化钠;<;稀盐酸氢氧化钠;(4)AC 25.一次实验课上,细心的小红,小敏同学同时发现盛有NaOH溶液的试剂瓶塞外有少量白色粉末. 【提出问题】白色粉末是什么呢? 【猜想与假设】①白色粉末是NaOH固体 ②白色粉末是Na2CO3固体 ③白色粉末是NaOH和Na2CO3的固体混合物 【实验探究】为了探究上述猜想,小红小敏取白色粉末置于烧杯中,加入水配制成溶液. (1)小红取溶液少量于试管中,加入稀盐酸,有气泡产生,该实验说明猜想 不成立. (2)能否向溶液中滴加酚酞试液来证明上述猜想 (填能或不能),你的理由是 (3)为了探究另外两个猜想哪个成立,小敏取溶液少量于试管中,加入过量CaCl2溶液后溶液变浑浊,该反应的化学方程式: .过滤,在滤液中滴加酚酞试液变红,表明猜想③成立. (4)用化学方程式解释NaOH变质的原因 ,该事实说明NaOH溶液或固体都必须密封保存. 【答案】(1)①; (2)不能; NaOH的水溶液和Na2CO3的水溶液均能使酚酞试液变红色; (3)Na2CO3+CaCl2 ═CaCO3↓+2NaCl;(4)2NaOH+CO2 =Na2CO3+H2O. 【解析】 (1)小红取溶液少量于试管中,加入稀盐酸,有气泡产生,说明白色粉末中含有Na2CO3固体;该实验说明猜想①不成立;(2)由于NaOH的水溶液和Na2CO3的水溶液均能使酚酞试液变红色,所以不能向溶液中滴加酚酞试液来证明上述猜想;答案应填:不能;NaOH的水溶液和Na2CO3的水溶液均能使酚酞试液变红色;(3)小敏取溶液少量于试管中,加入过量CaCl2 溶液后溶液变浑浊,说明溶液中含有Na2CO3,该反应的化学方程式:Na2CO3+CaCl2 ═CaCO3↓+2NaCl;(4)NaOH 遇二氧化碳会发生反应生成碳酸钠和水,该反应的化学方程式:2NaOH+CO2 =Na2CO3+H2O。 26.碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质。 【查阅资料】 ①Na2CO3 + CaCO3 = CaCO3↓+ 2NaCl ②2NaHCO3 Na2CO3 +CO2↑+ H2O ③ Ca(HCO3)2 易溶于水。 ④ CaCl2溶液分别与 NaHCO3、Na2CO3溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数): NaHCO3 Na 2CO3 0.1% 1% 5% 0.1% CaCl2 0.1% 无明显现象 有浑浊 有浑浊 有浑浊 1% 无明显现象 有浑浊 有浑浊,有微小气泡 有沉淀 5% 无明显现象 有浑浊 有浑浊,有大量气泡 有沉淀 【进行实验】 序号 实验装置 主要实验步骤 实验现象 实验 1 向 2 支试管中分别加入少 量Na 2CO3 和NaHCO3 溶液,再分别滴加盐酸 2 支试管中均有气泡产生 实验 2 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量Na2CO3 或NaHCO3 固体,分别加热一 段时间 Na 2CO3 受热时Ⅱ中无明显现象 NaHCO3受热时Ⅱ中出现 浑浊 实验 3 向Ⅱ中加入试剂 a,向Ⅰ中 加入少量 5%的 NaHCO3 溶 液,再滴加5%的 CaCl2 溶 液 Ⅰ中出现浑浊,有气泡产 生Ⅱ中出现浑浊 【解释与结论】 (1)实验1中, NaHCO3与盐酸反应的化学方程式为 。 (2)实验2中,试剂a为 。 (3)实验3中, NaHCO3与 CaCl+反应的化学方程式为: 2NaHCO3 + CaCl2 ==== + + +H2O 【反思与评价】 (1)实验 2 中,加热 NaHCO3后,试管Ⅰ中残留固体成分可能为能为 (写出所有可能)。 (2)资料④中,NaHCO3溶液与 CaCl2 溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是 。 (3)用 2 种不同的方法鉴别 Na 2CO3和NaHCO3 固体,实验方案分别为: ① ② 。 【答案】(1) NaHCO3 + HCl = NaCl ++H2O + CO2 ↑;(2) Ca(OH)2溶液 ;(3)2NaHCO3 + CaCl2= CaCO3↓++2NaCl + CO2 ↑+ H2O; 【反思与评价】(1) Na2CO3 ; Na2CO3 、 NaHCO3;(2)CaCl2 溶液的溶质质量分数较小,生成的CO2 量较少,CO2 溶于水,因此没有气泡;(3)①各取少量 0.1% 的 NaHCO3和Na2CO3加入等质量的5%的CaCl2溶液,若无明显现象,则为 NaHCO3,若观察到浑浊则为 Na2CO3;②各取少量Na2 CO3 和 NaHCO3固体于实验2装置中,若观察到澄清石灰水变浑浊,固体为 NaHCO3 ,若观察到无明显现象,固体为 Na2CO3。 ②各取少量 Na2CO3 和 NaHCO3固体于实验2装置中,若观察到澄清石灰水变浑浊,固体为 NaHCO3,若观察到无明显现象,固体为 Na2CO3。 27.某同学家的下水管道堵塞了,于是他买了一瓶“管道疏通剂”(部分说明如图).疏通剂是利用铝与氢氧化钠溶液反应时放出大量的热,以加快氢氧化钠与毛发等淤积物的作用,反应的原理为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.请回答下列有关问题: (1)该管道疏通剂需要密封保存的原因是 . (2)按照使用说明,该同学对“疏通剂”作了进一步研究.先向烧杯中加入206g水,再加入本品200g,当铝粉全部反应后,求:(计算结果保留1位小数) ①生成氢气的体积.(ρ氢气=0.09g/L) ②反应后溶液中氢氧化钠的质量分数. 【答案】(1)能和水反应.(2)66.7L;16.5% 28.铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算: 次 数 1 2 3 4 加入稀硫酸质量/g 50 50 50 50 剩余固体质量/g 8.5 7 6.6 6.6 (1)铜镁合金中铜的质量。 (2)求所加稀硫酸中溶质的质量分数。(写出计算过程) 【答案】(1)6.6g;(2) 12.25% 答:(1)铜镁合金中铜的质量6.6g;(2)求所加稀硫酸中溶质的质量分数为12.25% 29.兴趣小组欲测定某未知浓度Ba(OH)2溶液的溶质质量分数,请你和他们一起完成实验并回答有关问题. (1)配制30g 10%的Na2CO3溶液. 步骤为:计算、称取、量取、 、转移.量取水时应选用规格为 mL(从10、50、100中选取)的量筒.最后将碳酸钠溶液转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是 (填序号). A.30g B.10% C.Na2CO3溶液 (2)测定未知浓度Ba(OH)2,溶液的溶质质量分数. 取50g Ba(OH)2溶液,逐滴滴加上述Na2CO3溶液的过程中,测得产生沉淀与加入Na2CO3溶液的质量关系如图所示. ①恰好完全反应时,消耗Na2CO3溶液的质量为 g. ②请通过计算确定Ba(OH)2溶液的溶质质量分数. 【答案】(1)溶解 50 A(2)①21.2②溶质质量分数6.84% 30.某兴趣小组的同学为了测定碳酸钠样品(只含有氯化钠,不含其它杂质)中碳酸钠的含量,取该混合物样品与适量稀盐酸恰好完全反应,有关实验数据见附表. 附表:实验数据 反应前 反应后 实验数据 烧杯的质量/g 稀盐酸的质量/g 混合物样品的质量/g 烧杯和其中混合物的质量/g 40.6 123.4 12 171.6 (1)反应生成二氧化碳的质量为 g; (2)样品碳酸钠的质量分数是多少?(最后结果保留到0.1%) (3)反应后所得溶液的溶质质量分数是多少? 【答案】 (1)4.4g;(2)88.3%;(3)10% 【解析】 (1)根据化学方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑,由质量守恒定律可知反应前后减少的质量就是生成二氧化碳的质量,是40.6g+123.4g+12g﹣171.6g=4.4g; (2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y, Na2CO3+2HCl═2NaCl+H2O+CO2↑查看更多