- 2021-05-10 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
杭州市中考化学试卷含答案及解析
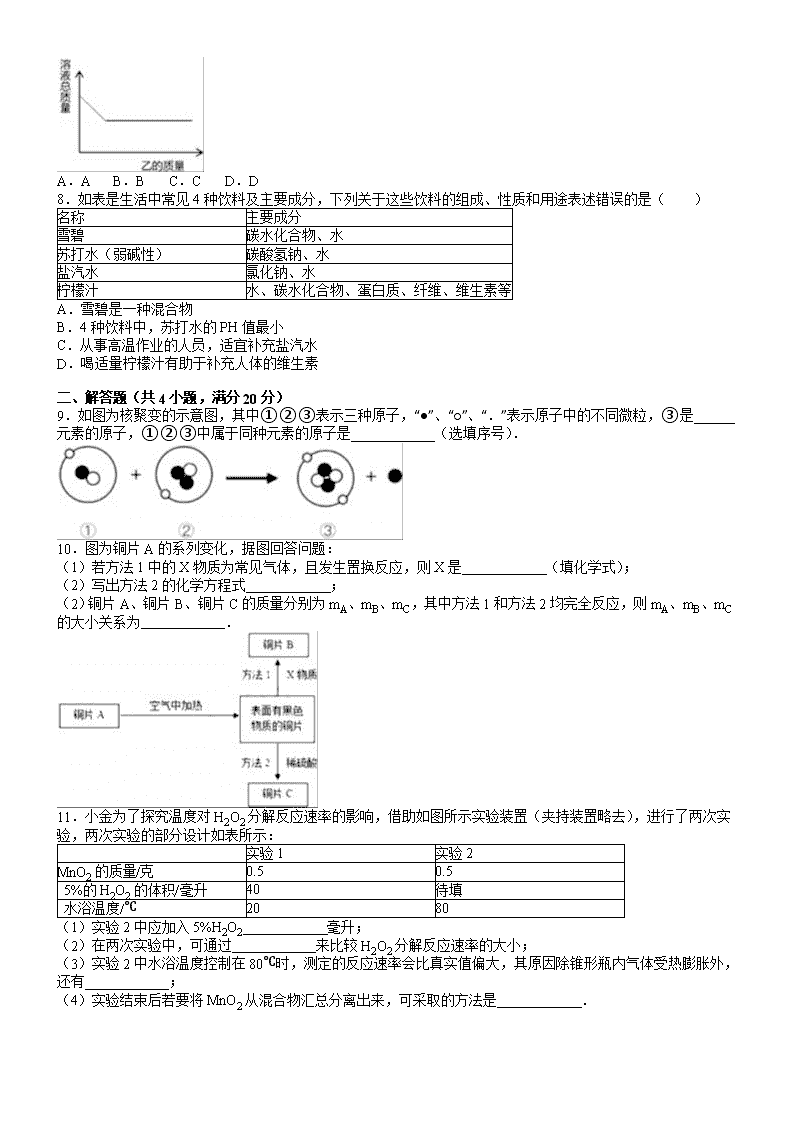
20XX年浙江省杭州市中考化学试卷(word版含答案及解析) 一、选择题(共7小题,每小题3分,满分21分) 1.下列选项正确的是( ) A. 检验甲烷燃烧有CO2生成 B. 读液体体积 C. 将带有残留夜的滴管倒持 D. 吹灭酒精灯 2.中国科学院某研究小组设计了一种高性能锂空气电池,其反应原理可表示为:2Li+O2Li2O2,已知锂元素在化合物中显+1价,下列说法错误的是( ) A.反应物锂是金属单质 B.该反应中MnO2是催化剂 C.Li2O2中氧元素的化合价显﹣2价 D.该反应是化合反应 4.下列有关钠在氯气中燃烧的实验,分析合理的是( ) A.钠在氯气中燃烧时,钠原子得到电子 B.反应物钠由分子构成,生成物氯化钠由离子构成 C.钠能在氯气中燃烧,说明燃烧不一定需要氧气参与 D.钠在氯气中燃烧生成的氯化钠与家庭中食用的氯化钠化学性质不同 5.一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( ) A.由饱和溶液变为不饱和溶液 B.溶质质量不变 C.溶液质量不变 D.溶质的质量分数减小 6.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( ) A.硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠 7.向一定质量的甲中连续加入乙至过量,此过程中溶液的总质量与加入乙的质量之间关系,符合如图曲线表示的是( ) 甲 乙 A 稀硫酸 氢氧化钠溶液 B 稀盐酸 碳酸钙粉末 C 稀盐酸 锌粒 D 硝酸银溶液 铜粉 A.A B.B C.C D.D 8.如表是生活中常见4种饮料及主要成分,下列关于这些饮料的组成、性质和用途表述错误的是( ) 名称 主要成分 雪碧 碳水化合物、水 苏打水(弱碱性) 碳酸氢钠、水 盐汽水 氯化钠、水 柠檬汁 水、碳水化合物、蛋白质、纤维、维生素等 A.雪碧是一种混合物 B.4种饮料中,苏打水的PH值最小 C.从事高温作业的人员,适宜补充盐汽水 D.喝适量柠檬汁有助于补充人体的维生素 二、解答题(共4小题,满分20分) 9.如图为核聚变的示意图,其中①②③表示三种原子,“●”、“○”、“.”表示原子中的不同微粒,③是 元素的原子,①②③中属于同种元素的原子是 (选填序号). 10.图为铜片A的系列变化,据图回答问题: (1)若方法1中的X物质为常见气体,且发生置换反应,则X是 (填化学式); (2)写出方法2的化学方程式 ; (2)铜片A、铜片B、铜片C的质量分别为mA、mB、mC,其中方法1和方法2均完全反应,则mA、mB、mC的大小关系为 . 11.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示: 实验1 实验2 MnO2的质量/克 0.5 0.5 5%的H2O2的体积/毫升 40 待填 水浴温度/℃ 20 80 (1)实验2中应加入5%H2O2 毫升; (2)在两次实验中,可通过 来比较H2O2分解反应速率的大小; (3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有 ; (4)实验结束后若要将MnO2从混合物汇总分离出来,可采取的方法是 . 12.焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5. 已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O B中发生的反应为:Na2SO3+SO2═Na2S2O5 (1)图中盛放浓硫酸的仪器名称是 ; (2)写出C中发生反应的化学方程式 ; (3)在实验过程中,滴加浓硫酸不宜过快,理由是 . (4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的 有关(填化学性质) 20XX年浙江省杭州市中考化学试卷 参考答案与试题解析 一、选择题(共7小题,每小题3分,满分21分) 1.下列选项正确的是( ) A. 检验甲烷燃烧有CO2生成 B. 读液体体积 C. 将带有残留夜的滴管倒持 D. 吹灭酒精灯 【考点】测量容器-量筒;加热器皿-酒精灯;液体药品的取用;常见气体的检验与除杂方法. 【分析】根据常见仪器的使用方法和注意事项,实验基本操作的正确操作方法回答本题. 【解答】解:A、检验甲烷燃烧有CO2生成,在火焰上方罩一个内壁涂有澄清石灰水的烧杯,澄清石灰水变浑浊,证明有二氧化碳生成,故正确; B、量筒读数时,视线要与凹液面最低处保持水平,故错误; C、将带有残留液的滴管倒持,会使残留液倒流,腐蚀胶头.故错误; D、熄灭酒精灯不能吹灭,要用灯帽盖灭,故错误; 故选A. 2.中国科学院某研究小组设计了一种高性能锂空气电池,其反应原理可表示为:2Li+O2Li2O2,已知锂元素在化合物中显+1价,下列说法错误的是( ) A.反应物锂是金属单质 B.该反应中MnO2是催化剂 C.Li2O2中氧元素的化合价显﹣2价 D.该反应是化合反应 【考点】资源综合利用和新能源开发;催化剂的特点与催化作用;单质和化合物的判别;有关元素化合价的计算;反应类型的判定. 【分析】A、根据物质的组成进行分析; B、根据反应过程进行来分析; C、根据在化合物中正负化合价代数和为零进行分析; D、根据反应物、生成物的种类及反应的特点分析反应的类型. 【解答】解:A、锂是由金属元素锂组成的纯净物,属于金属单质,故A正确; B、由化学反应方程式可知,该反应中MnO2是催化剂,故B正确; C、Li2O2是化合物,在化合物中正负化合价代数和为零,锂元素在钙化合物中显+1价,故氧元素的化合价为﹣1价,故C错误; D、该反应由两种物质生成了一种物质,属于化合反应,故D正确. 故选C. 4.下列有关钠在氯气中燃烧的实验,分析合理的是( ) A.钠在氯气中燃烧时,钠原子得到电子 B.反应物钠由分子构成,生成物氯化钠由离子构成 C.钠能在氯气中燃烧,说明燃烧不一定需要氧气参与 D.钠在氯气中燃烧生成的氯化钠与家庭中食用的氯化钠化学性质不同 【考点】金属的化学性质;原子和离子的相互转化;燃烧与燃烧的条件. 【分析】A、根据钠原子的最外层电子数是1,在化学反应中容易失去电子进行分析; B、根据钠是金属,金属是由原子直接构成的氯化钠是由钠离子、氯离子构成的进行分析; C、根据燃烧发生的条件下进行分析; D、根据同种物质的化学性质相同进行分析. 【解答】解:A、钠原子的最外层电子数是1,在化学反应中容易失去电子,故A错误; B、钠是金属,金属是由原子直接构成的氯化钠是由钠离子、氯离子构成的,故B错误; C、钠能在氯气中燃烧,说明燃烧不一定需要氧气参与,故C正确; D、钠在氯气中燃烧生成的氯化钠与家庭中食用的氯化钠化学性质相同,故D错误. 故选:C. 5.一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( ) A.由饱和溶液变为不饱和溶液 B.溶质质量不变 C.溶液质量不变 D.溶质的质量分数减小 【考点】晶体和结晶的概念与现象;溶质的质量分数. 【分析】根据题意,一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),不考虑溶剂的蒸发,则所得溶液中溶质的质量减少、溶剂的质量不变,结合饱和溶液与不饱和溶液的特征、溶质的质量分数等,进行分析判断. 【解答】解:A、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,剩余溶液不能继续溶解硝酸钾,仍为饱和溶液,故选项说法错误. B、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,故选项说法错误. C、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶液质量减少,故选项说法错误. D、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶质的质量分数减小,故选项说法正确. 故选:D. 6.小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( ) A.硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠 【考点】盐的化学性质. 【分析】根据题意,简易酸碱灭火器中碳酸钠溶液与一种常见的酸反应;结合石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,进行分析判断. 【解答】解:简易酸碱灭火器中碳酸钠溶液与一种常见的酸反应;结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色,石蕊溶液遇酸性溶液变红色,遇碱性溶液变蓝色,则说明残留液显酸性. ②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀存在,说明此沉淀是氯化银或硫酸钡沉淀,由于反应物是一种酸,酸与碳酸钠溶液反应生成盐、水和二氧化碳,同时酸有剩余,则原酸溶液为硫酸,硫酸与碳酸钠溶液反应生成硫酸钠、水和二氧化碳,则残留液中有大量的硫酸钠、硫酸. 故选:A. 7.向一定质量的甲中连续加入乙至过量,此过程中溶液的总质量与加入乙的质量之间关系,符合如图曲线表示的是( ) 甲 乙 A 稀硫酸 氢氧化钠溶液 B 稀盐酸 碳酸钙粉末 C 稀盐酸 锌粒 D 硝酸银溶液 铜粉 A.A B.B C.C D.D 【考点】酸的化学性质;金属的化学性质. 【分析】A、根据硫酸溶液中加入NaOH溶液发生中和反应,溶液总质量应该是随着NaOH的加入而不断上升的,图象不会有水平的那个阶段,进行解答; B、根据定量的盐酸,加入碳酸钙,当碳酸钙和盐酸全部反应完时,溶液质量就不变了,再加入大理石就不反应,且大理石是固体,它的质量不属于溶液的质量,所以最后总溶液的质量的不变;进行解答; C、锌置换氢气,显然质量增加,当盐酸反应完后,锌是固体,所以开始溶液质量增加,至反应完全后溶液总质量不再增加; D、根据铜粉置换银,因为铜的相对原子质量是64,银的相对原子质量是108.所以开始反应时,溶液总质量是降低的,进行解答. 【解答】解:A、硫酸溶液中加入NaOH溶液发生中和反应,溶液总质量应该是随着NaOH的加入而不断上升的,图象上不会有水平的那个阶段;不符合题意; B、开始时,溶液总质量就是盐酸的质量,随着加入大理石,溶液质量是不断增加的,当大理石和盐酸全部反应完时,溶液质量就不变了,因为盐酸已反应完,再加入大理石就不反应,且大理石是固体,它的质量不属于溶液的质量,所以最后总溶液的质量的不变;不符合题意; C、锌置换氢气,显然质量增加,当盐酸反应完后,锌是固体,所以开始溶液质量增加,至反应完全后溶液总质量不再增加;不符合题意; D、铜粉置换银,因为铜的相对原子质量是64,银的相对原子质量是108.所以开始反应时,溶液总质量是降低的,至反应完全后溶液总质量不变;正确. 故选D. 8.如表是生活中常见4种饮料及主要成分,下列关于这些饮料的组成、性质和用途表述错误的是( ) 名称 主要成分 雪碧 碳水化合物、水 苏打水(弱碱性) 碳酸氢钠、水 盐汽水 氯化钠、水 柠檬汁 水、碳水化合物、蛋白质、纤维、维生素等 A.雪碧是一种混合物 B.4种饮料中,苏打水的PH值最小 C.从事高温作业的人员,适宜补充盐汽水 D.喝适量柠檬汁有助于补充人体的维生素 【考点】生命活动与六大营养素;溶液的酸碱性与pH值的关系;常用盐的用途;纯净物和混合物的判别. 【分析】A.根据混合物的概念来分析; B.根据溶液的酸碱性来分析; C.根据人体排泄的物质来分析; D.根据维生素的来源来分析. 【解答】解:A.雪碧中含有水、碳水化合物等多种物质,属于混合物,故正确; B.苏打水成弱碱性,其pH>7,是最大,故错误; C.高温工作人员由于大量出汗,体内无机盐流失,可补充盐汽水调节人体内无机盐的平衡,故正确; D.柠檬汁含有维生素,喝适量的柠檬水可补充维生素,故正确. 故选B. 二、解答题(共4小题,满分20分) 9.如图为核聚变的示意图,其中①②③表示三种原子,“●”、“○”、“.”表示原子中的不同微粒,③是 氦 元素的原子,①②③中属于同种元素的原子是 ①② (选填序号). 【考点】原子的定义与构成;元素的概念. 【分析】根据微观结构示意图中的质子数来确定元素的种类、质子数决定元素的种类分析解答. 【解答】解:在原子中,电子在原子核的外部,所以小圈表示的是电子,在原子中,质子数=电子数,所以白球表示质子,黑圈表示中子;再根据元素的种类是由质子数决定的可知,③这种元素的原子核内有2个质子,所以是氦元素的原子;质子数决定元素的种类,由微观结构示意图可知,①和②这两种粒子核内的质子数均为1,故属于同种元素. 故答案为:氦;①②. 10.图为铜片A的系列变化,据图回答问题: (1)若方法1中的X物质为常见气体,且发生置换反应,则X是 H2 (填化学式); (2)写出方法2的化学方程式 CuO+H2SO4=CuSO4+H2O ; (2)铜片A、铜片B、铜片C的质量分别为mA、mB、mC,其中方法1和方法2均完全反应,则mA、mB、mC的大小关系为 mA=mB>mC . 【考点】金属的化学性质;酸的化学性质;书写化学方程式、文字表达式、电离方程式. 【分析】(1)根据常见的还原剂有碳单质、一氧化碳和氢气,X物质为常见气体,且发生置换反应,所以X是氢气进行分析; (2)根据氧化铜和硫酸反应生成硫酸铜和水进行分析; (3)根据方法1是将已经部分氧化的铜片重新用氢气还原,依据质量守恒中的原子守恒,方法1反应结束后,铜被重新还原,所以mA=mB,方法2中部分氧化的铜片产生了氧化铜,氧化铜与硫酸反应,有部分铜元素进入溶液中,剩余的铜单质的质量为mC,所以小于mA、mB进行分析. 【解答】解:(1)常见的还原剂有碳单质、一氧化碳和氢气,X物质为常见气体,且发生置换反应,所以X是氢气,化学式为:H2; (2)氧化铜和硫酸反应生成硫酸铜和水,化学方程式为:CuO+H2SO4=CuSO4+H2O; (3)方法1是将已经部分氧化的铜片重新用氢气还原,依据质量守恒中的原子守恒,方法1反应结束后,铜被重新还原,所以mA=mB,方法2中部分氧化的铜片产生了氧化铜,氧化铜与硫酸反应,有部分铜元素进入溶液中,剩余的铜单质的质量为mC,所以小于mA、mB,所以mA、mB、mC的大小关系为mA=mB>mC. 故答案为:(1)H2; (2)CuO+H2SO4=CuSO4+H2O; (3)mA=mB>mC. 11.小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示: 实验1 实验2 MnO2的质量/克 0.5 0.5 5%的H2O2的体积/毫升 40 待填 水浴温度/℃ 20 80 (1)实验2中应加入5%H2O2 40 毫升; (2)在两次实验中,可通过 相同的时间内注射器内气体的体积 来比较H2O2分解反应速率的大小; (3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有 温度较高时水蒸发成水蒸气 ; (4)实验结束后若要将MnO2从混合物汇总分离出来,可采取的方法是 过滤、洗涤、干燥 . 【考点】影响化学反应速率的因素探究;过滤的原理、方法及其应用. 【分析】(1)根据对比实验探究温度对H2O2分解反应速率影响的方法分析; (2)根据相同的时间内产生气体的多少分析; (3)根据温度高时水蒸发成水蒸气分析; (4)根据混合物的组成特点分析分离提纯MnO2的方法. 【解答】解:(1)利用对比试验探究温度对H2O2分解反应速率的影响时,变量应是温度,其余的量应相同,所以,实验2中应加入5%H2O240毫升; (2)在两次实验中,可通过相同的时间内注射器内气体的体积 来比较H2O2分解反应速率的大小; (3)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有温度较高时水蒸发成水蒸气; (4)实验结束后若要将MnO2从混合物汇总分离出来,由于MnO2不溶于水,可采取的方法是过滤、洗涤、干燥. 故答为:(1)40;(2)相同的时间内注射器内气体的体积小;(3)温度较高时水蒸发成水蒸气;(4)过滤、洗涤、干燥. 12.焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂,小金模仿化工生产,用如图装置来制取Na2S2O5. 已知:A中发生的反应为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O B中发生的反应为:Na2SO3+SO2═Na2S2O5 (1)图中盛放浓硫酸的仪器名称是 分液漏斗 ; (2)写出C中发生反应的化学方程式 SO2+2NaOH═Na2SO3+H2O ; (3)在实验过程中,滴加浓硫酸不宜过快,理由是 防止生成二氧化硫气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5 . (4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,若忘记这一操作,新制取的Na2S2O5产品中会混有Na2SO4杂质,这与O2的 氧化性 有关(填化学性质) 【考点】物质的相互转化和制备;常用仪器的名称和选用;书写化学方程式、文字表达式、电离方程式. 【分析】(1)根据常见仪器的名称进行分析; (2)根据反应物、生成物、质量守恒定律进行书写即可; (3)根据若滴加浓硫酸过快,则生成二氧化硫气体较快进行分析; (4)根据氧气的化学性质进行分析. 【解答】解:(1)图中盛放浓硫酸的仪器的名称为分液漏斗;故填分液漏斗; (2)反应过程中产生有害气体二氧化硫,需要进行尾气处理,二氧化硫与二氧化碳性质相似,与氢氧化钠反应生成相应的盐和水;反应的化学方程式为:SO2+2NaOH═Na2SO3+H2O;故填:SO2+2NaOH═Na2SO3+H2O (3)若滴加浓硫酸过快,则生成二氧化硫气体较快,可能导致二氧化硫气体来不及与B中的亚硫酸钠进一步反应生成Na2S2O5;故填:防止生成二氧化硫气体过快,来不及与B中的亚硫酸钠进一步反应生成Na2S2O5; (4)该实验开始滴加浓硫酸时,应先除尽装置内的空气,是为了防止Na2S2O5被氧化成Na2SO4,这里反映了氧气的氧化性;故填:氧化性. 查看更多