- 2021-05-10 发布 |
- 37.5 KB |
- 23页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
贵州省安顺市中考化学试卷
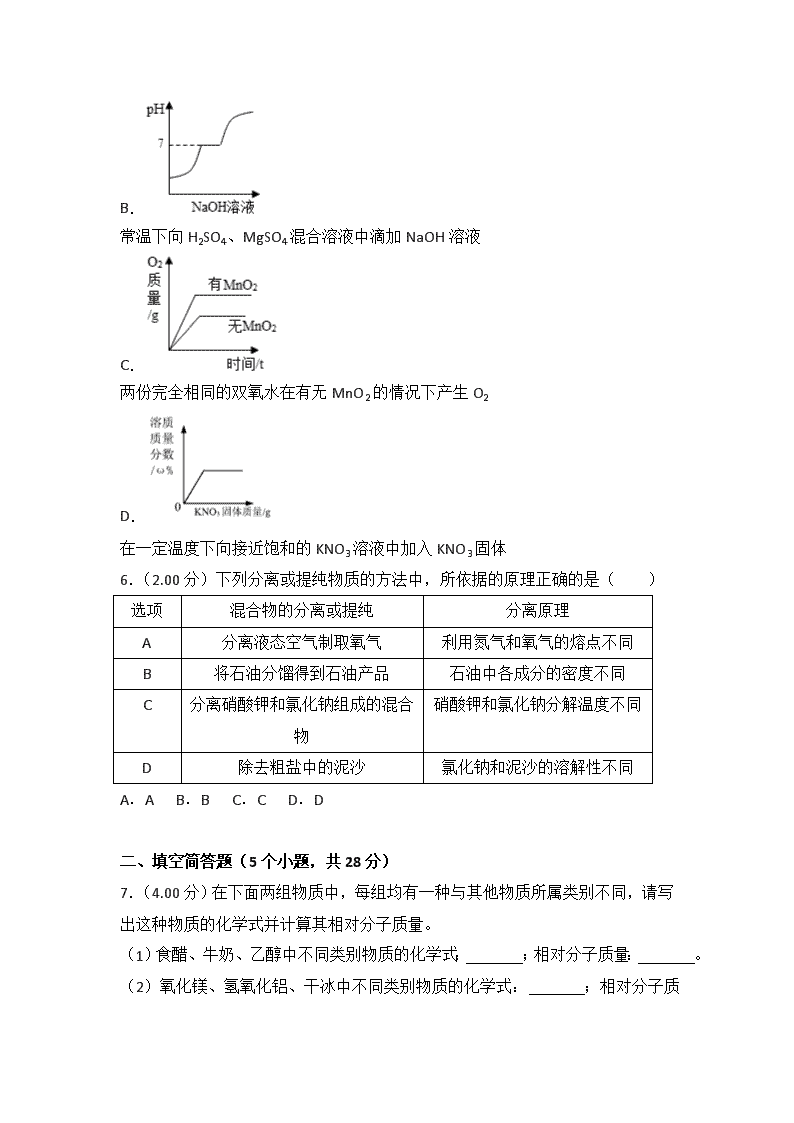
2018年贵州省安顺市中考化学试卷 一、选择题(6小题,每题2分,共12分) 1.(2.00分)以下对自然资源利用的过程中只发生物理变化的是( ) A. 铝土矿炼铝 B. 液化气燃烧 C. 木材制桌椅 D. 海水提取镁 2.(2.00分)下列实验操作不正确的是( ) A. 读取液体体积 B. 称量NaOH固体 C. 熄灭酒精灯 D. 检查装置的气密性 3.(2.00分)纯净物X在氧气中完全燃烧的化学方程式为:X+2O2 CO2+2H2O.下列说法不正确的是( ) A.该反应前后原子的种类发生改变 B.X是最简单的有机化合物 C.该反应的生成物都是氧化物 D.X是天然气的主要成分 4.(2.00分)“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( ) ①比较硬度,硬度小的是“愚人金” ②灼烧,表面变色的是“愚人金” ③浸没在稀硫酸中,表面有气泡产生的是“愚人金” ④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金” A.①③ B.②④ C.①④ D.②③ 5.(2.00分)下列图象能正确反映其对应关系的是( ) A. 电解水 B. 常温下向H2SO4、MgSO4混合溶液中滴加NaOH溶液 C. 两份完全相同的双氧水在有无MnO2的情况下产生O2 D. 在一定温度下向接近饱和的KNO3溶液中加入KNO3固体 6.(2.00分)下列分离或提纯物质的方法中,所依据的原理正确的是( ) 选项 混合物的分离或提纯 分离原理 A 分离液态空气制取氧气 利用氮气和氧气的熔点不同 B 将石油分馏得到石油产品 石油中各成分的密度不同 C 分离硝酸钾和氯化钠组成的混合物 硝酸钾和氯化钠分解温度不同 D 除去粗盐中的泥沙 氯化钠和泥沙的溶解性不同 A.A B.B C.C D.D 二、填空简答题(5个小题,共28分) 7.(4.00分)在下面两组物质中,每组均有一种与其他物质所属类别不同,请写出这种物质的化学式并计算其相对分子质量。 (1)食醋、牛奶、乙醇中不同类别物质的化学式: ;相对分子质量: 。 (2)氧化镁、氢氧化铝、干冰中不同类别物质的化学式: ;相对分子质量 。 8.(6.00分)通过一年的化学学习,我们认识了许多物质。请从①一氧化碳;②活性炭;③尿素;④氢气;⑤氦气;⑥氧气中,选取相应物质的序号填空(每种物质限选一次)。 (1)用于急救病人的气体是 ; (2)最清洁的燃料是 ; (3)可用于冰箱除异味的是 ; (4)可用作化肥的是 ; (5)充入灯泡内通电能发出有色光的是 ; (6)用于工业炼铁且有毒的气体是 。 9.(6.00分)请按照要求完成下列各题。 (1)根据要求写出相应的化学符号: ①锌元素被称为“智力之花”,该元素符号是 ; ②某种气体在空气中的体积分数占78%,表示出它的8个分子 。 (2)今天是小红爸爸的生日: ①妈妈为爸爸斟了满满一杯白酒,小红远远就闻到了酒的特殊香味,请从微观的角度解释能闻到香味的原因 ;爸爸点燃了生日蜡烛。许愿后大家一起将蜡烛吹灭。这种熄灭蜡烛火焰的原理是 。 ②小红用压岁钱给爸爸买了一条羊毛围巾。日常生活中可以用 的方法检验羊毛纤维和合成纤维;妈妈说面粉是制作蛋糕的主要原料,面粉中富含的营养素为 。 10.(6.00分)根据表中内容回答下列问题。 温度/℃ 溶解度/g 物质 0 20 40 60 80 KNO3 13.3 31.6 63.9 110 169 NaCl 35.7 36.0 36.6 37.3 38.4 Ca(OH)2 0.173 0.165 0.121 0.116 0.094 (1)随温度升高,Ca(OH)2溶解度的变化趋势是 (填“增大”、“减小”或“不变”)。 (2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 。 (3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 ;烧杯a所得溶液溶质的质量分数是 (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 。 (4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 。 11.(6.00分)某化学兴趣小组用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生化学反应,其中C物质的溶液呈蓝色,A与E反应产生的气体是光合作用的原理之一。 (1)A物质的俗称是 ,E物质的用途是 ; (2)B与C反应的化学方程式为 。E与D反应的基本类型是 。 (3)按游戏规则,下列能替代B物质的是 (填序号)。 ①银 ②氯化铁 ③氯化钡 ④氧化铜 三、实验及探究题(2个小题,共14分) 12.(6.00分)实验室部分仪器或装置如图所示,请回答下列问题。 (1)若要组装一套实验室制取二氧化碳的发生和收集装置,可选择图中 (填仪器或装置的标号),实验室用该装置制取二氧化碳的化学方程式为 。 (2)若用高锰酸钾制取氧气,你认为还需要增加的玻璃仪器是 ;写出该反应的化学方程式: 。 13.(8.00分)氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的CaH2 加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。 【提出问题】滤液中溶质的成分是什么? 猜想一:NaOH 猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2 经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 。 【实验验证】 实验 现象 结论 (1)取少量滤液,向其中滴入少量碳酸钠溶液 无明显现象 猜想 不成立 (2)另取少量滤液,向其中加入足量稀盐酸 猜想三成立 【反思与拓展】 (1)写出氢化钙(CaH2)与水反应的化学方程式 。 (2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和 。 (3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是 (写一条即可)。 四、计算题(只有一个小题,6分) 14.(6.00分)将含有可溶性杂质的某氯化镁样品3g溶于足量水中得到不饱和溶液,再向所得溶液中逐滴滴入200g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示: 试计算: (1)恰好完全反应时生成沉淀质量为 g。 (2)样品中含镁元素的质量是多少?(结果精确到0.01g) (3)原硝酸银溶液中溶质的质量分数是多少?(结果精确到0.1%) 2018年贵州省安顺市中考化学试卷 参考答案与试题解析 一、选择题(6小题,每题2分,共12分) 1.(2.00分)以下对自然资源利用的过程中只发生物理变化的是( ) A. 铝土矿炼铝 B. 液化气燃烧 C. 木材制桌椅 D. 海水提取镁 【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化与物理变化的本质区别是有无新物质生成,据此抓住化学变化和物理变化的区别结合事实进行分析判断即可。 【解答】解:A、铝土矿炼铝的过程中有新物质铝等生成,属于化学变化。 B、天然气燃烧的过程中有新物质二氧化碳和水生成,属于化学变化。 C、木材制桌椅的过程中只是形状发生改变,没有新物质生成,属于物理变化。 D、海水提取镁的过程中,有新物质镁等生成,属于化学变化。 故选:C。 【点评】本题难度不大,解答时要分析变化过程中是否有新物质生成,这里的新物质是指和变化前的物质是不同种的物质,若没有新物质生成属于物理变化,若有新物质生成属于化学变化。 2.(2.00分)下列实验操作不正确的是( ) A. 读取液体体积 B. 称量NaOH固体 C. 熄灭酒精灯 D. 检查装置的气密性 【分析】A.根据用量筒量取液体的方法考虑; B.据称量固体时易潮解物品的称量方法分析; C.根据酒精灯的使用分析; D.根据装置气密性检查的方法考虑。 【解答】解:A.视线与凹液面最低处保持水平,故正确; B.使用托盘天平时应将易潮解和腐蚀性强的药品放在玻璃器皿中称量,故错误 C.酒精灯的灯芯是活动的,所以在熄灭酒精灯时应该用灯帽盖灭,不能用嘴直接吹灭,故操作正确 D.将导管一段浸入水中,用手紧握烧瓶外壁,有水柱上升,说明气密性良好。故正确 故选:B。 【点评】化学实验的基本操作是做好化学实验的基础,学生要在平时的练习中多操作,掌握操作要领,使操作规范。 3.(2.00分)纯净物X在氧气中完全燃烧的化学方程式为:X+2O2 CO2+2H2O.下列说法不正确的是( ) A.该反应前后原子的种类发生改变 B.X是最简单的有机化合物 C.该反应的生成物都是氧化物 D.X是天然气的主要成分 【分析】A、根据质量守恒定律,进行分析判断。 B、由质量守恒定律:反应前后,原子种类、数目均不变,进行分析判断。 C、氧化物是只含有两种元素且其中一种元素是氧元素的化合物。 D、根据天然气的主要成分,进行分析判断。 【解答】解:A、化学反应前后原子的种类不变,故选项说法错误。 B、由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式X+2O2CO2+2H2O,反应前碳、氢、氧原子个数分别为0、0、4,反应后的生成物中碳、氢、氧原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则则每个X分子由1个碳原子和4个氢原子构成,则物质X的化学式为CH4,是最简单的有机化合物,故选项说法正确。 C、生成物二氧化碳和水,均是由两种元素组成的且有一种是氧元素的化合物,均属于氧化物,故选项说法正确。 D、天然气的主要成分是甲烷,故选项说法正确。 故选:A。 【点评】 本题难度不大,掌握质量守恒定律(反应前后,原子种类、数目均不变)、氧化物的特征、天然气的主要成分等是正确解答本题的关键。 4.(2.00分)“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是( ) ①比较硬度,硬度小的是“愚人金” ②灼烧,表面变色的是“愚人金” ③浸没在稀硫酸中,表面有气泡产生的是“愚人金” ④浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金” A.①③ B.②④ C.①④ D.②③ 【分析】根据金属的性质进行分析,金的化学性质稳定,一般不与其他物质发生化学反应,锌能与酸反应生成氢气,与盐溶液反应;铜能与氧气反应生成黑色氧化铜;真假黄金的硬度都很大。 【解答】解:①比较硬度,二者的硬度都很大,故错误; ②灼烧,铜能够和氧气反应产生氧化铜,表面变黑色的是“愚人金”,故正确; ③浸没在稀硫酸中,锌能够和学生反应产生氢气,因此表面有气泡产生的是“愚人金”,故正确; ④浸没在硫酸锌溶液中,三种金属都不能和硫酸锌反应,无法鉴别,故错误; 故选:D。 【点评】本题考查了常见金属的鉴别,在解此类题时,首先分析需要鉴别的物质的性质,然后选择适当的试剂和方法,出现不同的现象即可鉴别。 5.(2.00分)下列图象能正确反映其对应关系的是( ) A. 电解水 B. 常温下向H2SO4、MgSO4混合溶液中滴加NaOH溶液 C. 两份完全相同的双氧水在有无MnO2的情况下产生O2 D. 在一定温度下向接近饱和的KNO3溶液中加入KNO3固体 【分析】A、根据水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2进行分析; B、根据向H2SO4、MgSO4溶液中滴加NaOH溶液,氢氧化钠会先与硫酸反应生成硫酸钠,然后与硫酸镁反应生成氢氧化镁沉淀进行分析; C、根据催化剂只会改变反应的速率,不会影响生成氧气的质量进行分析; D、根据向接近饱和的KNO3溶液中加入KNO3固体,溶质质量分数不能从从零开始进行分析。 【解答】解:A、水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2,故A错误; B、向H2SO4、MgSO4溶液中滴加NaOH溶液,氢氧化钠会先与硫酸反应生成硫酸钠,然后与硫酸镁反应生成氢氧化镁沉淀,所以溶液的pH值先增大,然后不变,完全反应后,pH增大,故B正确; C、催化剂只会改变反应的速率,不会影响生成氧气的质量,故C错误; D、向接近饱和的KNO3溶液中加入KNO3 固体,溶质质量分数不能从从零开始,故D错误。 故选:B。 【点评】本题是过程与图象结合题,是对学生识图能力的考查,解题的关键是能正确的分析各个反应的过程并能结合图象分析问题。 6.(2.00分)下列分离或提纯物质的方法中,所依据的原理正确的是( ) 选项 混合物的分离或提纯 分离原理 A 分离液态空气制取氧气 利用氮气和氧气的熔点不同 B 将石油分馏得到石油产品 石油中各成分的密度不同 C 分离硝酸钾和氯化钠组成的混合物 硝酸钾和氯化钠分解温度不同 D 除去粗盐中的泥沙 氯化钠和泥沙的溶解性不同 A.A B.B C.C D.D 【分析】混合物的分离方法是指人们根据不同物质的性质的不同点,采用适当的方式将混合物中各物质分离开来的科学方法,据此结合常见的分离的方法,进行分析判断。 【解答】解:A、分离液态空气制取氧气,利用的是液态氮和液态氧沸点的不同,故选项错误。 B、将石油分馏得到石油产品,利用的是石油中各成分的沸点不同,故选项错误。 C、分离硝酸钾和氯化钠组成的混合物,利用的是硝酸钾和氯化钠的溶解度不同,故选项错误。 D、粗盐的主要成分是氯化钠,粗盐提纯是通过溶解(把不溶物与食盐初步分离)、过滤(把不溶物彻底除去)、蒸发(食盐从溶液中分离出来而得到食盐)得到精盐的过程,利用的是氯化钠和泥沙的溶解性不同,故选项正确。 故选:D。 【点评】本题难度不大,了解常见的混合物分离的方法、原理并能灵活运用是正确解答本题的关键。 二、填空简答题(5个小题,共28分) 7.(4.00分)在下面两组物质中,每组均有一种与其他物质所属类别不同,请写出这种物质的化学式并计算其相对分子质量。 (1)食醋、牛奶、乙醇中不同类别物质的化学式: C2H5OH ;相对分子质量: 46 。 (2)氧化镁、氢氧化铝、干冰中不同类别物质的化学式: Al(OH)3 ;相对分子质量 78 。 【分析】(1)食醋、牛奶、乙醇中乙醇属于纯净物,另外两种物质属于混合物,结合相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。 (2)氧化镁、氢氧化铝、干冰中氢氧化铝属于碱,另外两种物质属于氧化物,结合相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。 【解答】解:(1)食醋、牛奶、乙醇中乙醇属于纯净物,另外两种物质属于混合物,乙醇的化学式为C2H5OH;乙醇的相对分子质量为:12×2+1×5+16×5=46。 (2)氧化镁、氢氧化铝、干冰中氢氧化铝属于碱,另外两种物质属于氧化物,氢氧化铝的化学式为Al(OH)3;氢氧化铝的相对分子质量为27+(16+1)×3=78。 故答案为: (1)C2H5OH;46; (2)Al(OH)3;78。 【点评】本题难度不大,掌握相对分子质量的计算方法、物质的分类方法、化学式的书写是正确解答本题的关键。 8.(6.00分)通过一年的化学学习,我们认识了许多物质。请从①一氧化碳;②活性炭;③尿素;④氢气;⑤氦气;⑥氧气中,选取相应物质的序号填空(每种物质限选一次)。 (1)用于急救病人的气体是 ⑥ ; (2)最清洁的燃料是 ④ ; (3)可用于冰箱除异味的是 ② ; (4)可用作化肥的是 ③ ; (5)充入灯泡内通电能发出有色光的是 ⑤ ; (6)用于工业炼铁且有毒的气体是 ① 。 【分析】物质的结构和组成决定物质的性质,物质的性质决定物质的用途,根据物质的性质进行分析。 【解答】解:(1)氧气用于急救病人; (2)氢气燃烧生成水,是最清洁的燃料; (3)活性炭具有吸附性,可用于冰箱除异味; (4)尿素可用作化肥; (5)氦气充入灯泡内通电能发出有色光; (6)一氧化碳具有还原性和可燃性,可用于工业炼铁且有毒。 故答案为:(1)⑥;(2)④;(3)②;(4)③;(5)⑤;(6)①。 【点评】本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键。 9.(6.00分)请按照要求完成下列各题。 (1)根据要求写出相应的化学符号: ①锌元素被称为“智力之花”,该元素符号是 Zn ; ②某种气体在空气中的体积分数占78%,表示出它的8个分子 8N2 。 (2)今天是小红爸爸的生日: ①妈妈为爸爸斟了满满一杯白酒,小红远远就闻到了酒的特殊香味,请从微观的角度解释能闻到香味的原因 分子是在不断运动的 ;爸爸点燃了生日蜡烛。许愿后大家一起将蜡烛吹灭。这种熄灭蜡烛火焰的原理是 使温度降到着火点以下 。 ②小红用压岁钱给爸爸买了一条羊毛围巾。日常生活中可以用 灼烧闻气味 的方法检验羊毛纤维和合成纤维;妈妈说面粉是制作蛋糕的主要原料,面粉中富含的营养素为 糖类 。 【分析】(1)①书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写。 ② 在空气中占78%(体积百分含量)的气体是氮气,氮气是由氮分子构成的,它的8个分子为8个氮分子。 (2)①闻到气味,可用分子是在不断的运动的进行分析解释;结合灭火的三种原理,进行分析解答。 ②根据羊毛纤维的主要成分是蛋白质,人体所需六大营养素的种类、食物来源进行分析解答即可。 【解答】解:(1)①书写元素符号注意“一大二小”,锌的元素符号是Zn。 ②在空气中占78%(体积百分含量)的气体是氮气,氮气是由氮分子构成的,它的8个分子为8个氮分子,其分子符号为:8N2。 (2)①小红远远就闻到了酒的特殊香味,是因为酒精中含有的分子是在不断运动的,向四周扩散,使小红闻到酒的特殊香味。 许愿后大家一起将蜡烛吹灭,将热量吹走,使温度降到着火点以下。 ②羊毛纤维的主要成分是蛋白质,灼烧产生烧焦羽毛的气味,合成纤维灼烧产生特殊气味。 面粉中富含淀粉,淀粉属于糖类。 故答案为: (1)①Zn;②8N2; (2)①分子是在不断运动的;使温度降到着火点以下; ②灼烧闻气味;糖类。 【点评】本题难度不大,掌握羊毛纤维和合成纤维的鉴别方法、各种营养素的生理功能与食物来源、化学用语的书写方法等是正确解答本题的关键。 10.(6.00分)根据表中内容回答下列问题。 温度/℃ 溶解度/g 物质 0 20 40 60 80 KNO3 13.3 31.6 63.9 110 169 NaCl 35.7 36.0 36.6 37.3 38.4 Ca(OH)2 0.173 0.165 0.121 0.116 0.094 (1)随温度升高,Ca(OH)2溶解度的变化趋势是 减小 (填“增大”、“减小”或“不变”)。 (2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是 20℃~40℃ 。 (3)取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时存在如图1所示的实验现象,烧杯b中溶解的物质是 氯化钠 ;烧杯a所得溶液溶质的质量分数是 24% (结果精确到1%),若要使其溶质质量分数增大可采用的方法是 升温 。 (4)如图2所示,若向烧杯中加入足量的硝酸铵固体并使之充分溶解,在试管中可观察到的现象是 烧杯内水温下降,试管中有晶体析出 。 【分析】(1)根据表格中的数据来分析; (2)根据表格提供的数据结合已有的知识进行分析解答; (3)根据物质的溶解度、溶质质量分数的计算方法以及增大物质溶解度的方法来分析; (4)根据硝酸铵溶于水吸热以及硝酸钾的溶解度受温度影响来分析。 【解答】解:(1)通过分析溶解度表可知,随温度升高,硝酸钾溶解度的变化趋势是减小;故填:减小; (2)根据表格可以看出,在温度在20℃~40℃范围之内时,硝酸钾与氯化钠溶解度相等,故填:20℃~40℃; (3)20℃时,氯化钠的溶解度大于硝酸钾的溶解度,所以取KNO3、NaCl两种固体各36g分别放入20℃时的100g水中充分溶解,20℃时有如图1所示的实验现象,烧杯b中溶解的物质氯化钠;则烧杯a中溶解的是硝酸钾,此时硝酸钾溶液是饱和溶液,其中溶质的质量分数为:;因为硝酸钾的溶解度随着温度的升高而增大,所以若要使其溶质质量分数增大可以升高温度;故填:氯化钠;24%;升温; (4)硝酸铵溶于水,溶液温度降低,所以向烧杯中加入足量的硝酸铵使之充分溶解,可观察到的现象是:烧杯内水温下降,试管中有晶体析出;故填:烧杯内水温下降,试管中有晶体析出。 【点评】本题考查的是溶解度的影响因素以及溶解度的应用,完成此题,可以依据已有的知识进行。 11.(6.00分)某化学兴趣小组用铁、硫酸、氢氧化钡、硫酸铜和碳酸钠五种物质玩化学拼图游戏(如图),游戏规则要求图中相邻物质之间能发生化学反应,其中C物质的溶液呈蓝色,A与E反应产生的气体是光合作用的原理之一。 (1)A物质的俗称是 纯碱或苏打 ,E物质的用途是 金属除锈 ; (2)B与C反应的化学方程式为 Ba(OH)2+CuSO4=Cu(OH)2↓+BaSO4↓ 。E与D反应的基本类型是 置换反应 。 (3)按游戏规则,下列能替代B物质的是 ③ (填序号)。 ①银 ②氯化铁 ③氯化钡 ④氧化铜 【分析】本题属于推断题,根据题目给出的流程图和信息:其中C物质的溶液呈蓝色,因此C是硫酸铜;A与E反应产生的气体是光合作用的原理之一,铁与硫酸铜反应生成铜和硫酸亚铁,氢氧化钡和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钡白色沉淀,碳酸钠和硫酸反应生成硫酸钠和水和二氧化碳,硫酸能与三种物质反应,因此E是硫酸,A是碳酸钠,B是氢氧化钡,D是铁。 【解答】解:(1)A是碳酸钠,俗名纯碱或苏打,E是硫酸,E物质的用途是:金属除锈、做化工原料等,故答案为:纯碱或苏打;金属除锈;(合理即可) (2)氢氧化钡和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钡白色沉淀,铁与硫酸反应生成硫酸亚铁和氢气,属于置换反应;故答案为:Ba(OH)2+CuSO4=Cu(OH)2↓+BaSO4↓;置换反应; (3)按游戏规则,下列能替代B物质的是氯化钡,它能与碳酸钠、硫酸铜、硫酸反应;故答案为:③; 【点评】本考点属于物质的推断题,是通过对实验方法和过程的探究,在比较鉴别的基础上,得出了正确的实验结论。本考点是中考的重要内容之一,一般有两种类型:一是图框式推断题;二是文字描述型推断题;本题属于第一种类型。不论哪一种类型,都是通过实验现象,从而得出物质的组成。此考点主要出现在填空题和实验题中。 三、实验及探究题(2个小题,共14分) 12.(6.00分)实验室部分仪器或装置如图所示,请回答下列问题。 (1)若要组装一套实验室制取二氧化碳的发生和收集装置,可选择图中 ABCEG (填仪器或装置的标号),实验室用该装置制取二氧化碳的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ 。 (2)若用高锰酸钾制取氧气,你认为还需要增加的玻璃仪器是 酒精灯 ;写出该反应的化学方程式: 2KMnO4K2MnO4+MnO2+O2↑ 。 【分析】(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;因此要组装一套实验室制取二氧化碳的发生和收集装置,可选择图中ABCEG; (2)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。 【解答】解:(1)实验室制取CO2 ,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;因此要组装一套实验室制取二氧化碳的发生和收集装置,可选择图中ABCEG;故答案为:ABCEG;CaCO3+2HCl=CaCl2+H2O+CO2↑; (2)若用高锰酸钾制取氧气,我认为还需要增加的玻璃仪器是酒精灯,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;故答案为:酒精灯;2KMnO4K2MnO4+MnO2+O2↑; 【点评】本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。本考点是中考的重要考点之一,主要出现在实验题中。 13.(8.00分)氢化钙固体是登山运动员常用的能源提供剂。某探究小组的同学通过查阅资料得知:氢化钙(CaH2)遇水反应生成氢氧化钙和氢气。探究斯小组的同学把一定量的CaH2 加入Na2CO3溶液中,充分反应后过滤,得到滤渣和滤液,经检验滤渣的成分是碳酸钙。 【提出问题】滤液中溶质的成分是什么? 猜想一:NaOH 猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2 经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因 Na2CO3+Ca(OH)2═CaCO3↓+2NaOH 。 【实验验证】 实验 现象 结论 (1)取少量滤液,向其中滴入少量碳酸钠溶液 无明显现象 猜想 二 不成立 (2)另取少量滤液,向其中加入足量稀盐酸 产生气泡 猜想三成立 【反思与拓展】 (1)写出氢化钙(CaH2)与水反应的化学方程式 CaH2+2H2O=Ca(OH)2+2H2↑ 。 (2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和 氨气 。 (3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是 携带方便 (写一条即可)。 【分析】碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,和稀盐酸反应生成氯化钠、水和二氧化碳; 氢化钙和水反应生成氢氧化钙和氢气,氢氧化钙和氯化铵反应生成氯化钙、水和氨气。 【解答】解:【提出问题】 经过讨论,大家一致认为猜想四不合理,这是因为碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。 【实验验证】 (1)取少量滤液,向其中滴入少量碳酸钠溶液,无明显现象,说明溶液中不含有氢氧化钙; (2)另取少量滤液,向其中加入足量稀盐酸,产生气泡,说明溶液中含有碳酸钠,实验过程如下所示: 实验 现象 结论 (1)取少量滤液,向其中滴入少量碳酸钠溶液 无明显现象 猜想二不成立 (2)另取少量滤液,向其中加入足量稀盐酸 产生气泡 猜想三成立 【反思与拓展】 (1)氢化钙(CaH2)与水反应的化学方程式为:CaH2+2H2O=Ca(OH)2+2H2↑。 故填:CaH2+2H2O=Ca(OH)2+2H2↑。 (2)若向NH4Cl的溶液中加入一定量的CaH2,充分反应,产生的气体有氢气和氯化铵与氢氧化钙反应生成的氨气。 故填:氨气。 (3)登山运动员携带CaH2作为能源提供剂与携带氢气相比,其优点是携带方便、安全。 故填:携带方便。 【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。 四、计算题(只有一个小题,6分) 14.(6.00分)将含有可溶性杂质的某氯化镁样品3g溶于足量水中得到不饱和溶液,再向所得溶液中逐滴滴入200g一定溶质质量分数的AgNO3溶液(杂质不含镁元素且不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示: 试计算: (1)恰好完全反应时生成沉淀质量为 5.74 g。 (2)样品中含镁元素的质量是多少?(结果精确到0.01g) (3)原硝酸银溶液中溶质的质量分数是多少?(结果精确到0.1%) 【分析】氯化镁和硝酸银反应生成氯化银和硝酸镁,根据反应的化学方程式及其提供的数据可以进行相关方面的计算。 【解答】解:(1)恰好完全反应时生成沉淀质量为5.74g。 故填:5.74。 (2)设氯化镁质量为x,反应的硝酸银质量为y, MgCl2+2AgNO3═2AgCl↓+Cu(NO3)2, 95 340 287 x y 5.74g ==, x=1.9g,y=6.8g, 样品中含镁元素的质量是:1.9g×=0.48g, 答:样品中含镁元素的质量是0.48g。 (3)原硝酸银溶液中溶质的质量分数是:×100%=6.8%, 答:原硝酸银溶液中溶质的质量分数是6.8%。 【点评】本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性。 查看更多