- 2021-05-10 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届中考化学复习汇编 2 氧气的制取 新人教版
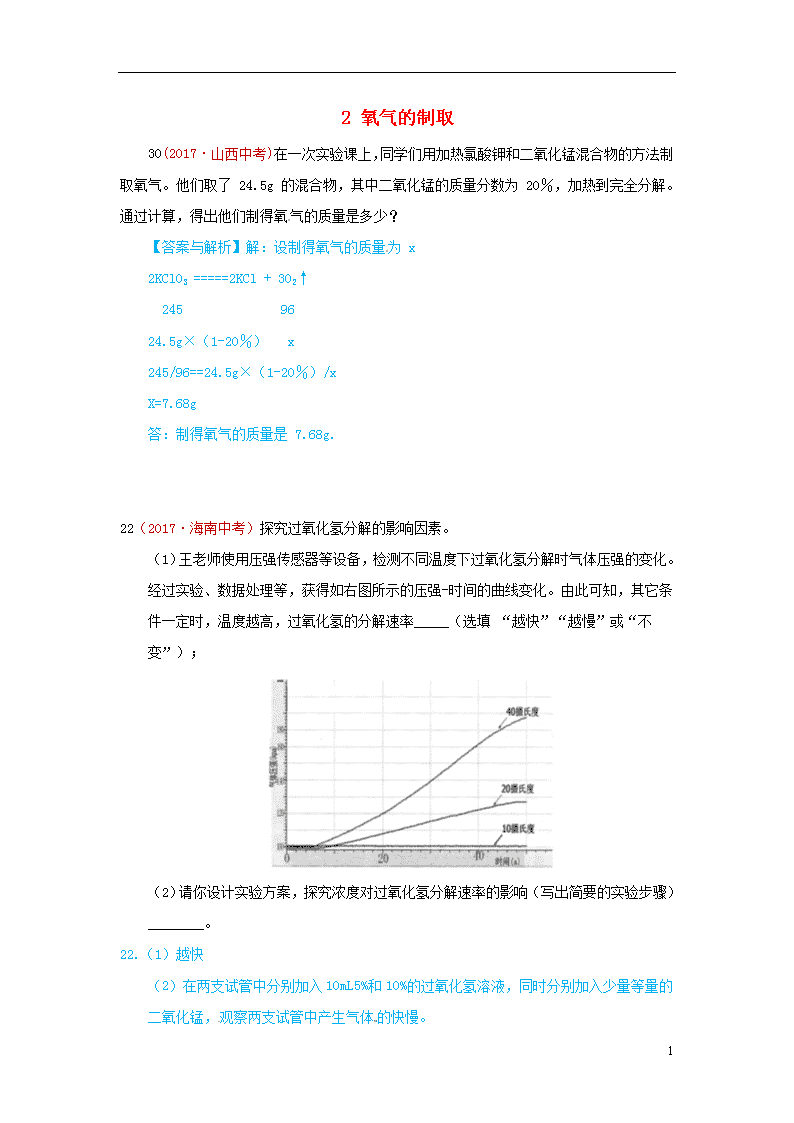
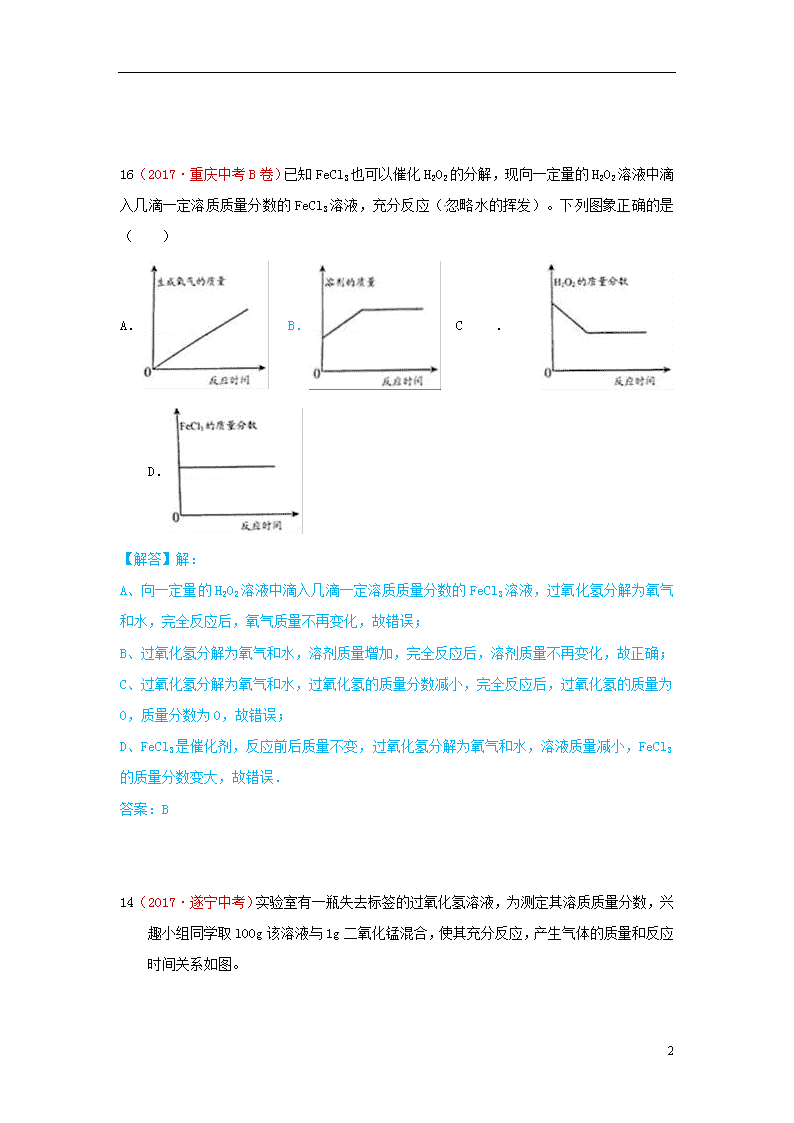
2 氧气的制取 30(2017·山西中考)在一次实验课上,同学们用加热氯酸钾和二氧化锰混合物的方法制取氧气。他们取了 24.5g 的混合物,其中二氧化锰的质量分数为 20%,加热到完全分解。通过计算,得出他们制得氧气的质量是多少? 【答案与解析】解:设制得氧气的质量为 x 2KClO3 =====2KCl + 3O2↑ 245 96 24.5g×(1-20%) x 245/96==24.5g×(1-20%)/x X=7.68g 答:制得氧气的质量是 7.68g. 22(2017·海南中考)探究过氧化氢分解的影响因素。 (1)王老师使用压强传感器等设备,检测不同温度下过氧化氢分解时气体压强的变化。经过实验、数据处理等,获得如右图所示的压强-时间的曲线变化。由此可知,其它条件一定时,温度越高,过氧化氢的分解速率_____(选填 “越快”“越慢”或“不变”); (2)请你设计实验方案,探究浓度对过氧化氢分解速率的影响(写出简要的实验步骤)________。 22.(1)越快 (2)在两支试管中分别加入10mL5%和10%的过氧化氢溶液,同时分别加入少量等量的二氧化锰,观察两支试管中产生气体的快慢。 6 16(2017·重庆中考B卷)已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发)。下列图象正确的是( ) A. B. C. D. 【解答】解: A、向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,过氧化氢分解为氧气和水,完全反应后,氧气质量不再变化,故错误; B、过氧化氢分解为氧气和水,溶剂质量增加,完全反应后,溶剂质量不再变化,故正确; C、过氧化氢分解为氧气和水,过氧化氢的质量分数减小,完全反应后,过氧化氢的质量为0,质量分数为0,故错误; D、FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶液质量减小,FeCl3的质量分数变大,故错误. 答案:B 14(2017·遂宁中考)实验室有一瓶失去标签的过氧化氢溶液,为测定其溶质质量分数,兴趣小组同学取l00g该溶液与1g二氧化锰混合,使其充分反应,产生气体的质量和反应时间关系如图。 6 (1)完全反应后,经过滤、烘干,得到固体的质量为_______(不计操作过程中的损耗,1分) (2)产生气体的速度越来越慢的原因是_______。(1分) A.二氧化锰越来越少 B.过氧化氢溶液的溶质质盘分数越来越小 D.温度越来越高 (3)计算所用过氧化氢溶液的溶质质量分数。(规范写出计算过程,5分) (2017·海南中考)探究过氧化氢分解的影响因素。 (1)王老师使用压强传感器等设备,检测不同温度下过氧化氢分解时气体压强的变化。经过实验、数据处理等,获得如右图所示的压强-时间的曲线变化。由此可知,其它条件一定时,温度越高,过氧化氢的分解速率__________(选填 “越快”“越慢”或“不变”); (2)请你设计实验方案,探究浓度对过氧化氢分解速率的影响(写出简要的实验步骤)______________________________________________________________________________________________________________________________________________________________。 (1)越快 6 (2)在两支试管中分别加入10mL5%和10%的过氧化氢溶液,同时分别加入少量等量的二氧化锰,观察两支试管中产生气体的快慢 (2017·成都中考) (2017·襄阳中考)把干燥、纯净的氯酸钾和二氧化锰的混合物31.5g装入大试管中,加热制取氧气.待完全反应后,将试管冷却、称量,得到21.9g固体物质.计算制得氧气多少克?21.9g固体物质中含有哪些物质?各多少克? 解:根据质量守恒定律可得.生成的氧气的质量为31.5g﹣21.9g=9.6g 由于是完全反应,所以21.9g的固体是氯化钾和二氧化锰的混合物 6 设生成9.6g氧气的同时生成的氯化钾的质量为x 2KClO32KCl+3O2↑ 149 96 x 9.6g = x=14.9g 则二氧化锰的质量为21.9g﹣14.9g=7g 答:制得氧气为9.6g.21.9g固体物质中含有14.9g氯化钾和7g二氧化锰. 15(2017·随州中考)实验探究一:课本第二单元课后作业中有“寻找新的催化剂”的探究内容,实验中学探究小组据此设计了如下探究方案。 【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何? 【实验探究】 实验步骤 实验现象 实验结论及解释 Ⅰ. A中无明显现象,B中产生大量能使带火星木条复燃的气体 ①产生的气体是 氧气 ②红砖粉末能改变过氧化氢分解速率 Ⅱ.向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 ①又产生大量能使带火星木条复燃的气体 ②滤渣质量等于ag 红砖粉末的 质量和化学性质 6 在反应前后均没有发生变化,能作过氧化氢分解的催化剂 Ⅲ. 两试管中均产生气泡且 加入二氧化锰的试管中产生气泡的速率比加入红砖粉末的快 红砖粉末的催化效果没有二氧化锰粉末好 【拓展应用】 己知CuSO4也可作为过氧化氢分解的催化剂.向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气 3.2 g. 实验探究二:实验室中的试剂一般要密封保存,否则可能会与空气接触而变质.淅河中学化学学习小组发现一瓶未密封的氢氧化钾固体,对其是否变质进行探究. 【提出猜想】1.未变质 2.部分变质 3.完全变质 【查阅资料】KOH与NaOH性质类似,也能与CO2反应而变质.写出KOH变质的化学方程式为 2KOH+CO2═K2CO3+H2O . 【设计实验】 (l)取少量样品于试管中配成溶液,滴加足量稀盐酸有气泡产生,则猜想 1 不成立. (2)准确称取一定质量的固体样品,放在如图所示装置中进行实验,根据CO2的体积和密度计算变质产物的质量,从而确定变质情况,你认为这个方案是否可行,并说明理由 不可行,因为二氧化碳能够溶于水,并且能和水反应生成碳酸 . (3)请你另外设计一个方案,进一步探究变质情况 实验步骤 实验现象 实验结论 取少量样品于试管中,加入足量水溶解,加入足量的氯化钙溶液,静置后滴加酚酞试液 产生白色沉淀,溶液变红色 猜想2成立 6查看更多