- 2021-05-10 发布 |
- 37.5 KB |
- 18页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考真题分类汇总解析计算题
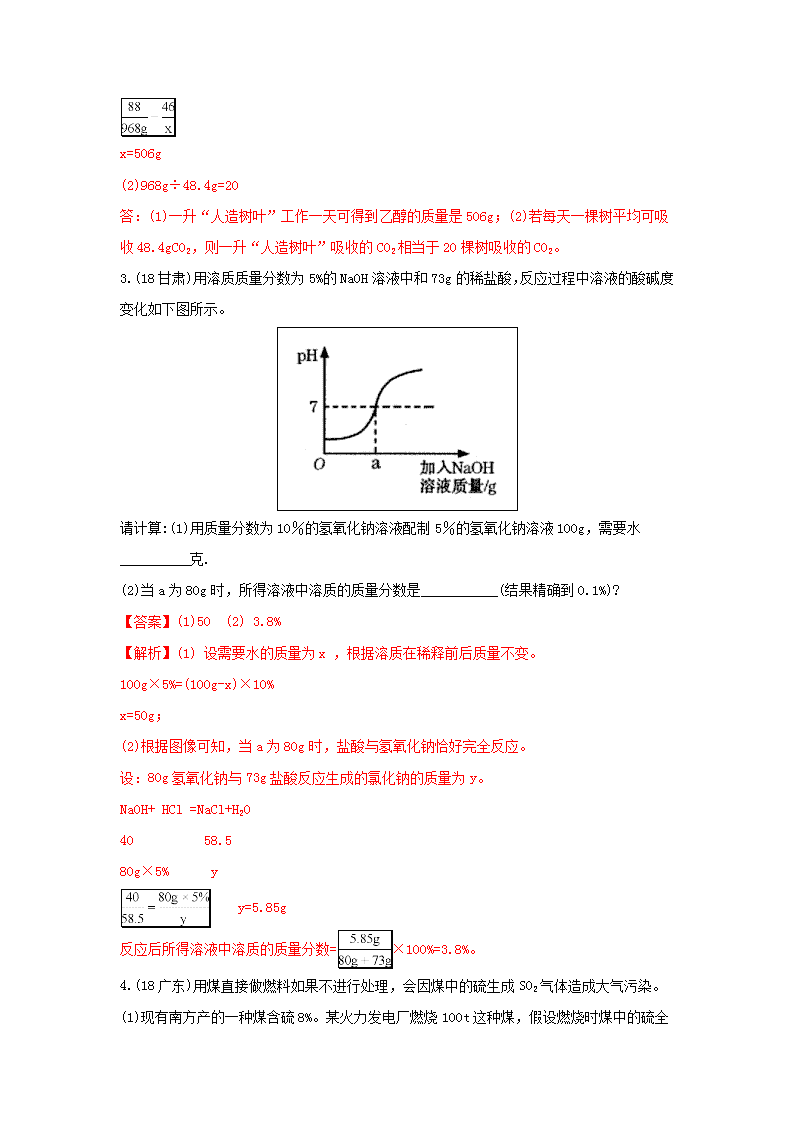
2018中考真题分类汇总解析 综合计算题(一) 1.(18安徽) 尿素[CO(NH2)2]是一种常见的氮肥,工业上制备反应如下: CO2+2NH3CO(NH2)2+H2O,请计算: (1)尿素中氮元素的质量分数。 (2)生产6t尿酸理论上需要氨气的质量是多少?化学试题参考答案及评分标准 【答案】(1)46.7%;(2)3.4t。 【解析】(1)尿素中氮元素的质量分数为:×100%=46.7% (2)设理论上需要氮气的质量为x。 CO2+2NH3CO(NH2)2+H2O 34 60 x 6t x=3.4t 答:生产6t尿酸理论上需要氨气的质量是3.4t。 2.(18福建)一种新型“人造树叶”可吸收二氧化碳并转化为乙醇(C2H5OH)燃料,化学方程式为2CO2+3H2OC2H5OH +3O2。研究显示,一升“人造树叶”每天可从空气中吸收968gCO2。 (1)一升“人造树叶”工作一天可得到乙醇的质量是________? (2)若每天一棵树平均可吸收48.4gCO2,则一升“人造树叶”吸收的CO2相当于_______棵树吸收的CO2。 【答案】 (1). 506g (2). 20 【解析】根据反应的化学方程式计算解答。(1)设一升“人造树叶”工作一天可得到乙醇的质量为x。 2CO2+3H2OC2H5OH +3O2 88 46 968g x x=506g (2)968g÷48.4g=20 答:(1)一升“人造树叶”工作一天可得到乙醇的质量是506g;(2)若每天一棵树平均可吸收48.4gCO2,则一升“人造树叶”吸收的CO2相当于20棵树吸收的CO2。 3.(18甘肃)用溶质质量分数为5%的NaOH溶液中和73g的稀盐酸,反应过程中溶液的酸碱度变化如下图所示。 请计算:(1)用质量分数为10%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水__________克. (2)当a为80g时,所得溶液中溶质的质量分数是___________(结果精确到0.1%)? 【答案】(1)50 (2) 3.8% 【解析】(1) 设需要水的质量为x ,根据溶质在稀释前后质量不变。 100g×5%=(100g-x)×10% x=50g; (2)根据图像可知,当a为80g时,盐酸与氢氧化钠恰好完全反应。 设:80g氢氧化钠与73g盐酸反应生成的氯化钠的质量为y。 NaOH+ HCl =NaCl+H2O 40 58.5 80g×5% y y=5.85g 反应后所得溶液中溶质的质量分数=×100%=3.8%。 4.(18广东)用煤直接做燃料如果不进行处理,会因煤中的硫生成SO2气体造成大气污染。 (1)现有南方产的一种煤含硫8%。某火力发电厂燃烧100t 这种煤,假设燃烧时煤中的硫全部转化为SO2,则产生SO2的质量是________? (2) 如在煤中混入粉末状的石灰石,则燃烧产生的SO2会与CaCO3反应生成CaSO3进入炉渣而减少大气污染。取50g此炉渣(含24%CaSO3)逐滴加入20%的盐酸,请在图坐标中画出相应的曲线图(纵坐标为盐的质量,请设定具体物质;并标出曲线中必要的数据)。 ________________ [已知]①设炉渣已不含石灰石,炉渣其它成分不与盐酸反应; ②CaSO3和盐酸反应类似于CaCO3 (3)向燃烧后的烟气喷洒石灰浆也可吸收SO2生成CaSO3。现用一万元分别购买两种原料来除去SO2,相关数据如下表: 方法 物质 相对分子质量 纯度 价格 (元/t) 除SO2的量 (t) A 石灰石 100 90% 200 14.4 B 熟石灰 74 94% 500 14.6 方法B比方法A除SO2的量略大,而且工业上多数采用方法B。其原因分别是:_________。 【答案】 (1). 16t (2). (3). ①单位价格(即10000元)氢氧化钙吸收二氧化硫的量更多;②石灰浆纯度较高,吸收二氧化硫气体更加充分 【解析】根据反应的化学方程式计算解答。(1)设生成二氧化硫的质量为x。 S+O2SO2 32 64 100t×8% x x=16t 答:生成二氧化硫的质量为16t。 (2) 设纵坐标为氯化钙的质量(或为亚硫酸钙的质量)。炉渣中CaSO3的质量为50g×24%=12g。设生成氯化钙的质量为y,反应消耗盐酸的质量为m。 CaSO3+2HCl=CaCl2+SO2↑+H2O 120 73 111 12g y m y=7.3g m=11.1g 反应消耗盐酸溶液的质量为7.3g÷20%=36.5g。相关曲线图为: 5.(18梧州) 为了测定某硫酸铜溶液的质量分数,小杨同学取50.0g样品置于烧杯中,逐滴加入氢氧化钠溶液,加入氢氧化钠溶液质量和生成沉淀质量的关系如下图所示。请计算: (1)NaOH的化学式量为 。 (2)硫酸铜刚好完全反应时,所得溶液的质量为 g(保留一位小数)。 (3)硫酸铜溶液中溶质的质量分数是多少?(写出计算过程) 【答案】(1)40;(2)65.1g;(3)16.0%。 【解析】(1)NaOH的化学式量为23×1+16×1+1×1=40;(2)硫酸铜刚好完全反应时,所得溶液的质量为50.0g+20.0g-4.9g=65.1g; (3)解:设样品中硫酸铜的质量为x CuSO4 + 2NaOH= Cu(OH)2↓ + Na2SO4 160 98 x 4.9g x=8 g 硫酸铜溶液中溶质的质量分数为 答:硫酸铜溶液中溶质的质量分数为16.0%。 6.(18黔东南) 化学实验小组同学为研究某公共场所铁制护栏锈蚀的程度,将12.8g已生锈的铁片,放入一定浓度的稀盐酸中充分反应,测得产生的气体质量与稀盐酸的质量关系如下图所示(假设铁片除有Fe2O3外,不含其他杂质)。 (1)生成氢气的质量为________g; (2)所用稀盐酸中溶质的质量分数为________; (3)计算该铁片中Fe2O3的质量分数为_______________(写出计算过程)。 【答案】 (1). 0.4 (2). 14.6% (3). 12.5% 【解析】(1)由图中信息可知,当稀盐酸的质量为115.0g。产生的氢气的质量为0.4g; (2)设铁的质量为x,稀盐酸中溶质质量为y Fe+2HCl═FeCl2+H2↑ 56 73 2 x y 0.4g x=11.2g, 7.(18海南) 实验室常用氯酸钾制备氧气,反应的化学方程式为 2KClO3 2KCl + 3O2↑。现加热 24.5g氯酸钾,最多可制得氧气多少克? 【答案】9.6g。 【解析】解:设生成氧气的质量为 x 2KClO3 2KCl + 3O2↑ 245 96 24.5g x 245/24.5g =96/x x = 9.6g 答:生成氧气的质量为 9.6g。 8.(18河北) 小明用某纯碱样品(含少量氯化钠)进行了图27所示的实验。请计算: (1)生成二氧化碳的总重量为_____g。 (2)所用稀盐酸的溶质质量分数。 【答案】(1)4.4g;(2) 7.3% 【解析】(1)根据反应前后物质减少的质量就是产生二氧化碳的质量:12g+50g+50g-107.6g=4.4g; (2)设反应所用稀盐酸的溶质质量分数为x Na2CO3+2HCl=2NaCl+H2O+CO2↑ 73 44 100gx 4.4g 73: 100gx=44: 4.4g x=7.3% ∴所用稀盐酸的溶质质量分数是7.3%。 答:所用稀盐酸的溶质质量分数是7.3%。 9.(18黄冈) 为测定某石灰石矿中碳酸钙的含量,现称取12.5g石灰石矿样品与足量的稀盐酸反应(杂质不溶于水,也不参与反应),得到二氧化碳气体4.4g(假设生成的气体全部逸出)。请计算:该石灰石样品含CaCO3的质量分数__________? 【答案】80% 【解析】解:设原石灰石中CaCO3的质量为x, CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 44 x 4.4g x=10g 石灰石中CaCO3的质量分数为: ×100%=80%。 10.(18荆州)取氯化钙和盐酸的混合溶液51.88g,逐滴滴加10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH变化关系如图所示,回答下列问题: (可能用到的相对分子质量:CaCl2﹣111 HCl﹣36.5 Na2CO3﹣106 NaCl﹣58.5 CaCO3﹣100 CO2﹣44 H2O﹣18) (1)BC段反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl 。 (2)CD段溶液pH>7的原因是 碳酸钠溶液本身显碱性,pH>7 。 (3)计算充分反应至C点时所得溶液中溶质的质量分数(写出计算过程,计算结果精确至0.1%)。 【解答】解:根据pH变化可知,AB段是碳酸钠和盐酸反应,BC段是碳酸钠和氯化钙反应,CD段是碳酸钠过量。 所以BC段反应是碳酸钠和氯化钙反应生成碳酸钙和氯化钠,对应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl。 CD段是碳酸钠过量由于CD段溶液pH>7的原因是 碳酸钠溶液本身显碱性,pH>7。 设碳酸钠和盐酸反应生成的二氧化碳的质量为x,生成的氯化钠的质量为y。而碳酸钠和氯化钙反应生成的碳酸钙的质量为z,生成的氯化钠的质量为a。 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 106 117 44 20g×10.6% y x == x=0.88g y=2.34g Na2CO3+CaCl2═CaCO3↓+2NaCl 106 100 117 10g×10.6% z a == z=1g a=1.17g 充分反应至C点时所得溶液中溶质的质量分数为×100%≈4.4% 答:(1)BC段反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl。 (2)CD段溶液pH>7的原因是 碳酸钠溶液本身显碱性,pH>7。 (3)充分反应至C点时所得溶液中溶质的质量分数为4.4%。 11. (18十堰)某兴趣小组对石灰石样品进行如下实验分析:取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算: 次数 1 2 3 4 加入稀盐酸的质量/g 25 25 25 25 剩余固体的质量/g 8 4 2 2 求: (1)样品中碳酸钙的质量为 10 g: (2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数。(写出计算过程,最终结果保留0.1%)。 【答案】10;10.5% 【解答】解:根据前两次都是固体减少4g,而第三次只减少2g,说明此时已经完全无反应,说明剩余的固体为杂质,碳酸钙的质量为12g﹣2g=10g。 设生成的氯化钙的质量为想,生成的二氧化碳的质量为y CaCO3+2HCl═CaCl2+H2O+CO2↑ 100 111 44 10g x y == x=11.1g y=4.4g 第4次加入稀盐酸后所得溶液中CaCl2的质量分数为×100%≈10.5% 答:(1)样品中碳酸钙的质量为 10g: (2)第4次加入稀盐酸后所得溶液中CaCl2的质量分数10.5%。 12. (18武汉) 某氯化钠样品中含有氯化镁。为测定其中氯化钠的质量分数,称量5.00g样品于烧杯中,加适量水完全溶解,然后逐滴加入氢氧化钠溶液至恰好完全反应,生成0.58g沉淀。请回答下列问题: (1)氢氧化钠溶液可使紫色石蕊溶液变成 蓝 色。 (2)计算该样品中氯化钠的质量分数。 【解答】根据紫色石蕊遇酸变红遇碱变蓝,氢氧化钠溶液是碱性溶液,所以可使紫色石蕊溶液变成 蓝色 设该样品中氯化钠的质量分数为x 2NaOH+MgCl2=2NaCl+Mg(OH)2↓ 95 58 5.00g×(1﹣x) 0.58g = x=81% 答:(1)氢氧化钠溶液可使紫色石蕊溶液变成 蓝色。 (2)该样品中氯化钠的质量分数为81%。 13. (18咸宁)为了测定一瓶硫酸铜溶液的溶质质量分数,取出50克该溶液,向其中逐滴加入溶质质量分数为16%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关量系如图所示,请你仔细分析此关系图,并进行计算: (1)当滴入氢氧化钠溶液 25 克时,硫酸铜与氢氧化钠恰好完全反应。 (2)计算此硫酸铜溶液中溶质的质量分数(写出计算过程)。 【解答】根据图可以看出加入25g氢氧化钠溶液时硫酸铜和氢氧化钠恰好完全生成氢氧化铜沉淀 设此硫酸铜溶液中溶质的质量分数为x。 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ 80 160 25g×16% 50gx = x=16% 答:(1)当滴入氢氧化钠溶液 25克时,硫酸铜与氢氧化钠恰好完全反应。 (2)此硫酸铜溶液中溶质的质量分数为16%。 14. (18襄阳)某同学将锌和氧化锌的混合物20g放入烧杯中,加入一定质量分数的稀硫酸,测得加入稀硫酸的质量与产生氢气质量的关系如图所示。求: (1)恰好完全反应时生成氢气的质量是_______g; (2)计算原20g混合物中氧化锌的质量分数_________。 【答案】 (1). 0.4 (2). 35%。 【解析】本题考查了根据化学方程式的计算。 (1)根据关系图可知,恰好完全反应时生成氢气的质量是0.4g; (2)设:产生0.4g的氢气需锌的质量为x。 Zn+H2SO4=ZnSO4+H2↑ 65 2 x 0.4g x=13g 混合物中氧化锌的质量=20g-13g=7g; 混合物中氧化锌的质量分数=×100%=35%。 答:(1)恰好完全反应时生成氢气的质量是0.4g; (2)计算原20g混合物中氧化锌的质量分数为35%。 15. (18宜昌)铜锌合金又称假黄金。向盛有30g铜锌合金粉末样品的烧杯中逐渐加入稀硫酸,生成氢气的质量与加入稀硫酸的质量关系如图所示,计算: (1)充分反应后生成氢气的质量为 0.2 g。 (2)合金样品中锌的质量。 (3)恰好完全反应时,所得溶液溶质的质量分数。(结果保留一位小数) 【答案】0.2g 6.5g 15.1% 【解答】根据图可知生成的氢气的质量为0.2g。 设合金样品中锌的质量为x,充分反应后生成硫酸锌的质量为y Zn+H2SO4=ZnSO4+H2↑ 65 161 2 x y 0.2g == x=6.5g y=16.1g 恰好完全反应后所得溶液溶质的质量分数:×100%=15.1% 答:(1)充分反应后生成氢气的质量为 0.2g。 (2)合金样品中锌的质量为6.5g (3)恰好完全反应时所得溶液溶质的质量分数为15.1%。 16. (18衡阳)氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H2OCl2↑+H2↑+2NaOH.现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到85.4g溶液,生成氢气的质量与时间的关系如图所示。请计算: (1)氯化钠完全反应时,生成氢气的质量是 0.4 g。 (2)氯化钠完全反应时,生成氢氧化钠的质量是 16 g。 (3)原氯化钠溶液中溶质的质量分数是多少? 【解答】解:(1)由图可知:氯化钠完全反应时,生成氢气的质量是0.4g,故填:0.4; (2)设生成氢氧化钠的质量是x,生成氯气的质量为y,氯化钠的质量为z 2NaCl+2H2OCl2↑+H2↑+2NaOH 117 71 2 80 z y 0.4g x x=16g;y=14.2g;z=23.4g; 故填:16; (3)原氯化钠溶液中溶质的质量分数是: =23.4% 答:原氯化钠溶液中溶质的质量分数是23.4%。 17(18娄底)高铁酸钠(Na2FeO4)是一种高效多功能水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为:3NaClO+2Fe(NO3) 3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O (1)次氯酸钠(NaClO) 中Cl元素的化合价为 +1 ; (2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为 7:8 (填最简比); (3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?(列式计算) 【解答】解:(1)在NaClO中,钠元素的化合价为+1价,氧元素的化合价为﹣2价,设次氯酸钠中氯元素的化合价为x,根据化合物中元素的正负化合价的代数和为0,则+1+x+(﹣2)=0,解得x=+1.故填:+1。 (2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量之比为56:(16×4)=7:8.故填:7:8。 (3)设次氯酸钠的质量为x, 3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O, 223.5 332 x 830kg , x=558.75kg, 答:至少需要次氯酸钠的质量是558.75kg。 18. (18邵阳)现有一瓶敞口放置在空气中的NaOH固体,欲知其组成成分,取样品9.3克向其中逐渐加入一定质量分数的稀盐酸,产生气体的质量与加入稀盐酸质量关系如图所示,试回答: (1)产生二氧化碳气体的质量为_______克。 (2)所用稀盐酸溶质质量分数为___________。 (3)求样品中氢氧化钠的质量分数为___________。(精确到0.1%) 【答案】 (1). 2.2 (2). 7.3% (3). 43.0% 【解析】本题考查了根据化学反应方程式的计算,认真审题,弄清反应过程,分析出盐酸与氢氧化钠反应的数据和盐酸与碳酸钠反应的数据是解题的基础。 (1)根据关系图可知,产生二氧化碳气体的质量为2.2克; (2)根据关系图可知,氢氧化钠固体已部分变质,其组成成分是氢氧化钠与碳酸钠混合物,向样品加入盐酸,碳酸钠与盐酸反应产生的二氧化碳会被氢氧化钠吸收,等氢氧化钠完全反应后,才能放出气体,所以消耗氢氧化钠的盐酸质量为50g,消耗碳酸钠的盐酸质量=(100g-50g)=50g;设生成2.2g的二氧化碳需碳酸钠的质量为x,需盐酸中的溶质的质量为y。 Na2CO3+2HCl=2NaCl+H2O+CO2↑ 106 73 44 x y 2.2g y=3.65g 稀盐酸溶质质量分数=×100%=7.3%; (3) x=5.3g 样品中含有氢氧化钠质量为:9.3g-5.3g=4g,氢氧化钠的质量分数= ×100%=43%。答:(1)产生二氧化碳气体的质量为2.2克。 (2)所用稀盐酸溶质质量分数为7.3%。 (3)样品中氢氧化钠的质量分数为43%。 16.(18长沙)小英同学用某铁合金样品做了如下实验:称量11.4g样品,放入质量为40g的烧杯中,再往烧杯中加入200g稀硫酸,恰好完全反应(杂质不与酸反应,也不溶于水)。反应完毕后称量,烧杯及烧杯内物质总质量为251g。求: (1)反应产生的氢气质量为__________g; (2)所用稀硫酸的溶质质量分数________________(写出计算过程)。 【答案】 (1). 0.4 (2). 9.8% 【解析】本题考查了根据化学反应方程式的计算。根据质量守恒可知,反应过程中质量的减少是因为生成了氢气,可以求算氢气的质量,根据氢气的质量和对应的化学方程式求算硫酸的质量。 (1)由质量守恒可知,反应产生的氢气的质量是11.4g+40g+200g-251g=0.4g; (2)设:生成0.4g的氢气需硫酸的质量为 x Fe+H2SO4=FeSO4+H2↑ 98 2 x 0.4g x=19.6g 稀硫酸的溶质质量分数=×100%=9.8%。 答:(1)反应产生的氢气质量为0.4g; (2)所用稀硫酸的溶质质量分数为9.8%。 17. (18宿迁)某硫酸厂欲测定排放的废水中硫酸的质量分数(假设废水中只含硫酸一一种溶质),取废水样品200g,逐滴加入溶质质量分数为5%的氢氧化钠溶液,废水中硫酸的质量随加入氢氧化钠溶液质量变化如下图所示, (1)要配制100g 5%的氢氧化钠溶液,需氢氧化钠固体质量为___________g; (2)计算该废水中硫酸的质量分数为_____________(写出计算过程)。 【答案】 (1). 5g (2). 2.45% 【解析】(1)要配制100g 5%的氢氧化钠溶液,需氢氧化钠固体质量为100g5%=5g (2)设200g废水中硫酸的质量为x 2NaOH + H2SO4= 2H2O+ Na2SO4 80 98 80g x = ,解得x=4.9g 该废水中硫酸的质量分数为=2.45% 18.(18济宁)长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分數利用图I装置将足量的盐酸加入到10.0g水垢中。随反应进行,装置C质量的变化如图I所示。请回答: (1)向图I装置A中不断通入氮气的目的是_______________; (2)若不考虑盐酸的挥发和水垢中含有其他成分,请根据图II数据计算: 水垢中碳酸钙的质量是________,水垢中氢氧化镁的质量分数是___________; (不要求计算过程,精确到0.1) (3)若考虑盐酸的挥发,会造成水垢中碳酸钙质量分数的测量结果_______(填“增大”“减小”或“不变”)。 【答案】(1)将装置AB中的二氧化碳排入C装置,并被吸收;(2)7.5g;25.0%; (3)增大。 【解析】(1)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,二氧化碳被C中氢氧化钡吸 收,用于计算,所以用氮气将装置AB中的二氧化碳排入C装置,并被吸收; (2)设参加反应的碳酸钙的质量为x, CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 44 x 3.3g (100/x)=44/3.3g x=7.5g 水垢中氢氧化镁的质量分数是 (10.0g-7.5g)/10g×100%=25.0% (3)若考虑盐酸的挥发,挥发出的氯化氢气体与氢氧化钠反应会使溶液质量增加,会使溶 液质量增加偏大,会造成水垢中碳酸钙质量分数的测量结果增大。 19. (18临沂)请你仔细分析如图所示的实验过程和提供的数据,并进行计算。 (1)生成氢气 0.4 g。 (2)反应后所得溶液中溶质的质量分数是多少?(写出计算过程,精确到0.1%)。 【解答】解:(1)设消耗11.2g铁生成的氯化亚铁的质量为x,生成的氢气的质量为y。 Fe+2HCl═FeCl2+H2↑, 56 127 2 11.2g x y x=25.4g,y=0.4g (2)反应后所得溶液中溶质的质量分数是×100%=12.7%, 答:(1)生成氢气0.4g,(2)反应后所得溶液中溶质的质量分数是12.7%。 20.(18泰安)厨房中使用的食用碱(主要成分碳酸钠) 中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸纳的质量分数。他们实验的过程和数据如下图所示。 计算:该食用碱中碳酸钠的质量分数是__________? (计算结果精确至0.1%) 【答案】88.3% 【解析】本题主要考查根据化学方程式的计算,难度不大,需要首先搞清反应原理,然后结合题中所给的数据进行解答。 设:6g食用碱样品中含碳酸钠的质量为x。 Na2CO3+ CaCl2==CaCO3↓+ 2NaCl 106 100 X 5.0g X=5.3g 该食用碱中碳酸钠的质量分数为: ×100%= 88.3%。 答:该食用碱中碳酸钠的质量分数为88.3%。查看更多