- 2022-04-09 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学阶段质量检测3从矿物到基础材料苏教版
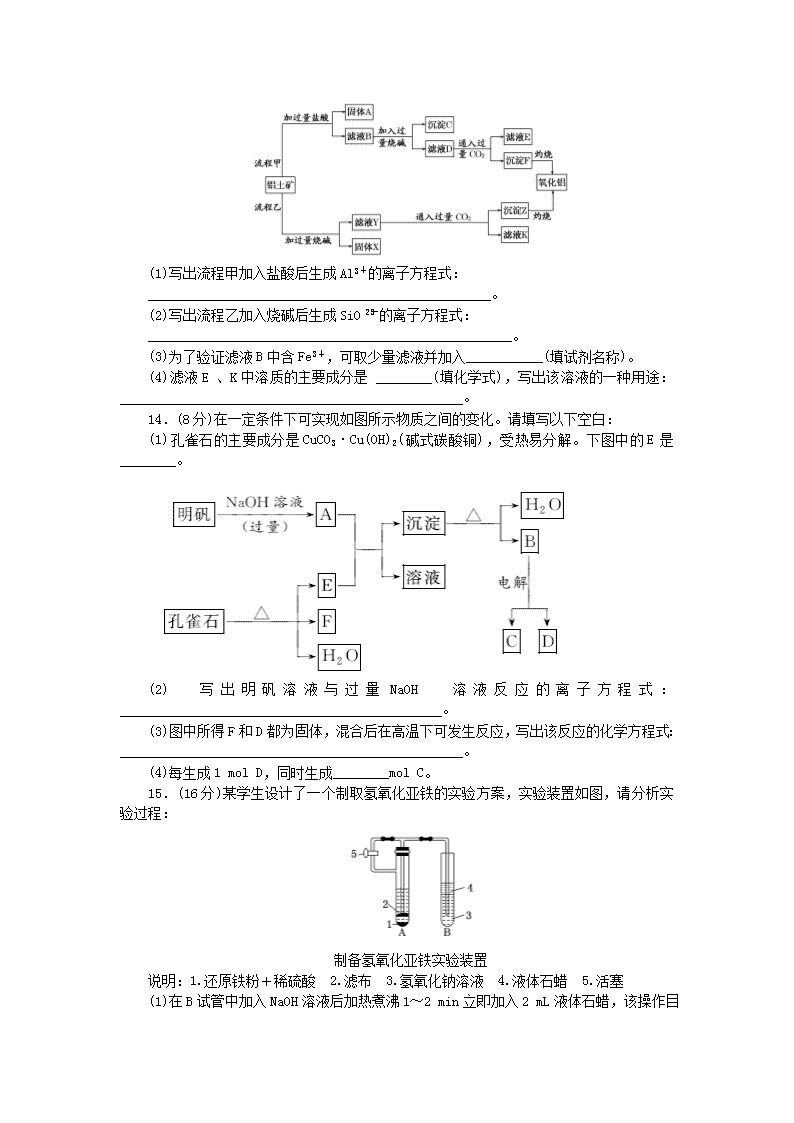
从矿物到基础材料(时间:60分钟,满分:100分)一、选择题(本题包括12小题,每小题4分,共48分)1.下列说法中正确的是( )A.硅是人类将太阳能转变为电能的常用材料B.工业上镁的制备是电解熔融MgOC.铝热法制铁适用于野外小范围操作,生物炼铜已经大规模用于铜的生产中D.海水的各种化学资源的开发过程,必须都要发生化学反应2.下列关于硅酸的说法正确的是( )A.硅酸可以通过SiO2和水的化合反应直接制得B.用反应Na2SiO3+2HCl===2NaCl+H2SiO3↓制取硅酸是利用了可溶性酸制难溶性酸的原理C.因为硅酸难溶于水,所以它不能与NaOH溶液反应D.硅胶可用作袋装食品的干燥剂3.下列反应产物的颜色按红色、红褐色、黑色、蓝色顺序排列的是( )①金属铁在纯氧中燃烧 ②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间 ③NaOH溶液中滴入酚酞 ④无水硫酸铜放入医用酒精中A.②③①④ B.③②①④C.③①②④D.①②③④4.某溶液既能溶解Al(OH)3,又能溶解Al2O3,但不能溶解Fe,在该溶液中可以大量共存的是( )A.K+、Na+、HCO、NOB.Mg2+、K+、NO、Na+C.H+、Zn2+、SO、NOD.Na+、SO、Cl-、S2-5.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有( )A.Cu、Fe3+B.Fe2+、Fe3+C.Cu、Cu2+、FeD.Cu、Fe2+、Fe6.向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴溴水后,混合液出现血红色。那么,由此得出下列的结论错误的是( )A.该晶体中一定含有SCN-B.Fe3+的氧化性比Br2的氧化性强C.Fe2+被Br2氧化为Fe3+D.Fe2+与SCN-不能形成血红色的化合物7.向MgSO4和Al2(SO4)3的混合溶液中逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )8.下表各组物质中,满足如图物质一步转化关系的选项是( )n选项XYZANaNaOHNaHCO3BCuCuSO4Cu(OH)2CCCOCO2DSiSiO2H2SiO39.用一种试剂可以检验一组物质,能达到实验目的的是( )选项试剂被检验物质组A氨水AlCl3溶液、MgCl2溶液、FeCl3溶液、NaOH溶液B水CuSO4、Na2CO3、Ca(OH)2、CaCl2固体C盐酸Al(OH)3、Mg(OH)2、Fe(OH)2、Ca(OH)2DNaOH溶液CuO、Fe3O4、MgO、Al2O310.蛇纹石由MgO、Al2O3、SiO2、Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述不正确的是( )A.沉淀X的成分是SiO2B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2D.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+11.一粗铝样品中含铁和硅两种杂质,取等质量的样品分别投入到足量的盐酸和足量的稀氢氧化钠溶液中,放出等量的氢气,则该粗铝中铁和硅的关系正确的是( )①物质的量之比为2∶1 ②物质的量之比为3∶1③质量之比为2∶1④质量之比为4∶1A.②④B.②③C.①④D.④12.某溶液中含有Fe3+、Mg2+、Fe2+和Al3+四种金属离子,若向其中加入过量的NaOH溶液,充分搅拌后,再加入过量的稀盐酸。则溶液中大量减少的金属离子是( )A.Fe3+ B.Mg2+C.Fe2+D.Al3+二、非选择题(本题包括4小题,共52分)13.(14分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:n(1)写出流程甲加入盐酸后生成Al3+的离子方程式:_________________________________________________。(2)写出流程乙加入烧碱后生成SiO的离子方程式:____________________________________________________。(3)为了验证滤液B中含Fe3+,可取少量滤液并加入___________(填试剂名称)。(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶液的一种用途:_________________________________________________。14.(8分)在一定条件下可实现如图所示物质之间的变化。请填写以下空白:(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。下图中的E是________。(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:______________________________________________。(3)图中所得F和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:_________________________________________________。(4)每生成1molD,同时生成________molC。15.(16分)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置如图,请分析实验过程:制备氢氧化亚铁实验装置说明:1.还原铁粉+稀硫酸 2.滤布 3.氢氧化钠溶液 4.液体石蜡 5.活塞(1)在B试管中加入NaOH溶液后加热煮沸1~2min立即加入2nmL液体石蜡,该操作目的是_______________________________。(2)在具支试管A中加入稀硫酸和略微过量的铁粉,铁粉过量的原因是__________________________________________。(3)连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为_________________________,原因是_____________________________。B试管中的现象为_______________________________。(4)写出此过程中所涉及的离子方程式:①________________________________________________________________________;②________________________________________________________________________;③________________________________________________________________________。(5)若制备的Fe(OH)2不小心接触空气,你会看到的溶液现象是________________,涉及的化学方程式为___________________________。16.(14分)含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成含A元素的化合物D。(1)易与C发生化学反应的酸是________,反应的化学方程式是____________________________________________________。(2)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E;将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F。①写出生成D和F的化学反应方程式:____________________________,____________________________。②要将纯碱高温熔化,下列坩埚中可选用的是________。A.普通玻璃坩埚B.石英玻璃坩埚C.瓷坩埚D.铁坩埚(3)100gC与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2L,100g混合物中石灰石的质量分数是________。阶段质量检测(三)1.选A B项,镁的制备是电解熔融的MgCl2,MgO熔点更高,熔化消耗能量更多;C项,生物炼铜在铜的生产中所占比例较少;D项,海水晒盐和海水的淡化不需要发生化学反应。2.选D SiO2不溶于水也不与水反应,A项错误;B项错误,此反应是利用了“强酸制弱酸”的原理;硅酸虽难溶于水,但可与强碱溶液反应生成硅酸盐,C项错误。3.选B Fe3O4(黑色)、Fe(OH)3(红褐色)、碱液中加入酚酞(红色)、CuSO4·5H2O(蓝色)。4.选D 某溶液能溶解Al(OH)3和Al2O3,溶液可能呈酸性或碱性,但不能溶解铁,溶液只能为碱性。A项中HCO,B项中Mg2+,C项中H+均不能在碱性溶液中存在,故选D。5.选D 因Fe较Cu活泼,可发生反应Fe+Cu2+===Fe2++Cu,Fe+2Fe3+===3Fe2+,当Fe有剩余时,溶液中不可能存在Fe3+、Cu2+,故容器中含有Cu、Fe2+、Fe,D项正确。6.选B 混合液出现血红色说明有Fe(SCN)3生成,从而推知晶体中一定含有SCN-,Fe2+被Br2氧化为Fe3+,Fe3+的氧化性比Br2的氧化性弱。7.选D MgSO4和NaOH反应生成Mg(OH)2沉淀,Al2(SO4)3和NaOH反应生成Al(OH)3沉淀,逐滴加入NaOH溶液,沉淀量逐渐增加,前一段图像一直上升,继续添加NaOH溶液,由于Al(OH)3溶解,沉淀消失一部分,然后保持不变。剩下Mg(OH)2沉淀。8.选C 本题考查元素化合物,意在考查考生对常见金属和非金属元素及其化合物相互转化的理解和分析能力。NaHCO3不能一步转化为Na,A项错误;Cu(OH)2n不能一步转化为Cu,B项错误;根据CCOCO2C知,C项正确;H2SiO3不能一步转化为Si,D项错误。9.选A FeCl3溶液呈棕黄色,其余无色溶液中加入氨水产生两种白色沉淀:Al(OH)3、Mg(OH)2,无现象的是NaOH溶液,利用NaOH溶液检验Mg(OH)2和Al(OH)3,A项正确;水能将CuSO4检验出来,Na2CO3、Ca(OH)2分别与CuSO4产生蓝色沉淀,无法区别,B项不正确;盐酸与Fe(OH)2反应生成FeCl2,溶液呈浅绿色,其他无色,不能检验其他物质,C项错误;NaOH溶液只能将Al2O3检验出来,MgO白色,其他物质不能检验出来,D项错误。10.选B 向蛇纹石试样中加入过量的盐酸,其中的MgO、Al2O3、Fe2O3溶解形成含Mg2+、Al3+、Fe3+和H+的溶液Y,而SiO2不溶解形成沉淀X,溶液Y中加入过量NaOH溶液,将得到Fe(OH)3和Mg(OH)2沉淀,所以A、C和D选项正确;将蛇纹石试样直接溶于过量的NaOH溶液,其中的Al2O3和SiO2溶解形成AlO和SiO,而MgO和Fe2O3不溶解形成沉淀,故B项不正确。11.选C 解法1:根据化学方程式分析设反应中Si、Fe反应产生的氢气的物质的量均为a,则Fe+2HCl===FeCl2+H2↑a aSi+2NaOH+H2O===Na2SiO3+2H2↑ an(Fe)∶n(Si)=a∶=2∶1,m(Fe)∶m(Si)=(56×2)∶(28×1)=4∶1。故①、④是合理的。解法2:根据氧化还原反应中电子的转移关系进行分析。在铁与盐酸的反应中:1molFe1molFeCl2,产生1molH2。在硅与氢氧化钠溶液的反应中:1molSi1molNa2SiO3,产生2molH2。若产生等量的氢气,Fe和Si在反应中失去的电子数应相等,因此,物质的量之比应为n(Fe)∶n(Si)=2∶1,质量之比为m(Fe)∶m(Si)=(56×2)∶(28×1)=4∶1。12.选C Fe3+的变化过程:Fe3+→Fe(OH)3→Fe3+;Mg2+的变化过程:Mg2+→Mg(OH)2→Mg2+;Fe2+的变化过程:Fe2+→Fe(OH)2→Fe(OH)3→Fe3+;Al3+的变化过程:Al3+→AlO→Al3+。13.解析:本题考查铝土矿中氧化铝提取的工艺流程。铝土矿中的成分能与HCl反应的有Al2O3、Fe2O3、MgO,不反应的是SiO2,所以固体A为SiO2,滤液B中有Al3+、Fe3+、Mg2+,再加入过量烧碱,Al3++4OH-===AlO+2H2O,Fe3++3OH-===Fe(OH)3↓,Mg2++2OH-===Mg(OH)2↓,沉淀C为Fe(OH)3、Mg(OH)2混合物,滤液D为NaAlO2、NaOH(过量),NaAlO2能与CO2反应,NaAlO2+2H2O+CO2===Al(OH)3↓+NaHCO3,滤液E为NaHCO3,沉淀F为Al(OH)3,Al(OH)3灼烧得到Al2O3。铝土矿中能与NaOH溶液反应的有Al2O3、SiO2,其余均不反应,所以固体X为Fe2O3、MgO,Al2O3+2NaOH===2NaAlO2+H2O,SiO2+2NaOH===Na2SiO3+H2O。答案:(1)Al2O3+6H+===2Al3++3H2On(2)SiO2+2OH-===SiO+H2O(3)硫氰化钾(或硫氰酸钾溶液等合理答案均可)(4)NaHCO3 制纯碱(或做发酵粉等合理答案均可)14.解析:明矾与过量NaOH溶液反应生成AlO,与孔雀石分解生成的CO2反应生成沉淀Al(OH)3,即为E,B到C和D的化学方程式为2Al2O34Al+3O2↑。由此可知每生成1molD,同时生成0.75molC。答案:(1)CO2(2)Al3++4OH-===AlO+2H2O(3)3CuO+2AlAl2O3+3Cu (4)0.7515.解析:Fe(OH)2有很强的还原性,极易被空气中的氧气氧化成Fe(OH)3,所以在制备时,一定要隔绝氧气。答案:(1)除去溶解在NaOH溶液中的O2,防止O2再进入(2)保证溶液中不存在Fe3+(3)A试管中溶液经导管压入B试管 生成的H2产生了压力 产生白色沉淀(4)①Fe+2H+===Fe2++H2↑②Fe2++2OH-===Fe(OH)2↓③Fe+2Fe3+===3Fe2+(5)白色沉淀迅速变为灰绿色,最后变为红褐色 4Fe(OH)2+O2+2H2O===4Fe(OH)316.解析:(1)C为SiO2,能与SiO2反应的酸只有氢氟酸。(2)SiO2与Na2CO3高温下反应生成Na2SiO3和CO2,故含SiO2的材料(普通玻璃、石英玻璃)都能与Na2CO3在高温下反应,故不能用以上材质的坩埚熔融Na2CO3。(3)若SiO2恰好或过量与CaCO3反应的方程式只有一个,即CaCO3+SiO2CaSiO3+CO2↑。若CaCO3过量,除发生上述反应外,还会发生反应:CaCO3CaO+CO2↑。总之,CaCO3的多少决定了CO2的产量,可通过以下关系式列式求解:CaCO3 ~ CO2100g 22.4Lm(CaCO3) 11.2Lm(CaCO3)=50g。混合物中CaCO3的质量分数:×100%=50%。答案:(1)氢氟酸(HF)SiO2+4HF===SiF4↑+2H2O(2)①SiO2+Na2CO3Na2SiO3+CO2↑ Na2SiO3+CO2+H2O===Na2CO3+H2SiO3↓ ②D (3)50%n查看更多