- 2022-04-09 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019高中化学第二章化学反应的方向、限度与速率2.4化学反应条件的优化——工业合成氨精练鲁科版
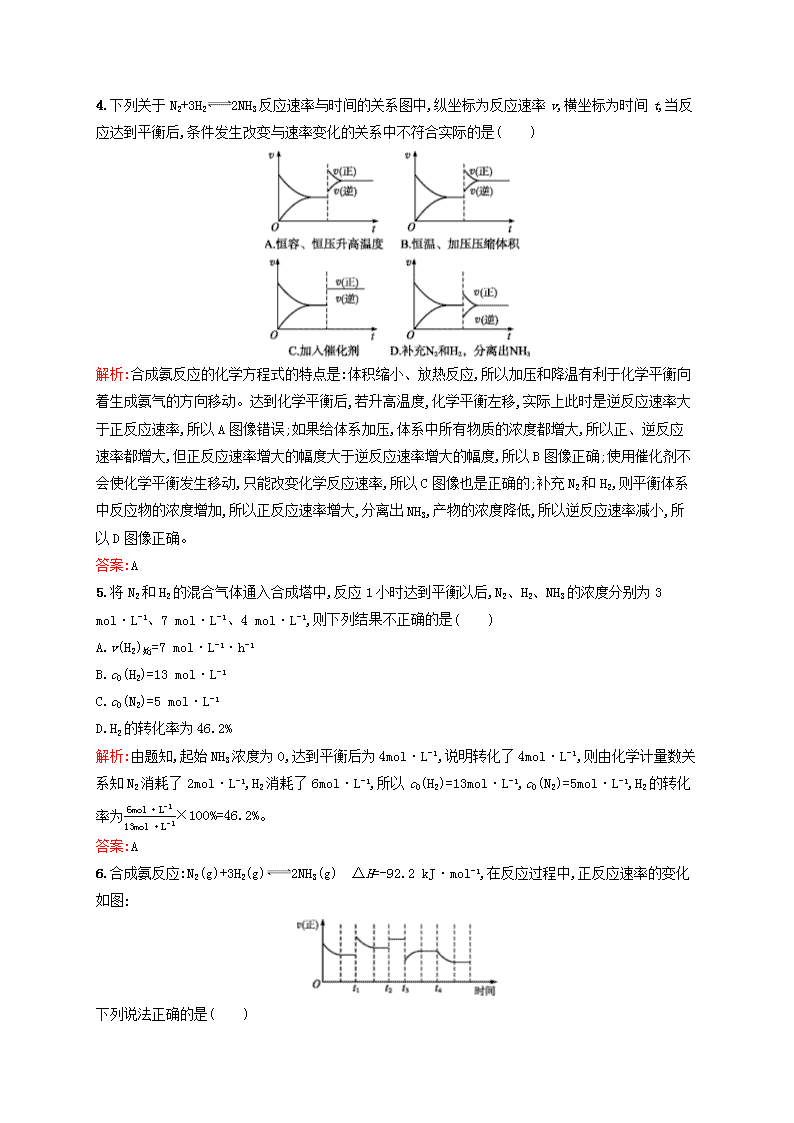
化学反应条件的优化——工业合成氨A组 1.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )A.①②③B.②④⑤C.①③⑤D.②③④解析:合成氨反应为N2(g)+3H2(g)2NH3(g) ΔH<0,加压、降温、减小NH3的浓度均有利于平衡向正反应方向移动,②④正确;将原料气循环利用也可提高原料的转化率,⑤正确。答案:B2.下列说法能够用勒·夏特列原理来解释的是( )A.加入催化剂可以提高单位时间氨的产量B.高压有利于氨的合成反应C.700K高温比室温更有利于合成氨的反应D.恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多解析:A项中加入催化剂只能加快反应速率,缩短到达平衡的时间,提高“单位时间”的产量,不能使化学平衡发生移动。B项中合成氨是一个气态物质系数减小的反应,所以增大压强,使平衡向正方向移动,有利于合成氨,符合勒·夏特列原理。C项中因为合成氨是一个放热反应,所以从化学平衡移动角度分析,应采用较低温度。700K高温较室温不利于平衡向合成氨方向移动。采用700K既考虑到温度对速率的影响,更主要的是700K左右催化剂活性最大。D项中恒温恒容下充He,稀有气体He不与N2、H2、NH3反应。虽总压强增大了,实际上平衡体系各成分浓度不变(即分压不变),所以平衡不移动,NH3的产量不变。答案:B3.将aLNH3通过灼热的装有铁催化剂的硬质玻璃管后,气体体积变为bL(气体体积均在同温同压下测定)。该bL气体中NH3的体积分数是( )A.2a-baB.b-abC.2a-bbD.b-aa解析:2NH3N2+3H2 ΔV213 2可见,分解的氨的体积:(b-a)L,则剩余氨的体积:aL-(b-a)L=(2a-b)L,该bL气体中NH3的体积分数是2a-bb。答案:Cn4.下列关于N2+3H22NH3反应速率与时间的关系图中,纵坐标为反应速率v,横坐标为时间t,当反应达到平衡后,条件发生改变与速率变化的关系中不符合实际的是( )解析:合成氨反应的化学方程式的特点是:体积缩小、放热反应,所以加压和降温有利于化学平衡向着生成氨气的方向移动。达到化学平衡后,若升高温度,化学平衡左移,实际上此时是逆反应速率大于正反应速率,所以A图像错误;如果给体系加压,体系中所有物质的浓度都增大,所以正、逆反应速率都增大,但正反应速率增大的幅度大于逆反应速率增大的幅度,所以B图像正确;使用催化剂不会使化学平衡发生移动,只能改变化学反应速率,所以C图像也是正确的;补充N2和H2,则平衡体系中反应物的浓度增加,所以正反应速率增大,分离出NH3,产物的浓度降低,所以逆反应速率减小,所以D图像正确。答案:A5.将N2和H2的混合气体通入合成塔中,反应1小时达到平衡以后,N2、H2、NH3的浓度分别为3mol·L-1、7mol·L-1、4mol·L-1,则下列结果不正确的是( )A.v(H2)始=7mol·L-1·h-1B.c0(H2)=13mol·L-1C.c0(N2)=5mol·L-1D.H2的转化率为46.2%解析:由题知,起始NH3浓度为0,达到平衡后为4mol·L-1,说明转化了4mol·L-1,则由化学计量数关系知N2消耗了2mol·L-1,H2消耗了6mol·L-1,所以c0(H2)=13mol·L-1,c0(N2)=5mol·L-1,H2的转化率为6mol·L-113mol·L-1×100%=46.2%。答案:A6.合成氨反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.2kJ·mol-1,在反应过程中,正反应速率的变化如图:下列说法正确的是( )nA.t1时升高了温度B.t2时使用了催化剂C.t3时增大了压强D.t4时降低了温度解析:若t1时升高了温度,则随后v(正)应增大至平衡,A错;若t3时增大了压强,v(正)应增大,而不会减小,故C错;若t4时降低了温度,则v(正)应突然减小,曲线不应相连,D错。答案:B7.高温下,某反应达平衡,平衡常数K=[CO][H2O][CO2][H2]。恒容时,温度升高,H2浓度减小。下列说法正确的是( )A.该反应的焓变为正值B.恒温恒容下,增大压强,H2浓度一定减小C.升高温度,逆反应速率减小D.该反应化学方程式为CO+H2OCO2+H2解析:由平衡常数表达式写出可逆反应为CO2(g)+H2(g)CO(g)+H2O(g),D项错误;由于升高温度,H2浓度减小,说明升温平衡正向进行,因此正反应是吸热反应,焓变为正值,A项正确;由于反应前后气态物质系数相等,增大压强平衡不移动,但若通入H2其浓度会增大,B项错误;升高温度,正逆反应速率都会增大,C项错误。答案:A8.一定条件下,在密闭容器中,通入N2、H2进行N2(g)+3H2(g)2NH3(g) ΔH<0,下列叙述正确的是( )A.充分反应后,密闭容器中N2和H2至少有1种物质的浓度为零B.使用适宜的催化剂,可以加快反应速率C.增加H2的浓度或降低温度,都会加快正反应速率D.反应达平衡后,减小容器的体积,H2的浓度不变解析:由可逆反应定义可知A错误;降低温度,反应速率降低,C错误;减小反应容器的体积,不论平衡向哪个方向移动,各物质的浓度均增大,D错误。答案:B9.在450℃时,N2(g)+3H2(g)2NH3(g) ΔH<0,体系中只改变下列条件,请把影响结果填入表中。改变条件正反应速率逆反应速率平衡移动N2的转化率(1)增大N2的浓度n(2)增大NH3的浓度(3)减小NH3的浓度(4)压缩体积增大压强(5)升高温度(6)加入催化剂(7)体积不变充入氖气答案:(1)增大 增大 正向移动 减小(2)增大 增大 逆向移动 减小(3)减小 减小 正向移动 增大(4)增大 增大 正向移动 增大(5)增大 增大 逆向移动 减小(6)增大 增大 不移动 不变(7)不变 不变 不移动 不变10.红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0(Na2CrO4在一定条件下可转化为Na2Cr2O7)(1)请写出上述反应的化学平衡常数表达式:K= 。 (2)图1、图2表示上述反应在t1时达到平衡、在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是 (用文字表达);由图2判断,t2到t3的曲线变化的原因可能是 (填写序号)。 A.升高温度B.加入催化剂C.通入O2D.缩小容器体积n解析:(1)根据K的书写要求,固体和纯液体不出现在平衡常数表达式中,所以K=[CO2]8[O2]7。(2)t2时刻,CO2、O2浓度均未发生变化,既不能继续通入CO2、O2,也不能改变容器体积,则外界条件只能是改变温度,且CO2浓度增大,O2浓度减小,说明改变温度时平衡正向移动,分析反应知降低温度,平衡正向(即放热方向)移动;t2到t3时刻,平衡没有发生移动,但是v变大,由此确定使用了催化剂。答案:(1)[CO2]8[O2]7(2)对平衡体系降温,平衡正向移动,CO2浓度增大,O2浓度减小 BB组 1.在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积分数为25%。若反应前后条件保持不变,则反应后缩小的气体体积与原反应物体积的比值是( )A.15B.14C.13D.12解析:设起始时H2的物质的量为a,N2的物质的量为b,平衡时NH3的物质的量为x。 3H2+ N2 2NH3 ΔV起始/molab0平衡/mola-3x2b-x2xx因为在相同条件下,气体的物质的量之比等于体积之比,据题意,可得方程:x(a-3x2)+(b-x2)+x=0.25,化简得xa+b=15,故A项正确。答案:A2.工业合成氨的正反应是放热反应,下列关于N2(g)+3H2(g)2NH3(g)反应的图像中,错误的是( )n解析:合成氨的正反应是放热反应,升高温度正、逆反应速率都增大,但逆反应速率增大的程度大,A正确;在T1时φ(NH3)最大,达到平衡,再升高温度,平衡逆向移动,φ(NH3)减小,B正确,C错误;增大压强,平衡正向移动,φ(NH3)增大,D正确。答案:C3.合成氨反应达到平衡时NH3的体积分数与温度、压强的关系如下图所示。根据此图分析合成氨工业最有前途的研究方向是( )A.提高分离技术B.研制耐高压的合成塔C.研制低温催化剂D.探索不用N2和H2合成氨的新途径解析:由图可知:φ(NH3)随着温度的升高而显著下降,故要提高φ(NH3),必须降低温度,但目前所用催化剂活性最好时的温度为700K,故最有前途的研究方向为研制低温催化剂。答案:C4.下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。达到平衡时混合物中NH3的含量(体积分数)[入料V(N2)∶V(H2)=1∶3] 压强/MPaNH3的 含量/% 温度/℃ 0.11020306010020015.381.586.489.995.498.83002.252.064.271.084.292.64000.425.138.247.065.279.85000.110.619.126.442.257.5n6000.054.59.113.823.131.4(1)比较200℃和300℃时的数据,可判断升高温度,平衡 (填“正”或“逆”)向移动,正反应方向为 (填“吸热”或“放热”)反应。 (2)根据平衡移动原理,合成氨适宜的条件是 。 A.高温高压 B.高温低压C.低温高压D.低温低压(3)计算500℃、30MPa时N2的转化率 。 (4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。 解析:(1)由表中数据可以看出,在0.1MPa下,200℃NH3的含量比300℃NH3的含量高,故知升高温度平衡逆向移动,进而根据平衡移动原理判断出正反应方向为放热反应。(2)由表中数据知,在相同压强下,温度越高,NH3的含量越低;相同温度时,压强越大,NH3的含量越高,故合成氨适宜条件是低温高压。(3) N2+ 3H22NH3起始/mol 1 3 0转化/mol n 3n 2n平衡/mol 1-n 3-3n 2n2n(1-n)+(3-3n)+2n×100%=26.4%n=0.4177故N2的转化率为0.41771×100%=41.77%。答案:(1)逆 放热(2)C(3)41.77%(4)加入过量的N2(或及时从平衡混合物中移走NH3)5.2014年11月11日至14日,全国化工合成氨设计技术中心站2014年技术交流会在贵州省贵阳市召开,会议组织观摩考察了贵州开阳化工有限公司年产50万吨合成氨装置。工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.2kJ·mol-1,其部分工艺流程如图所示:反应体系中各组分的部分性质见下表:n气体氮气氢气氨熔点/℃-210.01-252.77-77.74沸点/℃-195.79-259.23-33.42回答下列问题:(1)写出该反应的化学平衡常数表达式:K= 。 随着温度升高,K值 (填“增大”“减小”或“不变”)。 (2)K值越大,表明 (填字母)。 A.其他条件相同时N2的转化率越高B.其他条件相同时NH3的产率越大C.原料中N2的含量越高D.化学反应速率越快(3)在工业上采取气体循环的流程,即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。 解析:(1)由化学方程式N2(g)+3H2(g)2NH3(g)不难写出:K=[NH3]2[N2][H2]3,此反应ΔH<0,说明正反应为放热反应,升高温度,平衡向吸热方向移动,即向左移动,K减小。(2)K值越大,说明[NH3]越大,[N2]和[H2]就越小,说明反应进行的程度大,故其他条件相同时N2的转化率就越高,NH3的产率就越大。(3)根据气体的熔、沸点可知,氨气容易液化,使其分离可使平衡正向移动,剩余N2和H2循环使用,以提高产率。答案:(1)[NH3]2[N2][H2]3 减小 (2)AB (3)-33.42℃ 氨 N2和H26.工业上合成氨的反应为N2(g)+3H2(g)2NH3(g) ΔH=-92.2kJ·mol-1。(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g)2NH3(g),下列说法能说明上述反应向正反应方向进行的是 (填序号)。 ①单位时间内生成2nmolNH3的同时生成3nmolH2②单位时间内生成6nmolN—H键的同时生成2nmolH—H键③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2n④混合气体的平均摩尔质量增大⑤容器内的气体密度不变(2)某温度下,合成氨反应在容积为2L的密闭容器中进行,测得如下数据: 时间/h物质的量/mol 01234N21.50n11.20n31.00H24.504.203.60n43.00NH300.20n21.001.00根据表中数据计算:①反应进行到2h时放出的热量为 kJ。 ②0~1h内N2的平均反应速率为 mol·L-1·h-1。 ③此温度下该反应的化学平衡常数K= (保留两位小数)。 ④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将 (填“正”或“逆”)向移动。 解析:(1)①所述反应达到平衡状态;②生成2molNH3的同时生成2molH2,正反应速率大于逆反应速率,反应正向进行;③未指明各物质表示的化学反应速率是正反应速率还是逆反应速率,无法判断;④混合气体的平均摩尔质量增大,说明气体的物质的量减小,反应正向进行;⑤因为容积固定,所以密度始终保持不变。(2)①2h时消耗N2的物质的量为1.50mol-1.20mol=0.30mol,由热化学方程式可知,该反应放出的热量为92.2kJ·mol-1×0.30mol=27.66kJ。n②v(N2)=12v(NH3)=12×0.20mol2L×1h=0.05mol·L-1·h-1。③由表中数据可知,第3、4h时反应已达到平衡状态,故N2、H2、NH3的平衡浓度分别为0.50mol·L-1、1.50mol·L-1、0.50mol·L-1,故平衡常数K=(0.50mol·L-1)20.50mol·L-1×(1.50mol·L-1)3≈0.15(mol·L-1)-2。④向平衡体系中再加入N2、H2、NH3各1.00mol后,平衡发生移动前,N2、H2、NH3的浓度分别为1.00mol·L-1、2.00mol·L-1、1.00mol·L-1,此时Q=(1.00mol·L-1)21.00mol·L-1×(2.00mol·L-1)3查看更多
相关文章
- 当前文档收益归属上传用户