- 2021-11-11 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年广东省阳江市中考化学试卷【含答案;word版本;可再编辑】
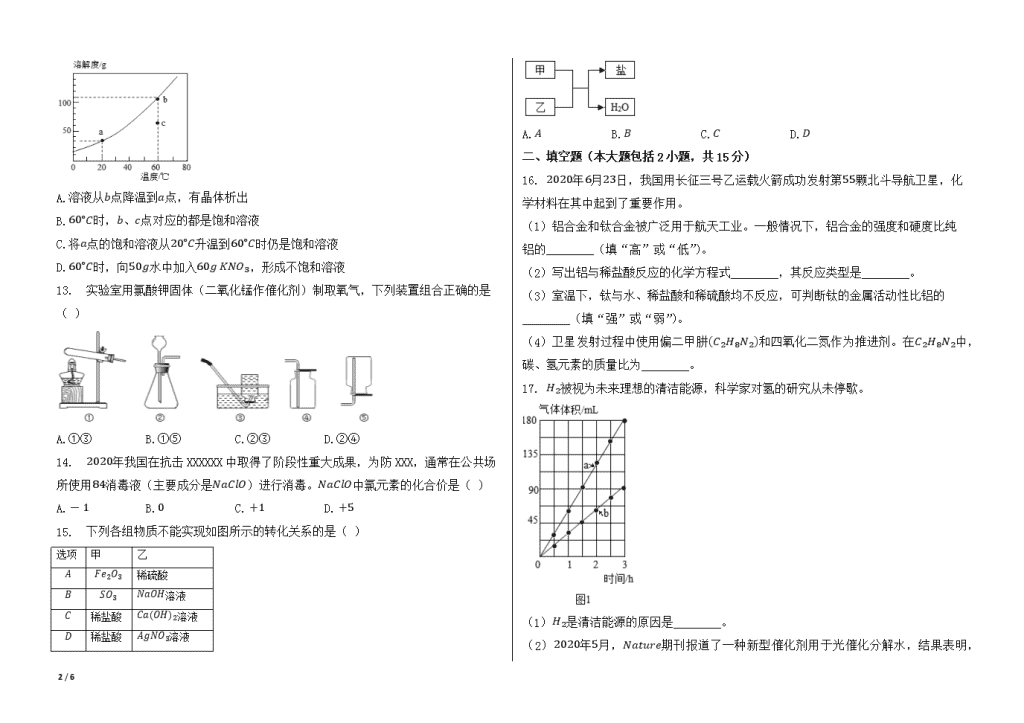
2020年广东省阳江市中考化学试卷 一、选择题(本大题包括15小题,每小题3分,共45分。在每小题列出的四个选项中,只有一个是正确的。请将答题卡上对应题目所选的选项涂黑) 1. 下列过程发生了化学变化的是( ) A.冰雪融化 B.汽油挥发 C.大米酿酒 D.玻璃破碎 2. 下列广东美食中富含淀粉的是( ) A.客家豆腐 B.广式腊肠 C.深井烧鹅 D.陈村米粉 3. 酒精运输车合适位置应张贴的标志是( ) A. B. C. D. 4. 下列物质属于空气污染物的是( ) A.氧气 B.氮气 C.水蒸气 D.二氧化硫 5. Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于( ) A.氧化物 B.盐 C.有机物 D.混合物 6. 公园里能闻到花香,合理的解释是( ) A.分子体积变大 B.分子在不断运动 C.分子数目变多 D.分子发生了分解 7. 合成材料的应用与发展,大大方便了人类的生活。下列物品是用有机合成材料制作的是( ) A.塑料桶 B.纯羊毛衫 C.铅笔芯 D.青铜铸像 8. 稀土有“工业的维生素”的美誉。钇是一种重要的稀土元素,下列说法中错误的是( ) A.钇属于金属元素 B.钇的原子序数是39 C.钇的相对原子质量是88.91克 D.钇原子的核外电子数为39 9. 下列除杂方法正确的是( ) 选项 物质(括号内为杂质) 方法 A K2CO3溶液(K2SO4) 加BaCl2溶液,过滤 B N2(O2) 将气体通过灼热的铜网 C NaOH溶液(Na2CO3) 加入稀硫酸 D ZnSO4溶液(CuSO4) 加入过量的铁粉,过滤 A.A B.B C.C D.D 10. 化学与生产、生活密切相关,下列说法错误的是( ) A.人体缺碘会引起贫血 B.碳酸氢铵(NH4HCO3)是一种氮肥 C.炒菜时油锅着火,用锅盖盖灭 D.铁制品表面刷漆可防止生锈 11. 将20g KOH加入100g水中,配制成溶液。下列说法错误的是( ) A.KOH在水中解离出K+和OH- B.一个K+带一个单位正电荷 C.该溶液的溶质质量分数为20% D.向该溶液中滴入酚酞指示剂,溶液变红 12. 如图是KNO3的溶解度曲线,下列说法正确的是( ) 6 / 6 A.溶液从b点降温到a点,有晶体析出 B.60∘C时,b、c点对应的都是饱和溶液 C.将a点的饱和溶液从20∘C升温到60∘C时仍是饱和溶液 D.60∘C时,向50g水中加入60g KNO3,形成不饱和溶液 13. 实验室用氯酸钾固体(二氧化锰作催化剂)制取氧气,下列装置组合正确的是( ) A.①③ B.①⑤ C.②③ D.②④ 14. 2020年我国在抗击XXXXXX中取得了阶段性重大成果,为防XXX,通常在公共场所使用84消毒液(主要成分是NaClO)进行消毒。NaClO中氯元素的化合价是( ) A.-1 B.0 C.+1 D.+5 15. 下列各组物质不能实现如图所示的转化关系的是( ) 选项 甲 乙 A Fe2O3 稀硫酸 B SO3 NaOH溶液 C 稀盐酸 Ca(OH)2溶液 D 稀盐酸 AgNO3溶液 A.A B.B C.C D.D 二、填空题(本大题包括2小题,共15分) 16. 2020年6月23日,我国用长征三号乙运载火箭成功发射第55颗北斗导航卫星,化学材料在其中起到了重要作用。 (1)铝合金和钛合金被广泛用于航天工业。一般情况下,铝合金的强度和硬度比纯铝的________(填“高”或“低”)。 (2)写出铝与稀盐酸反应的化学方程式________,其反应类型是________。 (3)室温下,钛与水、稀盐酸和稀硫酸均不反应,可判断钛的金属活动性比铝的________(填“强”或“弱”)。 (4)卫星发射过程中使用偏二甲肼(C2H8N2)和四氧化二氮作为推进剂。在C2H8N2中,碳、氢元素的质量比为________。 17. H2被视为未来理想的清洁能源,科学家对氢的研究从未停歇。 (1)H2是清洁能源的原因是________。 (2)2020年5月,Nature 6 / 6 期刊报道了一种新型催化剂用于光催化分解水,结果表明,水分解生成的两种气体的体积与时间的关系如图1所示,其中表示氢气的是________(填“a”或“b”)。 (3)2020年5月,科学家在Science期刊上首次报道了原子与分子的“最简单”反应存在两种路径,并用先进技术手段拍下了该反应的影像资料,其中一种路径的简化示意图如图2所示。 此“最简单”反应中,表示H原子,表示D原子。D原子核中有________个质子,此反应中涉及的元素种类有________种。该反应可表示为:H+________→H2+________。 三、(本大题包括2小题,共20分) 18. 实验室对含有MgCl2的粗盐进行提纯,步骤如图: (1)步骤①中,称量5.0g粗盐需补充的主要仪器是________。 (2)步骤②中,玻璃棒的作用是________。 (3)步骤③中,滴加过量NaOH溶液除去MgCl2,反应的化学方程式是________。 (4)步骤⑤中,为中和过量的NaOH,应滴加的“试剂a”是( )(填字母)。 A.稀盐酸 B.稀硫酸 C.稀硝酸 (5)步骤⑥的操作名称是________,当________时,停止加热。 19. 某兴趣小组在学习碳(C)的化学性质时,了解到高温下C与CuO反应生成CO2,C还能使CO2转变成CO.于是对过量木炭还原CuO的气体产物中是否含有CO进行了探究。 【猜想与假设】C还原CuO时产生的CO2与C进一步反应生成CO,化学方程式是 CO2+C2CO 。 【查阅资料】CO不与NaOH、Ca(OH)2及H2SO4反应。 【实验方案】取研细和干燥后的木炭(0.3g)和CuO(2.0g),混合均匀并装入试管,连接装置,高温反应, 检验气体。 【实验过程】 (1)由如图装置③中粉末的颜色变化可检验CO,除此之外,还可通过几种装置的组合,由另一种明显的现象来进一步确定CO的存在,则装置连接的最佳顺序为( )→尾气处理(填字母)。 A.①→②→③→④ B.④→①→②→③→① C.①→④→①→③→② D.③→④→①→② (2)上述进一步确定CO存在的现象是________(装置③中粉末的颜色变化除外)。 (3)装置③中发生反应的化学方程式是________。 (4)写出CO尾气处理的方法:________(一种即可)。 【实验结论】高温下,过量木炭还原CuO的气体产物中有CO。 【延伸应用】冬天,室内用炭火取暖时,应注意________。 四、(本大题包括1小题,共10分) 20. 某废酸液主要含H2SO4和FeSO4,研究人员利用CaCO3消耗部分酸,再加入廉价的电石渣(主要成分为CaO),通过一系列操作可得到磁性铁,成本较低且有利于保护环 6 / 6 境。工艺流程如图: (1)该废酸液的pH________7(填“<”或“>”)。操作Ⅰ的名称为________。 (2)电石渣转化为石灰乳的过程会________(填“吸收”或“放出”)热量。 (3)“沉铁”过程中,溶液中的FeSO4和石灰乳中的Ca(OH)2发生复分解反应,生成的产物是________和________(填化学式)。 (4)磁性铁是铁的一种氧化物,且为磁铁矿的主要成分,其化学式为________。 (5)研究发现,“沉铁”后,溶液的pH对磁性铁产率的影响如下表。欲获得高的产率,最适宜的pH为________,pH较低时产率较低的主要原因是________。 溶液的pH 6.0 6.5 7.0 7.5 8.0 9.0 产物颜色 黄褐色 黄褐色 较黑 很黑 很黑 灰黑色 产率(%) 43.9 50.6 86.2 93.0 92.3 91.6 五、(本大题包括1小题,共10分) 21. 某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图1所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图2所示。 实验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线 Ⅰ 3.4 10.0 a Ⅱ 2.4 10.0 b Ⅲ 1.7 10.0 c(待绘制) (1)实验前需准备不同浓度的H2O2溶液,若要配制100.0g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液________g。 (2)根据实验探究目的,从曲线a、b中,可得出的结论是________。 (3)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程(1.5-5.0% H2O2溶液的密度取值1.0g/mL)。 (4)在如图2中画出曲线c的大致位置及趋势。 6 / 6 参考答案与试题解析 2020年广东省阳江市中考化学试卷 一、选择题(本大题包括15小题,每小题3分,共45分。在每小题列出的四个选项中,只有一个是正确的。请将答题卡上对应题目所选的选项涂黑) 1.C 2.D 3.B 4.D 5.B 6.B 7.A 8.C 9.B 10.A 11.C 12.A 13.A 14.C 15.D 二、填空题(本大题包括2小题,共15分) 16.高 2Al+6HCl=2AlCl3+3H2↑,置换反应 弱 3:1 17.氢气燃烧的产物只有水,清洁无污染 a 1,1,HD,D 三、(本大题包括2小题,共20分) 18.托盘天平 搅拌,加快溶解速率 2NaOH+MgCl2=Mg(OH)2↓+2NaCl A 蒸发,蒸发皿中出现较多固体 19.B 经过③之后的澄清石灰水变浑浊 CO+CuO△Cu+CO2 增加点燃的酒精灯,通风 四、(本大题包括1小题,共10分) 20.<,过滤 放出 Fe(OH)2,CaSO4 Fe3O4 7.5,四氧化三铁能和酸反应 五、(本大题包括1小题,共10分) 21.8 过氧化氢溶液浓度越高,过氧化氢分解速率越快 0.16g。 6 / 6 。 6 / 6查看更多