- 2021-11-10 发布 |
- 37.5 KB |
- 52页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
人教版化学九年级下册题1常见的酸和碱优质
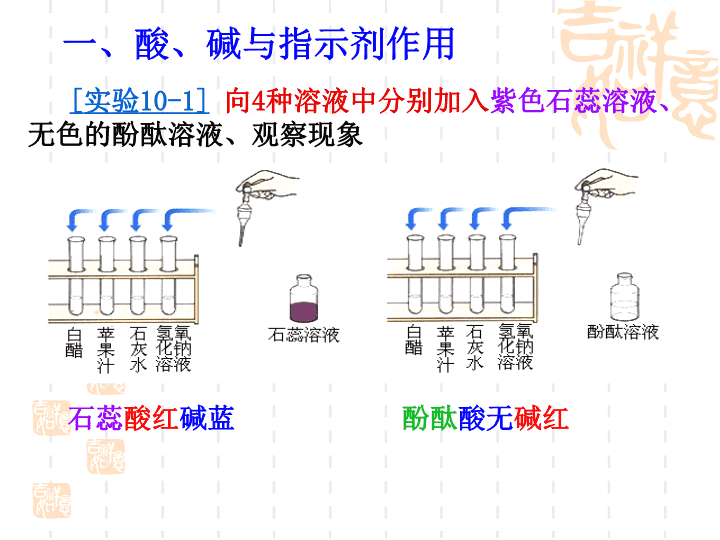
第十单元 酸和碱 课题 1 常见的酸和碱 课题 2 酸和碱的中和反应 实验活动 6 酸、碱的化学性质 实验活动 7 溶液酸碱性的检验 课题 1 常见的酸和碱 ( 第一课时 ) [ 实验 10-1] 向 4 种溶液中分别加入 紫色石蕊溶液、 无色的酚酞溶液、观察现象 一、酸、碱与指示剂作用 石蕊 酸红 碱蓝 酚酞 酸无 碱红 课 题 1 常 见 的 酸 和 碱 [ 实验 10-1] 加入紫色石蕊溶液后的 颜色变化 加入无色酚酞溶液后的 颜色变化 白 醋 苹果汁 石灰水 NaOH 溶液 变红色 变蓝色 变红色 变红色 变红色 变蓝色 不变色 不变色 结论: 1 、 酸能 使 紫色石蕊 溶液变成 红色 , 碱 能使无色的酚酞溶液变成 蓝色 (即 石蕊 酸红 碱蓝 ) 2 、酸不能使无色酚酞溶液变色 , 碱溶液使无色的酚酞溶液 变红色 (即 酚酞 酸无 碱 红 ) 酸碱指示剂 遇 酸性 溶液呈现颜色 遇 中性 溶液呈现颜色 遇 碱性 溶液呈现颜色 紫色 石蕊 溶液 红色 紫色 蓝色 无色 酚酞 溶液 无色 无色 红色 酸碱指示剂与酸中碱性溶液作用时显示的颜色: 酸性 溶液 酸 溶液 盐 溶液 碱性 溶液 碱 溶液 盐 溶液 课 题 1 常 见 的 酸 和 碱 1 、酸碱指示剂(指示剂)的概念 跟酸或碱的溶液起作用而显示 不同颜色 的物质。 2 、常用指示剂: 紫色石蕊溶液 和无色酚酞溶液 3 、变色规律 : 酸能使 紫色石蕊溶液 变成 红色 ,不能使 无色酚酞溶液变色;碱能使 紫色石蕊溶液 变成 蓝色,使 无色酚酞溶液溶液变成 红色 (即 石蕊 酸红 碱蓝、 酚酞 酸无 碱红 ) 4 、指示剂的作用 : 能检验溶液的酸碱性 5 、如何用酸碱指示剂检验溶液的酸碱性? 若溶液呈现 红色 ,则说明该溶液为 酸性 溶液。 取少量该溶液, 滴入几滴 紫色石蕊溶液 若溶液呈现 蓝色 ,则说明该溶液为 碱性 溶液。 自制指示剂原料 月季花 牵牛花 紫萝卜 美人焦 胡萝卜 紫包菜 自制酸碱指示剂 课 题 1 常 见 的 酸 和 碱 二、常见的酸 1 、几种常见的酸 [ 实验 10-2] ( 1 )观察盐酸、硫酸的颜色和状态 ( 2 )分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。 盐酸 (HCl) 硫酸 (H 2 SO 4 ) 颜色状态 打开瓶盖后的现象 气味 密度 常用浓盐酸 1.19g / cm 3 常用浓硫酸 1.84g / cm 3 无色液体 无色粘稠油状液体 瓶口有 白雾 无明显现象 有刺激性气味 无味 2. 用 途 ( P52 ) 盐 酸 HCl 重要化工产品。用于金属表面 除锈 、 制造药物 (如盐酸麻黄素、氯化锌)等; 人体胃液中 有 盐酸 ,可 帮助消化 。 硫 酸 H 2 SO 4 重要 化工原料 。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和 金属除锈 等。 浓硫酸有吸水性 ,在实验室中常用它 做 干燥剂 。 浓硫酸不能干燥碱性气体 氨气 ( NH 3 ) 课 题 1 常 见 的 酸 和 碱 2 、浓硫酸的腐蚀性 [ 实验 10-3] 将纸、小木棍、布放在 玻璃片上 做实验。 实 验 放置一会儿后的现象 原 理 用玻璃棒蘸浓硫酸在纸上写字 用小木棍蘸 少量浓硫酸 将浓硫酸滴到 一小块布上 纸上显出 黑色 字迹 蘸有硫酸的部位 变黑 滴有硫酸的部位 变黑 甚至烧成洞 浓硫酸有 强烈的腐蚀性, 能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭。 浓盐酸 浓硫酸 ↑ ↓ 稀释浓硫酸的方法 : [ 实验 10-4] 将浓硫酸沿烧杯壁缓慢地注入盛有水的 烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。 事故处理: (P53) 如果浓硫酸沾到皮肤或衣服上,应该怎么办? 立即用 大量水冲洗 ,然后涂上 3% ~ 5% 的 碳酸氢钠溶液 。 手的感觉 原因 发热或烫 浓硫酸溶于水 放出大量的热 散热 课 题 1 常 见 的 酸 和 碱 [ 实验 ] 将水注入到浓硫酸中 硫酸液滴向四周飞溅 再见 ! 课 题 1 常 见 的 酸 和 碱 课题 1 常见的酸和碱 (第二课时) 物质导电性 结论:不同的酸、碱却具有 相似 的 化学性质 的 原因 ?( P57 ) 1. 在不同的 酸溶液 中都含有相同的 H + ,因此 不同的 酸的化学性质是 相似 的。 2. 在不同的 碱溶液 中都含有相同的 OH - ,所以不同的碱也具有 相似 的化学性质。 3 、酸的化学性质 探究 ( 1 ) 酸溶液能与指示剂反应: 滴加紫色 石蕊溶液 滴加无色 酚酞溶液 稀盐酸 稀硫酸 变红色 变红色 不变色 不变色 结论 : 酸能使 紫色石蕊溶液 变成红色,不能使 无色 酚酞溶液 变色。 ( 2 )酸溶液能与 活泼 金属反应( 请回忆第八单元并填表 ) 与稀盐酸反应 与稀硫酸反应 镁 锌 铁 Mg+2HCl=MgCl 2 + H 2 ↑ Zn+2HCl=ZnCl 2 + H 2 ↑ Fe+2HCl= FeCl 2 + H 2 ↑ Mg+H 2 SO 4 =MgSO 4 + H 2 ↑ Zn+H 2 SO 4 =ZnSO 4 + H 2 ↑ Fe+H 2 SO 4 = FeSO 4 + H 2 ↑ 讨论:上面反应的生成物有什么共同之处? 生成物都是 盐 和 氢气 结论 : 酸 + 活泼金属 → 盐 + 氢气 (置换反应) ( 3 )酸溶液能与金属氧化物反应 : 现 象 化学方程式 铁锈 + 盐酸 铁锈 + 硫酸 铁锈 消失 , 溶液由无色 变为 黄色 Fe 2 O 3 + 6HCl = 2 FeCl 3 +3H 2 O Fe 2 O 3 +3H 2 SO 4 = Fe 2 (SO 4 ) 3 +3H 2 O 讨论:① 上面反应的生成物有什么共同之处? 生成物都是 盐 和 水 ② 利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么? 不能。因为酸会与 金属 继续反应, 金属制品 被腐蚀 。 酸 + 金属氧化物→盐 + 水 (复分解反应) 引申 氧化铜也可以与这两种酸发生化学反应,写出方程式 CuO+H 2 SO 4 = CuSO 4 +H 2 O CuO+2HCl= CuCl 2 +H 2 O 现象:黑色粉末逐渐 溶解 ,溶液由无色逐渐变为 蓝色 ( 4 )根据以上实验和讨论,试归纳出盐酸、硫酸等酸有哪些 相似 的 化学性质 。 ① 酸能使酸碱 指示剂 显示不同的颜色; ② 酸能与多种 活泼金属 反应,生成氢气; ③ 酸能与某些 金属氧化物 反应,生成水。 练习: 向放有铁锈的钉子的试管中加入 过量 盐酸 , 充分 反应后 , 铁锈消失 , 并有 气泡 产生 , 写出有关反应的化学方程式 :__________________________ 、 _____________________________ . Fe 2 O 3 + 6HCl = 2FeCl 3 + 3H 2 O Fe + 2HCl = FeCl 2 + H 2 ↑ ④ 酸能与 碱 反应: NaOH + HCl = NaCl + H 2 O 2 NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O Al(OH) 3 + 3 HCl = Al Cl 3 + 3 H 2 O 酸 + 碱 → 盐 + 水 2 Al(OH) 3 + 3 H 2 SO 4 = Al 2 (SO 4 ) 3 + 6 H 2 O (复分解反应) 实验 1 :稀盐酸和硝酸银溶液反应 HCl+AgNO 3 = AgCl↓ +HNO 3 (白色沉淀) 实验 2 :稀硫酸和氯化钡溶液反应 H 2 SO 4 +BaCl 2 = BaSO 4 ↓ +2HCl (白色沉淀) 注意: AgCl 、 BaSO 4 不溶于水,也不溶于酸。 ⑤ 酸跟某些 盐 发生的反应 酸 + 盐→ 新盐 + 新酸 (复分解反应) 1 、酸能使酸碱指示剂显示不同的颜色; 2 、酸能与多种活泼金属反应,生成盐和氢气; 3 、酸能与某些金属氧化物反应,生成盐和水。 4 、酸能与碱反应生成盐和水 预习常见的碱 学完本课题你应该知道 酸的化学性质 5 、酸能与某些盐反应生成新盐和新酸 【 小结 】 1 、 跟 指示剂 反应 2 、 跟 活泼金属 反应 3 、 跟 金属氧化物 反应 4 、 跟 碱 反应 5 、 跟某些 盐 反应 石蕊试液遇酸变成 红色 ,酚酞试液遇酸 不变色 。 酸 + 金属 == 盐 + 氢气↑ Fe 2 O 3 +6HCl= 2FeCl 3 +3H 2 O 金属氧化物 + 酸 == 盐 + 水 Na OH+HCl= NaCl+H 2 O 酸 + 碱 == 盐 + 水 酸的化学性质 再见 ! 课 题 1 常 见 的 酸 和 碱 课题 1 常见的酸和碱 ( 第三课时 ) 氢氧化钠: 氢氧化钾: 氢氧化钙: 氢氧化钡: 氨水: 四强碱 NaOH KOH Ca(OH) 2 Ba(OH) 2 NH 3 · H 2 O 实验 10—5 氢氧化钠 NaOH 实验 现象 分析 观察氢氧化钠的颜色、状态 将氢氧化钠放置于表面皿上,放置一会儿 将氢氧化钠放入盛有少量水的试管里,并用手 触碰试管外壁 白色固体 表面潮湿并逐渐溶解 容易吸收水分 发热 NaOH 溶于水 放出热量 。 用镊子夹取 3 小块氢氧化钠分别进行实验(切勿用手拿) 实验 10—6 取一药匙氢氧化钙,观察它的颜色和状态,然后放入小烧杯中,加入约 30mL 水,搅拌,观察氢氧化钙在水中的溶解情况。然后向上层澄清的溶液中通入二氧化碳, 现 象 颜色、状态 在水中的溶解情况 向澄清溶液中通入 CO 2 白色粉末状固体 没有完全溶解 , 呈浑浊状态 产生白色浑浊 氢氧化钙 [ Ca(OH) 2 ] CaO + H 2 O Ca(OH) 2 生石灰 与水反应得到 氢氧化钙 。 生石灰 CaO 现象: 放出大量的热 熟石灰 Ca(OH) 2 溶解性顺口溜 ( P114 ) 钾钠铵硝酸(盐)溶 盐酸(盐)不溶 AgCl 硫酸(盐)不溶 BaSO 4 碳酸(盐)只溶钾钠铵 溶碱只有氨钠钙钾钡 氨水: NH 3 · H 2 O 氢氧化钠: NaOH 氢氧化钙: Ca(OH) 2 氢氧化钾: KOH 氢氧化钡: Ba(OH) 2 再见 ! 课 题 1 常 见 的 酸 和 碱 课题 1 常见的酸和碱 ( 第四课时 ) 1. 碱 与 指示剂 反应 碱溶液 能 使 紫色石蕊 溶液变 蓝色 , 使 无色酚酞 溶液变 红色 。不溶于水的碱 不能 使指示剂变色。 2. 碱 与某些 非金属氧化物 反应 碱 的化学性质 2NaOH + CO 2 = Na 2 CO 3 + H 2 O Ca(OH) 2 +CO 2 =CaCO 3 ↓ +H 2 O 氢氧化钠必须 密封 保存 ? (P56) ( 检验 CO 2 ) ( 除去 CO 2 ) ( 氢氧化钠变质原理 ) CO 2 和 NaOH 反应,无明显现象,如何证明发生了反应呢? NaOH 溶液 2NaOH + SO 2 = Na 2 SO 3 + H 2 O 2NaOH + SO 3 = Na 2 SO 4 + H 2 O Ca(OH) 2 + SO 2 = CaSO 3 ↓ +H 2 O Ca(OH) 2 +SO 3 =CaSO 4 +H 2 O 碱 + 非金属氧化物 → 盐 + 水 (化合价不变,不属于任何基本反应类型) 2NaOH + CO 2 = Na 2 CO 3 + H 2 O Ca(OH) 2 +CO 2 =CaCO 3 ↓ +H 2 O 3. 碱跟 酸 反应 : 酸 + 碱 → 盐 + 水 (复分解反应) KOH + HCl == KCl +H 2 O 4. 碱 跟某些 盐 反应 : 碱 + 盐→ 新碱 + 新盐 (复分解反应) CuSO 4 +2NaOH == Cu(OH) 2 ↓ +Na 2 SO 4 FeCl 3 + 3NaOH == Fe(OH) 3 ↓ +3NaCl 蓝色沉淀 红褐色沉淀 碱与盐 反应的条件 反应物 :都可溶 生成物 :有沉淀、气体或水 Na 2 CO 3 +Ca(OH) 2 == CaCO 3 ↓ +2NaOH 白色沉淀 酸碱溶液中的粒子 酸溶液为什么具有一些相似的化学性质 ? 碱溶液为什么也具有一些相似的化学性质 ? 物质 盐酸 硫酸 NaOH 溶液 Ca(OH) 2 溶液 蒸馏水 乙醇 导电性 酸溶液、碱溶液为什么能导电? 而蒸馏水、乙醇为什么不导电? × × 酸碱溶液中的粒子 分子 不能自由 移动的离子 能 自由移动 的 离子 酸 H + + 酸根离子 在水溶液中 解 离 碱 金属离子 + OH — 在水溶液中 解 离 HCl H + + Cl — Ca(OH) 2 Ca 2+ + 2OH — 在不同的 酸溶液 中都含有相同的 H + ,所以,酸有一些 相似 的性质。 在不同的 碱溶液 中都含有相同的 OH — ,所以碱也有一些 相似 的性质。 碱的化学性质 1. 碱溶液 能与 酸碱指示剂 反应 , 碱溶液 能使紫色石蕊试液变蓝,无色酚酞试液变红。 2. 碱溶液 能和 某些 非金属氧化物 反应,生成盐和水。 3. 碱 能和 酸 反应,生成盐和水。 4. 碱溶液 能和 某些 盐 溶液 反应,生成新碱和新盐。 1 、 下列气体中,既能用固体 NaOH 干燥又能用浓 H 2 SO 4 干燥的是( ) A. CO 2 B. HCl C. SO 2 D. O 2 D 【 解析 】 干燥原理: 干燥剂只吸收水分,但不能与与被干燥的气体发生反应。 CO 2 、 SO 2 、 HCl 都能与 NaOH 反应,故三者均不能用 NaOH 来干燥,而 O 2 既不能与 NaOH 反应,也不能与浓 H 2 SO 4 反应,故用浓 H 2 SO 4 、 NaOH 干燥都可以。 2 、 若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的 _____ 、 ________ 、和 ________ ,最后剩余的气体主要是 _______ 。 CO 2 水蒸气 O 2 N 2 3 、 将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧杯中,充分反应,有部分铁剩余,过滤后,滤液中含有的溶质是( ) A. H 2 SO 4 B. FeSO 4 C. FeSO 4 和 CuSO 4 D. H 2 SO 4 和 FeSO 4 B 4. 下列物质中,不用密封保存的是( ) A. 浓硫酸 B. 氯化钠固体 C. 浓盐酸 D. 烧碱固体 5. 氢氧化钠是 ____ 色的 ______ 固体, _________ 于水。它露置在空气中,表面会发生潮解,这是因为它 ______________________ 的缘故。同时它还能与空气中的 _______ 发生反应,其化学方程式为 _______________________ ,从而使氢氧化钠变质;因此,氢氧化钠固体必须 __________ 保存;而它的水溶液也必须 _________ 保存。 B 白 片状 易溶解 吸收了空气中的水分 CO 2 2NaOH+CO 2 ==Na 2 CO 3 +H 2 O 密封 密封 7. 盛放在敞口瓶内的下列物质长期暴露在空气中,瓶内物质的质量会减少的是( ) A. 食醋 B. 生石灰 C. 食盐 D. 烧碱固体 6. 在某些食品的包装内,有一个装有白色颗粒固体的小纸袋,上面写着 “ 干燥剂,主要成分为生石灰 ” 。为什么生石灰能做干燥剂?如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这是为什么?试写出有关反应的化学方程式。 CaO + H 2 O == Ca ( OH ) 2 Ca ( OH ) 2 + CO 2 == CaCO 3 ↓ + H 2 O A 8. 将 2.8g 生石灰放入 47.4g 水中,充分反应,所得溶液中溶质的质量分数是( ) A.5.6% B. 7.4% C.10% D. 小于 1% D 分析: 本题属条件隐蔽型的习题 , 在解题时应注重审题,挖掘出隐含条件。其隐含条件是: ( 1 )生石灰与水反应生成氢氧化钙,即溶质为氢氧化钙。( 2 )氢氧化钙微溶于水。因此选 D 。 9. 下列氧化物中,通常情况下既不与酸反应,又不与碱反应的是( ) A.CO 2 B.CO C.CaO D.CuO B 10. 如图所示,向小试管内加入浓 H 2 SO 4 会使下图 U 型管的左边液面 _____ ,右边液 _____ ,其原因是 ______________________________________________ 。你还能另外再选择两种同样作用的物质吗?( 1 ) __________ ,( 2 ) __________ 。 下降 上升 浓 H 2 SO 4 溶于水放出大量的热,使瓶内压强增大 NaOH CaO 自制的叶脉书签 再见 !查看更多