- 2021-11-10 发布 |
- 37.5 KB |
- 55页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
中考化学全程复习第六单元碳和碳的氧化物课件 人教版
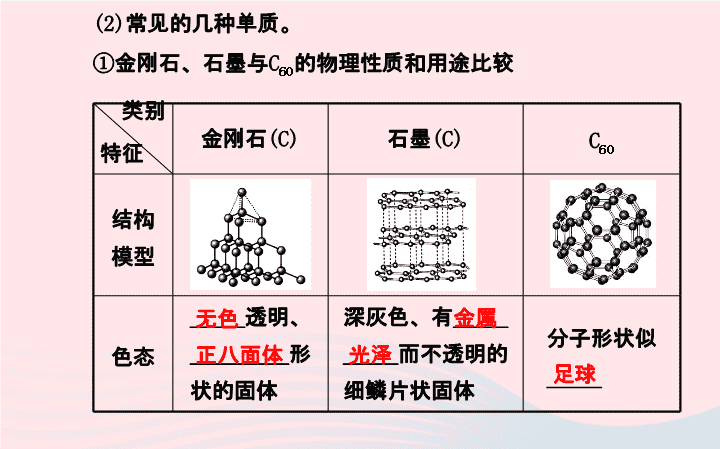
第六单元 碳和碳的氧化物 考点 一 碳的单质 1.碳的单质: (1)存在形式:碳的单质有_______、_____和___等,由于它们的 原子_________不同,导致它们在物理性质上存在很大差异。 金刚石 C60 排列方式 石墨 (2)常见的几种单质。 ①金刚石、石墨与C60的物理性质和用途比较 金刚石(C) 石墨(C) C60 结构 模型 色态 _____透明、 _________形 状的固体 深灰色、有_____ _____而不透明的 细鳞片状固体 分子形状似 _____ 类别 特征 正八面体 金属 光泽 足球 无色 金刚石(C) 石墨(C) C60 硬度 天然存在的 _____的物质 _____的矿 物之一 质脆 导电性 几乎不导电 导电(优良) 几乎不导电 用途 钻探机钻头、 刻刀、装饰品 润滑剂、铅 笔芯、电极 广泛应用于超导、 催化、材料、医学 及生物等领域 类别 特征 最硬 最软 ②木炭和活性炭:木炭和活性炭具有_______,可以用作_______, 除去食品和工业产品中的色素,消除异味和吸收有毒气体等。 吸附性 吸附剂 【思考感悟】 石墨与金刚石在一定条件下可以相互转化,两者之间的转化属 于物理变化还是化学变化? 提示:通过分析金刚石与石墨的结构,可以确定两者属于两种不 同的物质,因此两者之间的转化属于化学变化。 2.单质碳的化学性质:常温下,碳的化学性质_______,随着温 度的升高,碳的活泼性大大增强。 (1)可燃性。 氧气充足时,反应的化学方程式为______________; 氧气不足时,反应的化学方程式为______________。 点燃====C+O2 CO2 点燃====2C+O2 2CO 不活泼 (2)还原性。 ①与CuO反应。 ②与CO2反应。 化学方程式:_______________。 黑色粉末中有 红色固体生成 澄清的石灰石 变浑浊 C+2CuO CO2↑+2Cu高温==== CO2+Ca(OH)2====CaCO3↓+H2O 高温 ====CO2+C 2CO (3)应用:用于_____工业。如焦炭把铁从铁的氧化物矿石中还 原出来,化学方程式为_________________________。 冶金 高温 ====2Fe2O3+3C 4Fe+3CO2↑ 考点 二 二氧化碳的制取 1.工业制法: ____________________。高温 ====CaCO3 CO2↑+CaO 2.实验室制取: (1)反应原理。 _____________________________。 (2)制取装置。 实验室常用的制取二氧化碳的装置如图甲、乙所示。 CaCO3+2HCl====CaCl2+H2O+CO2↑ 将燃着的木条放在 集气瓶口,若木条 熄灭 向上排空气法 伸入液面以下 从长颈 漏斗中排出 正放 考点 三 二氧化碳的性质与用途 1.性质: (1)物理性质。 颜色 气味 状态 密度 溶解性 _____ _____ _____ 比空气___ ___溶于水无色 无味 气体 大 能 (2)化学性质。 ①实验:熄灭蜡烛 a.现象:_____的蜡烛先熄灭,_____的蜡烛后 熄灭; b.结论:二氧化碳不能_____,也___________, 密度比空气___。 下面 上面 燃烧 不支持燃烧 大 ②实验:与水化合 a.现象:紫色的石蕊溶液变___; b.结论:二氧化碳与水反应生成_____,反应的化学方程式为 _________________。 红 碳酸 CO2+H2O====H2CO3 ③实验:与澄清石灰水反应(常用于二氧化碳的检验) a.现象:澄清石灰水变_____; b.二氧化碳与澄清石灰水反应生成_______沉淀,反应的化学 方程式为__________________________。 浑浊 碳酸钙 Ca(OH)2+CO2====CaCO3↓+H2O 2.用途及对环境的影响: (1)用途。 人工降雨 灭火 (2)对环境的影响——温室效应。 ①成因:大气中的二氧化碳增多,使全球变暖。能产生温室效 应的气体有:_________、臭氧、甲烷、氟氯代烷等。 ②危害:导致两极的冰川融化,使海平面上升,土地沙漠化。 ③缓解措施:减少_________的使用;使用_____型能源;大力植 树造林,严禁乱砍滥伐森林等。 二氧化碳 化石燃料 清洁 考点 四 一氧化碳的性质和用途 1.物理性质: 颜色 气味 状态 密度 溶解性 _____ _____ _____ 比空气___ ___溶于水无色 无味 气体 小 难 2.化学性质: (1)可燃性:反应现象:纯净的CO在空气中点燃时,能产生_____ 火焰,放出大量的热。化学方程式为________________。 (2)还原性:CO还原CuO反应的化学方程式为 __________________。 (3)剧毒性:毒性原理:CO与血液中的_________结合,使_____ ______________________,造成生物体缺氧,甚至危及生命。 蓝色 点燃====2CO+O2 2CO2 △ ====CO+CuO Cu+CO2 血红蛋白 血红 蛋白不能很好地与O2结合 3.用途: (1)用作_____。 (2)用于_________,如用CO冶炼生铁的化学方程式为 _______________________。 燃料 冶炼金属 高温 ====3CO+Fe2O3 2Fe+3CO2 【易错微博】小博士答学生问 问题1 “一种元素只能组成一种单质”,这种说法是否正确? 答:不正确。一种元素可组成不同单质,如碳元素可组成金刚石、 石墨等。 问题2 实验室能否用浓盐酸或硫酸反应制取二氧化碳? 答:不能。因浓盐酸具有挥发性,挥发出的氯化氢会使制得的二 氧化碳不纯;不能用硫酸,是因为硫酸与碳酸钙反应生成微溶于 水的硫酸钙,会覆盖在碳酸钙的表面,阻止反应的继续进行。 问题3 “为防止一氧化碳中毒,可在房间内放一盆水”,这种说 法是否正确?为什么? 答:不正确。一氧化碳难溶于水,故在房间内放一盆水,不能有 效吸收一氧化碳,而应保持房间通风、透气。 实验 气体的发生装置与收集装置的综合探究 1.气体发生装置: 2.收集装置: 3.问题探究: (1)选择气体的发生装置的依据是什么?图1中五套气体发生装 置各自适用于什么条件下的反应? 提示:一般根据反应条件(是否加热、加催化剂等)和反应物状 态(固体和固体反应、固体和液体反应或液体和液体反应等) 设计发生装置;若固+固 气,可选用图1的A装置;若固+ 液 气,可选用图B、C、D、E等装置。 △ (2)选择气体的收集装置的依据是什么?图2中A、B、C三套收集 装置各自适用于收集具有什么特点的气体? 提示:一般根据气体的水溶性和气体的密度设计收集装置。当 气体密度大于空气时,可选用向上排空气法(装置A),如CO2、O2、 SO2等气体的收集;若密度小于空气,则用向下排空气法(装置 B),如H2、CH4等气体的收集;若气体难溶或不易溶于水,且不与 水发生化学反应,则用排水法收集(装置C),如H2、CO、CH4、O2 等气体的收集。 (3)图2中D装置被称为“万能瓶”,若用该装置收集CO2气体,你认 为要从哪端(填“a”或“b”)进气?若用排水法收集气体,应如何操 作? 提示:因CO2的密度比空气大,故应选用向上排空气法收集,若用 D装置收集,气体应从a端进入;若用排水法收集气体,应在该装 置中装满水,气体从b端进入。 【典例】(2012·南京中考)请根据下列装置图,回答有关问题: (1)写出装置图中标号仪器的名称: a ;b 。 (2)写出实验室用大理石和稀盐酸反应制取二氧化碳的化学方 程式 , 可选用的收集装置是 (填字母)。某同学用碳酸钠粉末 和稀盐酸反应来制取二氧化碳,为了较好地控制反应速率,可选 用的发生装置是 (填字母)。 (3)写出实验室用A装置加热高锰酸钾固体制取氧气的化学方程 式: 。 (4)你认为实验室制取气体时要注意的是: ①选择适当的反应,包括 和 ; ②选择合适的 ; ③需验证所制得的气体。 【我的收获】(1)图中仪器分别是试管和集气瓶。(2)大理石和 稀盐酸反应生成二氧化碳、水和氯化钙;二氧化碳的密度比空 气大,故可用向上排空气法收集;C装置可以控制液体的滴加速 率,从而达到控制反应速率的目的。(3)高锰酸钾在加热的条件 下生成锰酸钾、二氧化锰和氧气。(4)实验室制取气体时要注 意选择适当的反应物和反应条件及实验装置等因素。 答案:(1)试管 集气瓶 (2)CaCO3+2HCl====CaCl2+H2O+CO2↑ E C (3)2KMnO4 K2MnO4+MnO2+O2↑ (4)①药品 反应条件 ②实验装置 △ ==== 【拓展延伸】实验室制取二氧化碳的药品选择及选择依据 (1)药品的选择:实验室制取二氧化碳通常选用大理石(或石灰 石)与稀盐酸反应。 ①大理石(或石灰石)的主要成分是碳酸钙,是难溶性块状固体, 与盐酸反应速率适中,价廉易得,便于气体收集; ②实验室一般不用粉末状的碳酸钠或碳酸钙做反应物,是因为 反应速率太快,不利于气体收集; ③实验室不用浓盐酸做反应物,是因为浓盐酸具有挥发性,挥发 出的氯化氢气体导致二氧化碳气体不纯; ④实验室一般不用硫酸做反应物,是因为硫酸与碳酸钙反应生 成微溶于水的硫酸钙,会覆盖在碳酸钙的表面,阻止反应进行。 (2)选择药品的依据:有二氧化碳生成的反应不一定适用于实验 室制取二氧化碳。实验室制取气体选择药品时,要考虑以下几 个要素: ①药品是否价廉易得; ②反应速率是否有利于气体的收集; ③反应是否有利于环境保护,无有毒、污染物产生; ④反应装置是否简单、操作简便等。 要点 一 正确理解碳单质的性质及用途 1.碳单质的物理性质及用途: (1)结构决定性质。由于碳原子的排列方式不同,因而不同的碳 单质物理性质有很大差异,如金刚石是天然存在的最硬的物质, 而石墨是最软的矿物质之一。 (2)性质决定用途。不同的碳单质由于性质不尽相同,因而用途 不同。如金刚石常用于制玻璃刀,石墨常用作电极,焦炭常用作 燃料和炼铁用的还原剂,活性炭常用作吸附剂,木炭常用作燃料 等。 2.碳单质的化学性质:常温下,碳的化学性质很稳定,高温下,碳 能够与很多物质(如Fe2O3、CO2等)发生反应。 角度 1 结合生产、生活实际及新科技知识,考查碳单质的物 理性质、用途 【典例1】(2013·十堰中考)有关碳元素形成的几种物质,以下 说法错误的是( ) A.C60是一种新型化合物 B.金刚石是天然最硬的物质 C.石墨具有优良的导电性 D.活性炭可以除去冰箱中的异味 【我的答案】选A。本题考查考生对碳的理解。C60是一种新型 化合物是错误的,C60是只由一种元素组成的物质,是单质。 角度 2 以实验题、探究题等形式考查碳的化学性质 【典例2】(2013·德州中考)对于化学反应,我们不但要考虑加 入的试剂,还要考虑环境中的其他物质对化学反应的影响。在“ 木炭还原氧化铜”的实验中(如图),你认为试管A中的物质除木 炭与氧化铜外,还存在_________________________ 。 (1)根据你所学知识猜测:试管A中,除C、CuO外,还可能有物 质 (写化学式,下同)参与反应。除木炭可以还原氧化 铜外,经反应生成的 也可以还原氧化铜。写出相应的 化学方程式 。 要排除环境对该反应的影响,你认为应采取何种措施? ___________________________________________________ 。 (2)请你推测,进入试管B的气体,除二氧化碳外,还可能有 。要想使进入试管B中的二氧化碳全部被吸收,应采取什么措施 ? _____________________________________________________ _____________________________________________________ 。 【我的收获】由于试管内有空气,其中的氧气在较高的温度下 会与碳发生反应生成一氧化碳,且一氧化碳具有还原性,也能与 氧化铜发生反应;将试管内的空气抽出或通入保护气体,便可消 除这种影响;由于氢氧化钙微溶于水,因此用澄清石灰水难以将 反应生成的二氧化碳完全吸收,而氢氧化钠易溶于水,故可换用 较浓的氢氧化钠溶液吸收二氧化碳。 答案:空气 (1)O2 CO CO+CuO Cu+CO2 抽成真空(或 充入氮气等保护气体) (2)氧气(或空气、氮气、一氧化碳) 将澄清石灰水换成较浓 的氢氧化钠溶液(或将试管换成大烧杯、广口瓶;增加澄清石 灰水的量) △ ==== 【拓展延伸】C、CO还原氧化铜实验的对比 装置 A B 还原剂 C CO 现象 黑色的粉末变成红色 ;澄清的石灰水变浑 浊 黑色的粉末变成红色;澄 清的石灰水变浑浊 反应的 方程式 C+2CuO 2Cu+CO2↑ CO+CuO Cu+CO2 反应 类型 置换反应,氧化还原 反应 氧化还原反应 高温 ==== 加热 ==== 要点 二 CO与CO2的有关性质、鉴别与除杂 1.CO与CO2的化学性质比较: 化学性质 CO CO2 可燃性 可燃 2CO+O2 2CO2 一般情况下,既不燃烧, 也不支持燃烧 还原性 有还原性 CO+CuO Cu+CO2 无还原性,有较弱的氧 化性:CO2+C 2CO 点燃==== △ ==== 高温 ==== 化学性质 CO CO2 与水反应 不能与水反应 与水反应:CO2+H2O====H2CO3 与石灰水反应 不发生反应 反应,使澄清石灰水变浑浊: CO2+Ca(OH)2====CaCO3↓+H2O 毒 性 有剧毒 无毒 2.CO与CO2的鉴别方法: (1)澄清石灰水法:将气体分别通入澄清石灰水中,能使澄清石 灰水变浑浊的是CO2,无现象的是CO。 (2)点燃法:将气体分别在空气中点燃,能燃烧的是CO,不能燃烧 的是CO2。 (3)紫色石蕊溶液法:将气体分别通入紫色石蕊溶液中,能使石 蕊溶液变红的是CO2,无现象的是CO。 (4)还原CuO法:将气体分别通入灼热的CuO中,出现黑色粉末变 红现象的是CO,无现象的是CO2。 3.互为杂质时的除杂方法: (1)CO中混有CO2杂质: ①通过足量氢氧化钠溶液;②通过足量灼热的炭粉。 (2)CO2中混有CO杂质: 通过足量的灼热的氧化铜。 【特别提醒】用点燃的方法不能除去CO2中的CO。在CO2气体中 CO属于杂质,其含量不会很多,而二氧化碳不能支持燃烧,因此, 不能将其中的CO点燃。 角度 1 结合CO2和CO的比较考查两者的有关性质 【典例1】(2013·广州中考)下列关于碳及其化合物的说法,正 确的是( ) A.CO和CO2都可将氧化铜还原成铜 B.CO2的排放不是导致酸雨的原因 C.在室内放一盆澄清石灰水可防止CO中毒 D.铅笔字迹易变模糊是因为常温下石墨化学性质活泼 【我的答案】选B。CO具有还原性,能够将氧化铜还原成铜,但 CO2不能还原氧化铜,A错误;酸雨主要是由于空气中的二氧化硫 或氮氧化物溶于雨水造成的,与二氧化碳无关,B正确;CO难溶于 水,也不能与澄清石灰水发生化学反应,C错误;石墨是碳的一种 单质,常温下,碳的化学性质很稳定,D错误。 角度 2 结合CO2和CO的性质考查两者的鉴别方法 【典例2】(2012·肇庆中考)鉴别O2、CO、CO2三种气体,可行 简便的方法是( ) A.将气体分别通入澄清石灰水 B.将气体分别通入石蕊溶液 C.试验三种气体在水中的溶解性 D.将燃着的木条分别伸入瓶内 【我的答案】选D。本题考查气体的检验,解题时应利用所要鉴 别物质的性质差别设计实验,根据实验中出现的明显现象差异, 达到鉴别目的。将燃着的木条分别伸入三瓶气体中,木条燃烧 更剧烈的是O2,木条火焰熄灭的是CO2,气体能燃烧的是CO。查看更多