- 2021-11-10 发布 |
- 37.5 KB |
- 24页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年安徽省安庆市桐城市新安中学中考化学模拟试卷 解析版
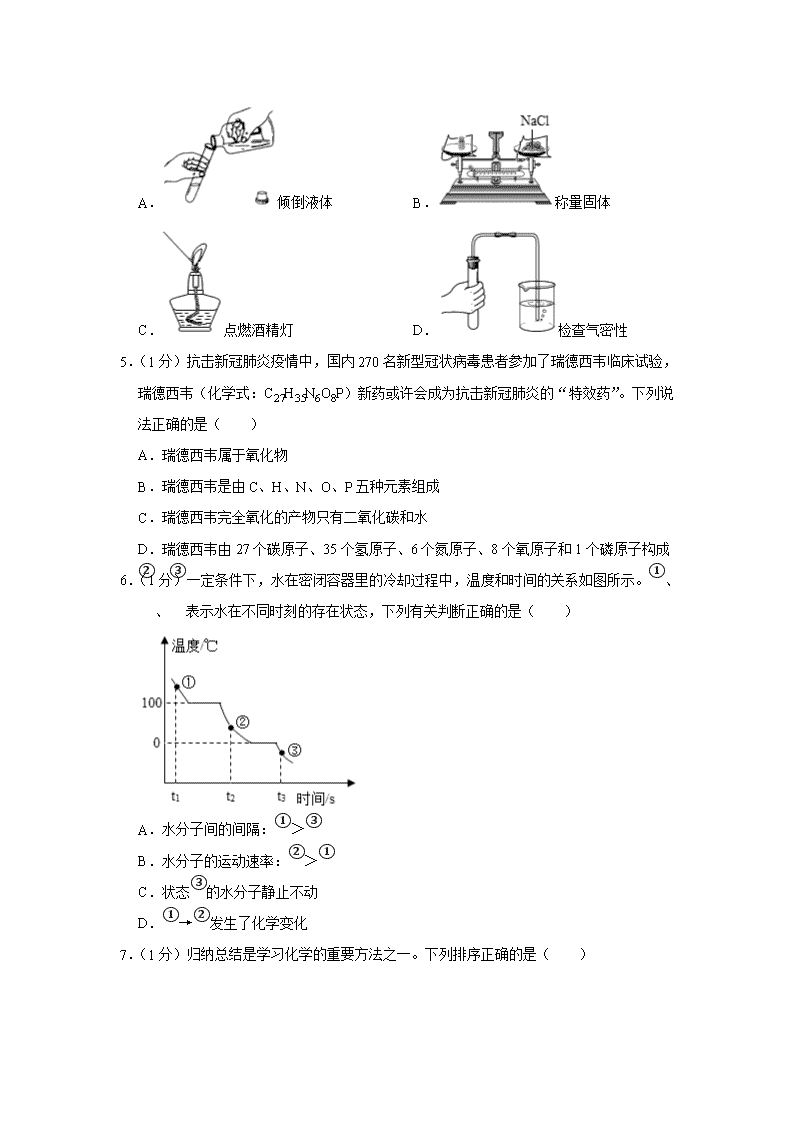
2020年安徽省安庆市桐城市新安中学中考化学模拟试卷 一、本大题包括12小题,每小题1分,共12分.每小题的4个选项,中只有1个符合题意,请将选出的选项序号填入答题卡内. 1.(1分)2019年10月1日,北京天安门前举行的国庆70周年大阅兵扬我国威,耀我中华。阅兵过程中,下列一定发生化学变化的是( ) A.56门礼炮齐放,70响轰鸣 B.放飞7万气球 C.三军将士昂首阔步 D.群众载歌载舞 2.(1分)党的十九大提出要加快生态文明体制改革,建设美丽中国。下列做法正确的是( ) A.为保护环境,废旧塑料焚烧处理 B.为增加粮食产量,大量使用农药、化肥 C.对垃圾进行分类回收 D.二氧化碳的大量排放造成酸雨 3.(1分)钪(Sc)是一种“工业的维生素”。如图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是( ) A.钪属于非金属元素 B.钪的相对原子质量是21 C.原子结构示意图中x=10 D.钪原子在化学反应中易失去电子 4.(1分)下列实验操作不正确的是( ) A.倾倒液体 B.称量固体 C.点燃酒精灯 D.检查气密性 5.(1分)抗击新冠肺炎疫情中,国内270名新型冠状病毒患者参加了瑞德西韦临床试验,瑞德西韦(化学式:C27H35N6O8P)新药或许会成为抗击新冠肺炎的“特效药”。下列说法正确的是( ) A.瑞德西韦属于氧化物 B.瑞德西韦是由C、H、N、O、P五种元素组成 C.瑞德西韦完全氧化的产物只有二氧化碳和水 D.瑞德西韦由27个碳原子、35个氢原子、6个氮原子、8个氧原子和1个磷原子构成 6.(1分)一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( ) A.水分子间的间隔:①>③ B.水分子的运动速率:②>① C.状态③的水分子静止不动 D.①→②发生了化学变化 7.(1分)归纳总结是学习化学的重要方法之一。下列排序正确的是( ) A.金属活动性顺序: B.溶液的pH: C.地壳中的元素含量: D.气体的密度: 8.(1分)归纳总结能使知识系统化,有利于提高素质和能力,下面是一同学对部分化学知识的归纳,其中都正确的一项是( ) A 物质与微粒构成 B 化学中常见的“三” 金刚石:由碳原子构成 氯化钠:由氯化钠离子构成 三种可燃性气体:H2、CO、O2 三种可加热仪器:试管、烧杯、蒸发皿 C 元素与人体健康 D 鉴别物质的方法 缺钙元素:易患骨质疏松症 缺碘元素:易患甲状腺疾病 酱油和食醋:闻气味 氮气和二氧化碳:用燃着的木条 A.A B.B C.C D.D 9.(1分)向盛有10g 49%稀硫酸的烧杯中加入5.6克的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。下列说法正确的是( ) A.取a点溶液,加入锌粉,有气体放出 B.b点时,溶液中溶质只有一种 C.c点时,烧杯中固体一定是铜 D.m=12.7 10.(1分)小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是( ) 温度/℃ 0 10 20 40 60 80 100 溶解度/g 182 191 204 238 287 362 487 A.配制的蔗糖溶液下层比上层甜 B.降温,糖水中一定有晶体析出 C.20℃时,蔗糖饱和溶液质量一定为304g D.升温,糖水中蔗糖的质量分数不变 11.(1分)课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( ) A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素 C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的 12.(1分)工业上常采用Cu与稀盐酸在持续通入空气的条件下制取CuCl2.其原理如图所示。下列说法正确的是( ) A.反应过程中需不断添加FeCl3溶液 B.该实验说明Cu能与稀盐酸发生置换反应 C.通入空气发生的反应为4FeCl2+O2+4HCl═4FeCl3+2H2O D.若反应恰好完全进行,将6.4g的铜完全反应,需消耗10.0%的盐酸146g 二、本大题包括5小题,共28分 13.(6分) 垃圾分类,人人有责。 新华社北京6月3日电中共中央总书记、国家主席、中央军委主席习近平近日对垃圾分类工作作出重要指示。习近平强调,实行垃圾分类,关系广大人民群众生活环境,关系节约使用资源,也是社会文明水平的一个重要体现。垃圾中含有人类生存和从事生产劳动所需要的“半成品”。我们要变废为宝,保护好环境,首先我们每个人都要自觉地对垃圾进行分类。 (1)在垃圾回收中,我们提倡实行垃圾分类回收。下列物质中属于可回收垃圾的是 。 A.旧书、旧报纸 B.易拉罐 C.空矿泉水瓶 D.废弃的口罩 E.果皮 (2)我们的现代生活离不开电池,电池的使用能减少大气污染物和提高能量的转化效率,但废弃的电池(如含汞电池)却属于有害垃圾呢? (文字叙述)。 (3)一些可燃性的垃圾可用于燃烧发电。 ①垃圾发电厂中的可燃性垃圾中通常含有较多的水分,我们一般可通过 等措施,促进可燃性垃圾完全燃烧,减少有害物质的产生; ②在燃烧过程中,可能会有二氧化硫气体产生,除去二氧化硫还可以用石灰乳吸收,写出石灰乳吸收二氧化硫的化学方程式 ; ③在综合反应塔和袋式除尘器之间的水平烟道中,喷入活性炭粉末,对残留的二噁英等有害有毒气体进行 。 (4)在我们一些农村中,将植物的秸秆和人、动物的排泄物加入沼气池中发酵产生沼气(主要成分是甲烷),甲烷在空气中完全燃烧的化学方程式 。 14.(9分)实验室里现有氯酸钾、稀盐酸、石灰石、澄清石灰水、火柴、药匙、镊子以及如图仪器: (1)利用上述药品,若要补充一种仪器 ,可制取、检验进而收集二氧化碳,除补充的仪器外还需要的仪器有 (填序号),则发生装置内反应的化学方程式为 。 (2)若想利用上述实验用品制取氧气,还需补充一种药品 (填化学式),仪器④在该实验中用于 。 (3)收集完氧气后接下来的操作是先 ,然后再 ,如果操作顺序颠倒,试管内气体温度会 (填升高或降低),试管内气体压强会 ,在压强差作用下,水就会倒吸入试管,试管因骤然冷却而炸裂。 15.(5分)用黑钨矿(主要含FeWO4)制得金属钨(W)的主要工艺流程如图: 已知:Na2WO4溶液为无色:H2WO4是一种不溶于水的黄色固体:WO3难溶于水。 (1)将黑钨矿石碾成粉末,目的是 。 (2)压煮器中,发生反应为4Na2CO3+4FeWO4+O24Na2WO4+2Fe2O3+4R,R的化学式为 。 (3)酸浸槽中,Na2WO4溶液和浓盐酸发生复分解反应,该反应的化学方程式为 。 (4)焙烧炉中,焙烧H2WO4的反应属于 (填基本反应类型)。 (5)还原炉中,H2与WO3发生置换反应得到W,反应中化合价升高的元素是 。 16.(10分)为了探究酸和碱之间的反应,某化学兴趣小组的同学进行了以下实验。 实验l:甲同学向盛有少量NaOH溶液的试管中滴入几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由 色变成无色。得出结论:酸和碱能发生反应。该反应的化学方程式是 ,从微观角度分析,该反应的实质是 。 实验2:如图所示的是乙同学利用数字传感器,测定稀盐酸氢氧化钠溶液反应的过程中溶液的pH的变化曲线。 (1)实验2进行的操作是 (填序号)。 ①将稀盐酸逐滴加入氢氧化钠溶液中 ②将氢氧化钠溶液逐滴加入稀盐酸中 (2)点c表示的含义是 。 (3)d点对应的溶液中的溶质是 (填化学式)。 实验3:甲同学在做完实验后所得的无色液体中的溶质除了酚酞外。还有什么?请你作出猜想并设计用两种不同的方案进行验证。 【作出猜想】猜想1:NaCl;猜想2:NaCl和 。 【设计实验】方案1: 。 方案2: 。 17.(8分)现有20g氯化钠和碳酸氢钠的固体混合物,将其放入烧杯中,再加入125.8g稀盐酸,恰好完全反应,反应后所得溶液的质量为137g。(温馨提示:化学反应方程式为NaHCO3+HCl═NaCl+H2O+CO2↑) 请计算并回答下列问题: (1)反应中生成气体的质量是 g。 (2)固体混合物中碳酸氢钠的质量分数是多少? 2020年安徽省安庆市桐城市新安中学中考化学模拟试卷 参考答案与试题解析 一、本大题包括12小题,每小题1分,共12分.每小题的4个选项,中只有1个符合题意,请将选出的选项序号填入答题卡内. 1.(1分)2019年10月1日,北京天安门前举行的国庆70周年大阅兵扬我国威,耀我中华。阅兵过程中,下列一定发生化学变化的是( ) A.56门礼炮齐放,70响轰鸣 B.放飞7万气球 C.三军将士昂首阔步 D.群众载歌载舞 【分析】有新物质生成的变化属于化学变化,没有新物质生成的变化属于物理变化,判断化学变化的唯一标准是有新物质生成。 【解答】解:A、鸣放礼炮过程中包含着物质与氧气发生的剧烈的氧化反应,生成新物质,是化学变化,故A正确; B、放飞气球过程中没有生成新物质,是物理变化,故B错。 C、三军将士昂首阔步就是走路,过程中没有生成新物质,是物理变化,故C错; D、群众载歌载舞过程中没有生成新物质,是物理变化,故D错。 故选:A。 2.(1分)党的十九大提出要加快生态文明体制改革,建设美丽中国。下列做法正确的是( ) A.为保护环境,废旧塑料焚烧处理 B.为增加粮食产量,大量使用农药、化肥 C.对垃圾进行分类回收 D.二氧化碳的大量排放造成酸雨 【分析】A、根据废旧塑料焚烧处理会产生大量有害气体和粉尘进行解答; B、根据大量使用农药、化肥会对水体造成污染进行解答; C、根据对垃圾进行分类回收处理能防止环境污染分析; D、根据二氧化硫是形成酸雨的主要气体进行解答。 【解答】解:A、废旧塑料焚烧处理会产生大量有害气体和粉尘,造成二次污染,故选项做法错误; B、大量使用农药、化肥会对水体造成污染,故选项做法错误; C、对垃圾进行分类回收,符合这一主题,故选项错误,故选项做法正确; D、二氧化硫的大量排放,是造成酸雨的主要原因,故选项说法错误。 故选:C。 3.(1分)钪(Sc)是一种“工业的维生素”。如图为钪在元素周期表中的相关信息及其原子的结构示意图。下列说法正确的是( ) A.钪属于非金属元素 B.钪的相对原子质量是21 C.原子结构示意图中x=10 D.钪原子在化学反应中易失去电子 【分析】A、除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁; B、元素周期表任一小方格中,汉字下面是相对原子质量; C、原子中,核电荷数=核内质子数=核外电子数; D、原子最外层电子数小于4个,易失去电子,大于4个易得到电子。 【解答】解:A、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是钪,带“钅”字旁,属于金属元素,故A选项说法错误。 B、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为85.47,相对原子质量单位是“1”,不是“克”,故B选项说法错误。 C、原子中质子数等于核外电子数,21=2+x+9+2,x=8,该C选项说法错误; D、钪原子最外层电子数为2,小于4个,易失去电子,故D说法正确。 故选:D。 4.(1分)下列实验操作不正确的是( ) A.倾倒液体 B.称量固体 C.点燃酒精灯 D.检查气密性 【分析】A、根据倾倒液体的注意事项考虑; B、根据天平的使用方法考虑; C、根据点燃酒精灯的方法考虑; D、根据检查装置气密性的方法考虑。 【解答】解:A、倾倒液体的注意事项:瓶塞倒放在桌面上,标签向着手心,试管要倾斜,试管口与试剂瓶口紧挨着,故A操作正确; B、天平的使用方法:要左物右码,故B操作错误; C、点燃酒精灯要用火柴点燃,故C操作正确; D、检查装置气密性的方法:连接装置,将导管一端浸入水中,用手紧握试管外壁,导管口有气泡冒出,说明气密性良好,故D操作正确。 故选:B。 5.(1分)抗击新冠肺炎疫情中,国内270名新型冠状病毒患者参加了瑞德西韦临床试验,瑞德西韦(化学式:C27H35N6O8P)新药或许会成为抗击新冠肺炎的“特效药”。下列说法正确的是( ) A.瑞德西韦属于氧化物 B.瑞德西韦是由C、H、N、O、P五种元素组成 C.瑞德西韦完全氧化的产物只有二氧化碳和水 D.瑞德西韦由27个碳原子、35个氢原子、6个氮原子、8个氧原子和1个磷原子构成 【分析】A.氧化物是由两种元素组成的,且其中一种元素是氧元素的化合物; B.根据物质的组成来分析; C.根据物质的组成以及质量守恒定律来分析; D.根据物质的构成来分析。 【解答】解:A.瑞德西韦(化学式:C27H35N6O8P)是由五种元素组成的,所以不属于氧化物,选项说法错误; B.由化学式可知,瑞德西韦是由C、H、N、O、P五种元素组成,选项说法正确; C.由物质组成与质量守恒定律可知,该物质完全氧化的产物中除二氧化碳和水以外,还含有含氮元素、磷元素的物质,选项说法错误; D.瑞德西韦是由分子构成的,一个瑞德西韦分子由27个碳原子、35个氢原子、6个氮原子、8个氧原子和1个磷原子构成的,选项说法错误。 故选:B。 6.(1分)一定条件下,水在密闭容器里的冷却过程中,温度和时间的关系如图所示。①、②、③表示水在不同时刻的存在状态,下列有关判断正确的是( ) A.水分子间的间隔:①>③ B.水分子的运动速率:②>① C.状态③的水分子静止不动 D.①→②发生了化学变化 【分析】根据水分子在不同状态时的性质以及间隔的知识进行分析解答即可,温度升高,分子运动速率加快,间隔变大。 【解答】解:A、①是水蒸气状态,③是冰的状态,故水分子间的间隔:①>③,正确; B、在状态①时水分子的运动速率大于状态②,错误; C、无论物质处于何种状态,构成物质的分子都在不断运动,状态③的水分子处于固态,在固定的位置震动,错误; D、①→②没有产生新物质,是物理变化,错误; 故选:A。 7.(1分)归纳总结是学习化学的重要方法之一。下列排序正确的是( ) A.金属活动性顺序: B.溶液的pH: C.地壳中的元素含量: D.气体的密度: 【分析】A、根据金属活动性顺序中锌、铜、银的金属活动性强弱的顺序,进行分析判断。 B、当溶液的pH等于7时,呈中性;当溶液的pH小于7时,呈酸性;当溶液的pH大于7时,呈碱性,进行分析判断。 C、根据地壳中元素的含量分析判断; D、根据相对分子质量分析判断。 【解答】解:A、钾、镁、铜、银四种金属活动性由强到弱的顺序为钾>镁>铜>银,数轴表示正确,故选项正确。 B、氢氧化钠溶液显碱性,pH大于7;氯化钠溶液显中性,pH等于7;盐酸显酸性,pH小于7;pH值由大到小的排列顺序应是氢氧化钠溶液、氯化钠溶液、盐酸,数轴表示不正确,故选项错误。 C、地壳中元素的含量由多到少的顺序是氧、硅、铝、铁,数轴表示不正确,故选项错误。 D、标准状况下,气体的相对分子质量越大,密度越大,二氧化碳、氢气、氧气的相对分子质量分别为44、2、32,气体的密度由大到小的排列顺序应是二氧化碳、氧气、氢气,数轴表示不正确,故选项错误。 故选:A. 8.(1分)归纳总结能使知识系统化,有利于提高素质和能力,下面是一同学对部分化学知识的归纳,其中都正确的一项是( ) A 物质与微粒构成 B 化学中常见的“三” 金刚石:由碳原子构成 氯化钠:由氯化钠离子构成 三种可燃性气体:H2、CO、O2 三种可加热仪器:试管、烧杯、蒸发皿 C 元素与人体健康 D 鉴别物质的方法 缺钙元素:易患骨质疏松症 缺碘元素:易患甲状腺疾病 酱油和食醋:闻气味 氮气和二氧化碳:用燃着的木条 A.A B.B C.C D.D 【分析】A、根据构成物质的微粒进行判断; B、根据气体是否具有可燃性;三种可加热仪器判断; C、根据缺钙元素、缺碘元素人体所导致的疾病进行判断; D、根据物质性质进行判断。 【解答】解:A.金刚石是由碳原子构成;氯化钠是由氯离子和钠离子构成的;故错误; B.氧气不具有可燃性;试管、烧杯、蒸发皿可以加热;故错误; C.缺钙元素:易患骨质疏松症,缺碘元素:易串甲状腺疾病;故正确; D.酱油和食醋可以用闻气味的方法区分;氮气和二氧化碳都具有不燃烧,也不支持燃烧的性质,不能用燃着的木条来鉴别;故错误。 故选:C。 9.(1分)向盛有10g 49%稀硫酸的烧杯中加入5.6克的铁粉,充分反应后有固体残留,t1时迅速倒入一定量的硫酸铜溶液。整个过程烧杯中溶液的质量随时间的变化如图所示。下列说法正确的是( ) A.取a点溶液,加入锌粉,有气体放出 B.b点时,溶液中溶质只有一种 C.c点时,烧杯中固体一定是铜 D.m=12.7 【分析】根据铁与稀硫酸反应的质量比分析剩余的物质是铁,铁与稀硫酸反应溶液的质量增加;t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应溶液的质量减小进行分析。 【解答】解:由方程式: Fe+H2SO4═FeSO4+H2↑ 56 98 5.6g 10g×49% 可知,向盛有10g49%稀硫酸的烧杯中加入5.6g克的铁粉,铁粉有剩余,在t1时迅速倒入一定量的硫酸铜溶液,铁与硫酸铜反应溶液的质量减小, A、由上述分析和图象可知,a点时溶液中没有剩余的稀硫酸,加入锌粉,没有气体放出,故A错误; B、由图象可知,b点时溶液的质量还在减小,硫酸铜没有完全反应,溶液中溶质有硫酸亚铁和硫酸铜两种,故B错误; C、由于硫酸铜的量不能确定,可能有剩余的铁,c点时,烧杯中固体一定有铜,可能有铁,故C错误; D、设溶液的增量为x Fe+H2SO4═FeSO4+H2↑ 增量 56 98 2 56﹣2=54 10g×49% x = x=2.7g 所以m=10g+2.7g=12.7g,故D正确。 故选:D。 10.(1分)小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是( ) 温度/℃ 0 10 20 40 60 80 100 溶解度/g 182 191 204 238 287 362 487 A.配制的蔗糖溶液下层比上层甜 B.降温,糖水中一定有晶体析出 C.20℃时,蔗糖饱和溶液质量一定为304g D.升温,糖水中蔗糖的质量分数不变 【分析】A、根据溶液具有均一性,进行分析判断。 B、根据一杯蔗糖水(无固体剩余),可能是溶质质量分数很小的溶液,进行分析判断。 C、根据20℃时,蔗糖的溶解度为204g,进行分析判断。 D、根据蔗糖的溶解度随着温度的升高而增大,进行分析判断。 【解答】解:A、溶液具有均一性,配制的蔗糖溶液下层和上层一样甜,故选项说法错误。 B、一杯蔗糖水(无固体剩余),可能是溶质质量分数很小的溶液,降温,糖水中不一定有晶体析出,故选项说法错误。 C、20℃时,蔗糖的溶解度为204g,含义是20℃时,100g水中最多能溶解蔗糖204g,形成饱和溶液304g;但选项说法没有指明溶剂的质量,则20℃时,蔗糖饱和溶液质量不一定为304g,故选项说法错误。 D、蔗糖的溶解度随着温度的升高而增大,升温,蔗糖的溶解度增大,但溶液的组成没有发生改变,糖水中蔗糖的质量分数不变,故选项说法正确。 故选:D。 11.(1分)课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图,其中正确的是( ) A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素 C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的 【分析】A、根据酸能与碳酸盐反应生成二氧化碳气体,进行分析判断。 B、根据实验②是向碎鸡蛋壳中加入水和无色酚酞溶液,进行分析判断。 C、根据灼烧蛋壳后的生成物加入水之后,无色酚酞溶液变红色,进行分析判断。 D、根据使用胶头滴管滴加少量液体的方法进行分析判断。 【解答】解:A、实验①滴加食醋,产生气体,只能证明蛋壳成分可能是碳酸盐,不能证明蛋壳成分是CaCO3,故选项说法错误。 B、实验②是向碎鸡蛋壳中加入水和无色酚酞溶液,不变色,说明溶液不显碱性,不能证明蛋壳中含钙元素,故选项说法错误。 C、灼烧蛋壳后的生成物加入水之后,无色酚酞溶液变红色,说明得到的固体能与水反应,生成了碱性物质,故选项说法正确。 D、使用胶头滴管滴加少量液体的操作,注意胶头滴管不能伸入到试管内或接触试管内壁,应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,实验中不是每步操作都是规范的,故选项说法错误。 故选:C。 12.(1分)工业上常采用Cu与稀盐酸在持续通入空气的条件下制取CuCl2.其原理如图所示。下列说法正确的是( ) A.反应过程中需不断添加FeCl3溶液 B.该实验说明Cu能与稀盐酸发生置换反应 C.通入空气发生的反应为4FeCl2+O2+4HCl═4FeCl3+2H2O D.若反应恰好完全进行,将6.4g的铜完全反应,需消耗10.0%的盐酸146g 【分析】根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。 【解答】解:开始反应为4FeCl2+O2+4HCl═4FeCl3+2H2O,后来反应为Cu+2FeCl3=2FeCl2+CuCl2.总反应相当于为:O2+4HCl+2Cu=2H2O+2CuCl2。 A、由于反应过程中氯化铁是第一个反应的生成物,是第二个反应的反应物,所以不需要添加FeCl3溶液,故错误; B、整个过程可以看出是铜被氯化铁氧化,所以不能说是铜和盐酸发生置换反应,故错误; C、根据分析可知,通入空气发生的反应为4FeCl2+O2+4HCl═4FeCl3+2H2O,故正确; D、若反应恰好完全进行,将6.4g的铜完全反应,设需消耗10.0%的盐酸的质量为x O2+4HCl+2Cu=2H2O+2CuCl2。 146 128 10.0%x 6.4g x=73g。故错误; 故选:C。 二、本大题包括5小题,共28分 13.(6分) 垃圾分类,人人有责。 新华社北京6月3日电中共中央总书记、国家主席、中央军委主席习近平近日对垃圾分类工作作出重要指示。习近平强调,实行垃圾分类,关系广大人民群众生活环境,关系节约使用资源,也是社会文明水平的一个重要体现。垃圾中含有人类生存和从事生产劳动所需要的“半成品”。我们要变废为宝,保护好环境,首先我们每个人都要自觉地对垃圾进行分类。 (1)在垃圾回收中,我们提倡实行垃圾分类回收。下列物质中属于可回收垃圾的是 ABC 。 A.旧书、旧报纸 B.易拉罐 C.空矿泉水瓶 D.废弃的口罩 E.果皮 (2)我们的现代生活离不开电池,电池的使用能减少大气污染物和提高能量的转化效率,但废弃的电池(如含汞电池)却属于有害垃圾呢? 废弃的电池中含有汞、镉等有害离子 (文字叙述)。 (3)一些可燃性的垃圾可用于燃烧发电。 ①垃圾发电厂中的可燃性垃圾中通常含有较多的水分,我们一般可通过 增大可燃物与氧气的接触面积 等措施,促进可燃性垃圾完全燃烧,减少有害物质的产生; ②在燃烧过程中,可能会有二氧化硫气体产生,除去二氧化硫还可以用石灰乳吸收,写出石灰乳吸收二氧化硫的化学方程式 Ca(OH)2+SO2═CaSO3↓+H2O ; ③在综合反应塔和袋式除尘器之间的水平烟道中,喷入活性炭粉末,对残留的二噁英等有害有毒气体进行 吸附 。 (4)在我们一些农村中,将植物的秸秆和人、动物的排泄物加入沼气池中发酵产生沼气(主要成分是甲烷),甲烷在空气中完全燃烧的化学方程式 CH4+2O2CO2+2H2O 。 【分析】根据垃圾的类别、废弃电池中含有的物质、促进燃烧的方法、化学方程式的书写的知识进行分析解答即可。 【解答】解:(1)A.旧书、旧报纸属于可回收垃圾; B.易拉罐属于可回收垃圾; C.空矿泉水瓶属于可回收垃圾; D.废弃的口罩不属于可回收垃圾; E.果皮不属于可回收垃圾; 故填:ABC; (2)废弃的电池(如含汞电池)属于有害垃圾,是因为废弃的电池中含有汞、镉等有害离子,故填:废弃的电池中含有汞、镉等有害离子。 (3)①可燃性垃圾可通过增大可燃物与氧气的接触面积等措施,促进可燃性垃圾完全燃烧,减少有害物质的产生,故填:增大可燃物与氧气的接触面积; ②石灰乳吸收二氧化硫生成亚硫酸钙和水,化学方程式为Ca(OH)2+SO2═CaSO3↓+H2O,故填:Ca(OH)2+SO2═CaSO3↓+H2O; ③在除尘器之间的水平烟道中,喷入活性炭粉末,可以对残留的二噁英等有害有毒气体进行吸附,故填:吸附。 (4)沼气的主要成分是甲烷,甲烷在空气中完全燃烧生成二氧化碳和水,化学方程式为CH4+2O2CO2+2H2O,故填:CH4+2O2CO2+2H2O。 14.(9分)实验室里现有氯酸钾、稀盐酸、石灰石、澄清石灰水、火柴、药匙、镊子以及如图仪器: (1)利用上述药品,若要补充一种仪器 长颈漏斗 ,可制取、检验进而收集二氧化碳,除补充的仪器外还需要的仪器有 ①②④⑥ (填序号),则发生装置内反应的化学方程式为 CaCO3+2HCl=CaCl2+H2O+CO2↑ 。 (2)若想利用上述实验用品制取氧气,还需补充一种药品 MnO2 (填化学式),仪器④在该实验中用于 收集和贮存少量氧气 。 (3)收集完氧气后接下来的操作是先 将导管移出水面(或水槽) ,然后再 停止加热(或熄灭酒精灯) ,如果操作顺序颠倒,试管内气体温度会 降低 (填升高或降低),试管内气体压强会 变小,小于外界压强(或大气压) ,在压强差作用下,水就会倒吸入试管,试管因骤然冷却而炸裂。 【分析】(1)仪器的名称;实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集。 (2)制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热。氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集。 (3)收集完氧气后接下来的操作是先将导管移出水面(或水槽),然后再停止加热(或熄灭酒精灯),如果操作顺序颠倒,试管内气体温度会降低,试管内气体压强会变小,小于外界压强(或大气压),在压强差作用下,水就会倒吸入试管,试管因骤然冷却而炸裂。 【解答】解:(1)利用上述药品,若要补充一种仪器长颈漏斗,可制取、检验进而收集二氧化碳,除补充的仪器外还需要的仪器有①试管②锥形瓶④集气瓶⑥带导管的双孔橡皮塞;碳酸钙和氯化氢反应生成氯化钙和水和二氧化碳,配平即可;故答案为:长颈漏斗;①②④⑥;CaCO3+2HCl=CaCl2+H2O+CO2↑; (2)若想利用上述实验用品制取氧气,还需补充一种药品二氧化锰;仪器④在该实验中用于:收集和贮存少量氧气;故答案为:MnO2;收集和贮存少量氧气; (3)收集完氧气后接下来的操作是先将导管移出水面(或水槽),然后再停止加热(或熄灭酒精灯),如果操作顺序颠倒,试管内气体温度会降低,试管内气体压强会变小,小于外界压强(或大气压),在压强差作用下,水就会倒吸入试管,试管因骤然冷却而炸裂;故答案为:将导管移出水面(或水槽);停止加热(或熄灭酒精灯);降低;变小,小于外界压强(或大气压)。 15.(5分)用黑钨矿(主要含FeWO4)制得金属钨(W)的主要工艺流程如图: 已知:Na2WO4溶液为无色:H2WO4是一种不溶于水的黄色固体:WO3难溶于水。 (1)将黑钨矿石碾成粉末,目的是 增大反应物接触面积,加快反应速率 。 (2)压煮器中,发生反应为4Na2CO3+4FeWO4+O24Na2WO4+2Fe2O3+4R,R的化学式为 CO2 。 (3)酸浸槽中,Na2WO4溶液和浓盐酸发生复分解反应,该反应的化学方程式为 Na2WO4+2HCl(浓)=H2WO4↓+2NaCl 。 (4)焙烧炉中,焙烧H2WO4的反应属于 分解反应 (填基本反应类型)。 (5)还原炉中,H2与WO3发生置换反应得到W,反应中化合价升高的元素是 氢元素 。 【分析】反应物接触面积越大、温度越高,反应速率越快; 化学反应前后原子种类、总个数和质量都不变; Na2WO4溶液和浓盐酸发生复分解反应生成H2WO4沉淀和氯化钠; 高温条件下H2WO4分解生成三氧化钨和水; 一定条件下三氧化钨和氢气反应生成钨和水。 【解答】解:(1)将黑钨矿石碾成粉末,目的是增大反应物接触面积,加快反应速率。 故填:增大反应物接触面积,加快反应速率。 (2)由质量守恒定律可知,反应前后钠原子都是8个,铁原子都是4个,钨原子都是1个,反应前氧原子是30个,反应后应该是30个,其中8个包含在4R中,反应前碳原子是4个,反应后应该是4个,包含在4R中,R的化学式为CO2。 故填:CO2。 (3)酸浸槽中,Na2WO4溶液和浓盐酸发生复分解反应生成H2WO4沉淀和氯化钠,该反应的化学方程式为:Na2WO4+2HCl(浓)=H2WO4↓+2NaCl。 故填:Na2WO4+2HCl(浓)=H2WO4↓+2NaCl。 (4)焙烧炉中,焙烧H2WO4生成三氧化钨和水,是分解反应。 故填:分解反应。 (5)还原炉中,H2与WO3发生置换反应得到W,反应中化合价升高的元素是氢元素,即氢元素由0变成+1。 故填:氢元素。 16.(10分)为了探究酸和碱之间的反应,某化学兴趣小组的同学进行了以下实验。 实验l:甲同学向盛有少量NaOH溶液的试管中滴入几滴无色酚酞试液,振荡,继续加入稀硫酸,观察到溶液由 红 色变成无色。得出结论:酸和碱能发生反应。该反应的化学方程式是 2NaOH+H2SO4=Na2SO4+2H2O ,从微观角度分析,该反应的实质是 氢离子与氢氧根离子结合生成水分子 。 实验2:如图所示的是乙同学利用数字传感器,测定稀盐酸氢氧化钠溶液反应的过程中溶液的pH的变化曲线。 (1)实验2进行的操作是 ② (填序号)。 ①将稀盐酸逐滴加入氢氧化钠溶液中 ②将氢氧化钠溶液逐滴加入稀盐酸中 (2)点c表示的含义是 c点处的溶液pH=7,反应签好完全 。 (3)d点对应的溶液中的溶质是 NaCl、NaOH (填化学式)。 实验3:甲同学在做完实验后所得的无色液体中的溶质除了酚酞外。还有什么?请你作出猜想并设计用两种不同的方案进行验证。 【作出猜想】猜想1:NaCl;猜想2:NaCl和 HCl 。 【设计实验】方案1: 取样于试管中,测定溶液的pH,若pH=7,则猜想1成立,若pH<7,则猜想2成立 。 方案2: 取样于试管中,滴加几滴紫色的石蕊试液,若溶液变红色,则猜想2成立;若溶液的颜色没有变化,则猜想1成立 。 【分析】实验1:根据酚酞试液的变色情况、化学反应的基本原理、中和反应的实质来分析解答; 实验2:(1)根据溶液的pH变化情况来分析; (2)根据c点的pH来分析; (3)根据d点的pH来分析; 实验3:根据物质的检验方法来分析。 【解答】解:实验1:氢氧化钠溶液显碱性,能使无色的酚酞试液变红色,随着硫酸的滴加,溶液的pH变小,当滴加的硫酸恰好将氢氧化钠完全中和时,溶液呈中性,溶液变成无色;氢氧化钠与硫酸反应生成硫酸钠和水;反应的实质是氢离子与氢氧根离子结合生成水分子;故填:红;2NaOH+H2SO4=Na2SO4+2H2O;氢离子与氢氧根离子结合生成水分子; 实验2:(1)由图象可知,溶液的pH变化情况是由小于7,到等于7,到大于7,所以是向酸中滴加碱,故填:②; (2)c点的p=7,说明反应恰好完全;故填:c点处的溶液pH=7,反应签好完全; (3)d点所示溶液的pH>7,显碱性,说明溶液中既有氯化钠,还有氢氧化钠;故填:NaCl、NaOH; 实验3:甲同学在做完实验后所得的无色液体中的溶质除了酚酞外,还有氯化钠,可能有HCl;可以通过测定溶液的pH来进行检验,取样于试管中,测定溶液的pH,若pH=7,则猜想1成立,若pH<7,则猜想2成立;还可以用紫色的石蕊试液来检验,取样于试管中,滴加几滴紫色的石蕊试液,若溶液变红色,则猜想2成立;若溶液的颜色没有变化,则猜想1成立;故填:【作出猜想】HCl; 【设计实验】取样于试管中,测定溶液的pH,若pH=7,则猜想1成立,若pH<7,则猜想2成立; 取样于试管中,滴加几滴紫色的石蕊试液,若溶液变红色,则猜想2成立;若溶液的颜色没有变化,则猜想1成立。 17.(8分)现有20g氯化钠和碳酸氢钠的固体混合物,将其放入烧杯中,再加入125.8g稀盐酸,恰好完全反应,反应后所得溶液的质量为137g。(温馨提示:化学反应方程式为NaHCO3+HCl═NaCl+H2O+CO2↑) 请计算并回答下列问题: (1)反应中生成气体的质量是 8.8 g。 (2)固体混合物中碳酸氢钠的质量分数是多少? 【分析】碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,根据反应的化学方程式及其提供数据可以进行相关方面的计算。 【解答】解:(1)反应中生成气体的质量是:20g+125.8g﹣137g=8.8g。 (2)设碳酸氢钠质量为x, NaHCO3+HCl═NaCl+H2O+CO2↑, 84 44 x 8.8g =, x=16.8g, 固体混合物中碳酸氢钠的质量分数是:×100%=84%, 答:固体混合物中碳酸氢钠的质量分数是84%。查看更多