- 2021-11-10 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
九年级化学(人教版下册)第9单元课题2溶解度教案
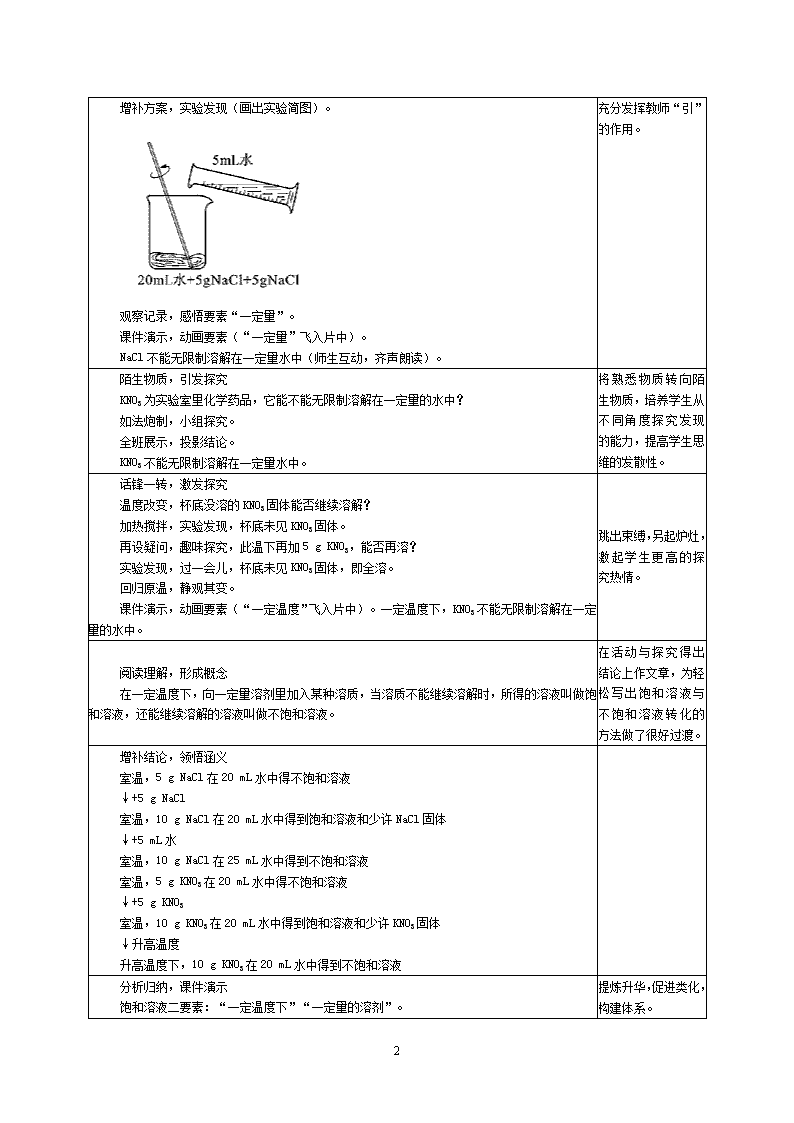
1 第九单元 溶液 课题 2 溶解度(第一课时) 教学目标 通过实验探究,建立饱和溶液与不饱和溶液的概念,了解饱和溶液与不饱和溶液的相互转化的方法, 了解结晶现象。 初步培养活动与探究的一般程序:提出问题→建立假设→设计方案(画出实验简图)→动手实验→ 观察记录→分析现象→得出结论。 通过实验条件的改变,让学生感受饱和溶液与不饱和溶液的存在和转化是有条件的,逐步建立用辩 证的、发展的思想观点来看待事物的变化,和逐步培养由具体到一般认识事物过程的能力,并培养学生互 相协作、友好相处的健康心态。 重点和难点 饱和溶液的涵义及“活动与探究”。 实验准备 将全班学生分成若干小组,每小组不超过 5 人。 每组准备器材:烧杯 2 个(各装 20 mL 水)、玻璃棒 1 根、5 g NaCl(预先称好)、5 g KNO3 4 包 (预先称好)、酒精灯、铁架台(带铁圈)、石棉网、火柴、量筒、胶头滴管。 CAI 课件、实物投影仪。 教学设计 教学过程 点评 激趣设境,问题导入 师生互动:俗话说:“饭前喝汤,苗条漂亮;饭后喝汤,肥胖晃晃。”妈妈在家为小槐同学 准备了一碗汤,小槐一尝淡了,要妈妈加 (盐);小槐一尝还说淡了,又要妈妈 加 (盐);小槐一尝还是说淡了,再要妈妈加 (盐)……食盐是我们 熟悉的物质,它是否无限制地溶解在一定量的水中呢? 以俗语作导语,由生 活经验作铺垫,学生 感到自然亲切,着力 创设快乐课堂。 问题探究,得出结论 小组讨论,提出假设。 NaCl 能(不能)无限制溶解在一定量的水中。 阅读 P33,确定方案(画出实验简图)。 投影方案,交流共享。 动手实验,观察记录。 上台展示,投影结论。 ①5 g NaCl 能溶解在 20 mL 水中;②10 g NaCl 不能溶解在 20 mL 水中,杯底有少许固体 NaCl。 即 NaCl 不能无限制溶解在一定量水中。 误导结论,延伸探究。 “NaCl 不能无限制溶解在水中”这句话是否正确?教师有意漏读“一定量”三个字,引起 学生质疑猜想。 方案源于教材,形式 却别于教材,更显直 观、生动。 注重交流合作,掌握 直观区分“溶”与 “ 不 溶 ” 的 依 据 ──杯底是否有未 溶固体溶质。 通过追究教师“疏 忽”增补方案,动手 实验,使学生关注、 重视“一定量”这 2 增补方案,实验发现(画出实验简图)。 观察记录,感悟要素“一定量”。 课件演示,动画要素(“一定量”飞入片中)。 NaCl 不能无限制溶解在一定量水中(师生互动,齐声朗读)。 个要素。充分发挥教 师“引”的作用。 陌生物质,引发探究 KNO3 为实验室里化学药品,它能不能无限制溶解在一定量的水中? 如法炮制,小组探究。 全班展示,投影结论。 KNO3 不能无限制溶解在一定量水中。 将熟悉物质转向陌 生物质,培养学生从 不同角度探究发现 的能力,提高学生思 维的发散性。 话锋一转,激发探究 温度改变,杯底没溶的 KNO3 固体能否继续溶解? 加热搅拌,实验发现,杯底未见 KNO3 固体。 再设疑问,趣味探究,此温下再加 5 g KNO3,能否再溶? 实验发现,过一会儿,杯底未见 KNO3 固体,即全溶。 回归原温,静观其变。 课件演示,动画要素(“一定温度”飞入片中)。一定温度下,KNO3 不能无限制溶解在一定 量的水中。 跳出束缚,另起炉 灶,激起学生更高的 探究热情。 阅读理解,形成概念 在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得的溶液叫做饱 和溶液,还能继续溶解的溶液叫做不饱和溶液。 在活动与探究得出 结论上作文章,为轻 松写出饱和溶液与 不饱和溶液转化的 方法做了很好过渡。 增补结论,领悟涵义 室温,5 g NaCl 在 20 mL 水中得不饱和溶液 ↓+5 g NaCl 室温,10 g NaCl 在 20 mL 水中得到饱和溶液和少许 NaCl 固体 ↓+5 mL 水 室温,10 g NaCl 在 25 mL 水中得到不饱和溶液 室温,5 g KNO3 在 20 mL 水中得不饱和溶液 ↓+5 g KNO3 室温,10 g KNO3 在 20 mL 水中得到饱和溶液和少许 KNO3 固体 ↓升高温度 升高温度下,10 g KNO3 在 20 mL 水中得到不饱和溶液 分析归纳,课件演示 饱和溶液二要素:“一定温度下”“一定量的溶剂”。 提炼升华,促进类 化,构建体系。 3 深化探究,激活思维 室温下,10 g KNO3 在 20 mL 水中溶液达到饱和,升高温度,杯底 KNO3 固体继续溶解,且又 溶解了 5 g KNO3;冷却到室温,20 mL 水溶解 KNO3 的质量不超过 10 g,此时多余的 KNO3 会怎样? (观察杯中 KNO3 晶体和课本上图 9-11,阅读感悟,请生上台投影 KNO3 晶体) 探究发现,联想顿悟 观察玻璃片上的白色斑迹。 观察教材上从海水中提取食盐过程图。 联想:炒菜时,菜汤在锅里蒸发,锅底上有白色斑迹;运动出汗衣服上会出现白色斑迹…… 学以致用,趣味延伸 练习:教材 P40,习题 1、5、6。 家庭小实验:制取白糖晶体(P39)。 创设新的问题情境, 培养学生求异思维, 提升学生质疑能力。 4 第九单元 溶液 课题 2 溶解度(第二课时) 教学目标 了解固体物质溶解度的涵义。 会利用溶解性表或溶解度曲线,查阅相关物质的溶解性或溶解度,能依据给定的数据绘制溶解度曲 线。 知道影响气体溶解度的一些因素。会利用有关气体溶解度的知识解释身边的一些现象。重点和难点 重点:利用溶解度曲线获得相关信息。 难点:固体物质溶解度的涵义;利用溶解度曲线获得相关信息。 实验准备 投影仪、坐标纸、汽水两瓶、火柴、带导管的橡皮塞、试管、澄清的石灰水。 教学设计 教学过程 点评 教师:我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱,那里的农民冬天捞 碱,夏天晒盐,你知道为什么吗? 学生:(议论纷纷) 教师:你可能暂时还不知道为什么。 学习了今天的知识后,你就会从中找到答案。 在前面的活动与探究中,所用的水均为 20 mL,其中溶解 NaCl 与 KNO3 的质量是否 相同? 学生甲:不相同。 乙:不加热时,二者相近。 丙:加热后,等量水中溶解的 KNO3 要多。 教师:大家回答得都很好。我们如何来定量地描述 KNO3 与 NaCl 在水中的溶解性 强弱呢? 学生:溶解度。 教师:这位同学回答得不错。什么叫溶解度呢?请同学们阅读教材。找出溶解度 的概念。 学生:(大声朗读)(教师板书) 溶解度:在一定温度下,某固态物质在 100 g 溶剂(通常溶剂为水)里达到饱和 状态时所溶解的质量。 教师:在教材 P36,表 9-1,给出了几种物质在不同温度时的溶解度,请大家查 一查 20 ℃时 NaCl 的溶解度。 学生甲:(很快找出答案)36.0。 乙:不对,应该是 36.0 g,溶解度有单位,单位是 g。 设置悬念,激发学 生的求知欲。 教师:(表扬乙,肯定甲)乙同学回答得很准确,溶解度有单位。“在 20 ℃时, NaCl 的溶解度为 36.0 g。”这句话所表达的含义是什么呢? 学生:(踊跃发言) 甲:在 20 ℃时,36.0 gNaCl 在 100 g 水中溶解达到饱和状态。 乙:在 20 ℃时,100 g 水中最多能溶解 36.0 g NaCl。 让学生 体验成功 后的喜悦。 教师:同学们回答得都不错,溶解度的概念包括四个要素: ①指明一定温度;②溶剂为 100 g;③必须达到饱和状态;④单位为 g。 及时小结,纠正偏 差。 学习了溶解度的概念,下面我们一起来做一个练习,相信你会做! 鼓励学 生大胆尝 试。 5 巩固练习(投影)。 查表 9-1,完成下列练习。 1 20 ℃时,KNO3 的溶解度为 ,60 ℃时 KNO3 饱和溶液中,溶质与溶剂 的质量比为 。 2 下列有关 NaCl 的溶解度,说法正确的是( ) A 20 ℃时,18.0 g NaCl 溶解在 50 g 水中达到饱和状态,20 ℃时,NaCl 的溶 解度为 18.0 g。 B 36.0 g NaCl 溶解在 100 g 水中达到饱和状态,NaCl 的溶解度为 36.0 g C 20 ℃时,36.0 g NaCl 溶解在 100 g 水中,20 ℃时,NaCl 的溶解度为 36.0 g D 20 ℃时,100 g 水中最多能溶解 36.0 g NaCl,20 ℃时,NaCl 的溶解度为 36.0 g。 (教师巡回指导后,请学生代表说出答案,简单点评) 通过习题,及时巩 固新知。 教师:我们在学习过程中,往往会遇到“易溶”“微溶”“难溶”等一些概念, 它表示什么意思呢?学生通过阅读 P36“资料”寻找答案。 我们知道,影响固体物质溶解度大小的因素主要是温度,同一物质在水中的溶解 度随温度的变化而变化,这种变化关系可以用物质的溶解度曲线来表示。 鼓励学 生自主学 习。 活动与探究:学习绘制物质溶解度曲线的方法。 教师简单介绍方法,学生结合表 9-1 分组绘制 NaCl、KCl、KNO3 的溶解度曲线, 教师巡回指导,然后展示交流,分享快乐,结合学生绘制的溶解度曲线及教材中图 9-12, 分组讨论、交流。 (投影) ①你所绘制的溶解度曲线有何特点,为什么? ②从你绘制的溶解度曲线图上能否找出上述几种物质在 25 ℃、85 ℃时的溶解 度?如果能,请找出,你是怎样查找的? ③从图中,你能比较出 45 ℃时 KCl、KNO3 的溶解度大小吗? ④从溶解度曲线中,你能获得哪些信息? (学生汇报展示,教师小结归纳) 教师:通过溶解度曲线,可以判断固体物质的溶解度受温度影响的变化情况,可 以比较不同物质在同一温度时溶解度的大小,也可以查出同一种物质在不同温度时的溶 解度。 巩固练习(投影) 亲自动手,自主参 与,乐于探究。 教师:除了固体物质能溶解在水中外,生活中气体溶解在水中的现象也很多,你 能举出一些实例吗? 学生甲:鱼儿能在水中生存,说明水中有 O2。 乙:烧开水时,水未沸腾时也冒气泡。 丙:把汽水瓶打开,有大量气泡产生。 教师:同学们都很善于思考,以上现象均说明了气体能溶解在水中的事实。(展 示两瓶汽水,取其中一瓶不打开,摇晃,然后打开,学生观察现象) 教师:你能观察到什么现象? 学生:不打开时,无明显现象,打开后有大量气泡产生。 教师:为什么打开后产生气泡,而不打开时没有。 学生:打开后,压强减小,CO2 在水中的溶解度减小。 教师:这说明气体的溶解度受压强的影响。压强增大,气体溶解度增大;压强减 小,溶解度减小。 联系生活实际,引 出新知 ,气氛活 跃。 6 刚才一位同学说汽水中冒出的气体为 CO2,你能用实验方法将其检验出来吗? 学生:(上台演示) 教师:(加以肯定,给予激励性评价)烧开水时,水未开时就看到水中冒气泡, 这些气泡是什么?(贴近生活) 学生:水中溶解的空气。 教师:这说明气体的溶解度受温度的影响,温度升高,气体的溶解度变小。 教师小结:气体的溶解度受温度与压强的影响。 教师:我们学习化学知识的目的就是为了利用,解决我们所遇到的一些实际问题。 现在问题来了! 鼓励学 生动手实 践。 巩固练习:(投影)夏天,阵雨来临之前,鱼塘里的鱼常会出现“浮头”现象, 你知道为什么吗?假如你承包了这个鱼塘,你将采取哪些措施? 教师:(肯定学生的种种措施) 整理与归纳:(师生共同进行) 怎样表示固体物质溶解性的大小?如何表示溶解度与温度的关系?通过溶解度 曲线我们可获得哪些信息?影响气体的溶解度的因素有哪些? 课后练习 利用所学,解决问 题,关注生活。查看更多